

(图片来源:J. Am. Chem. Soc.)
正文
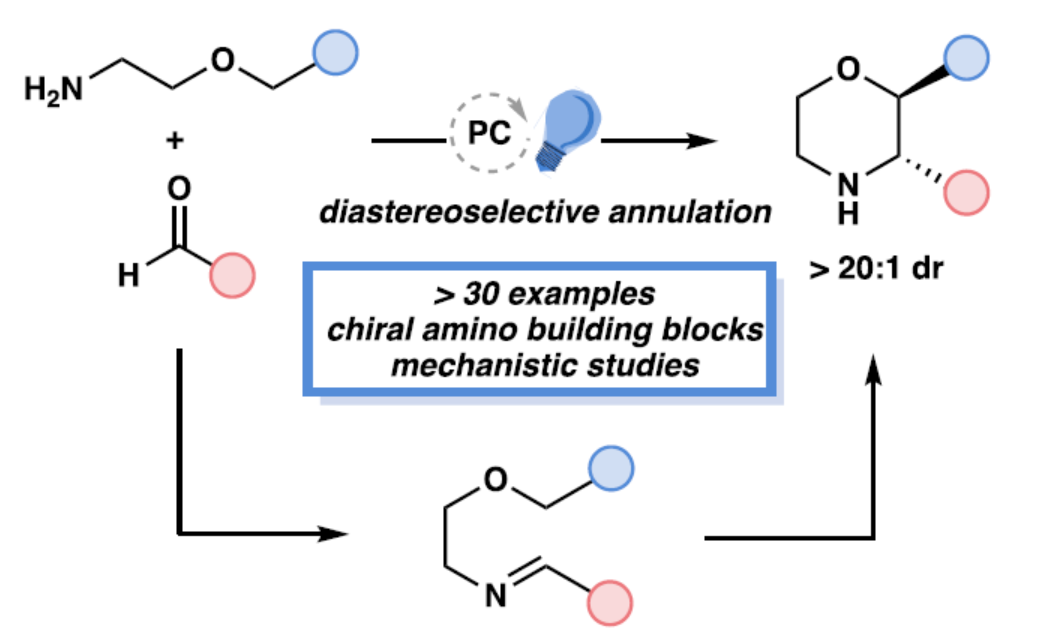
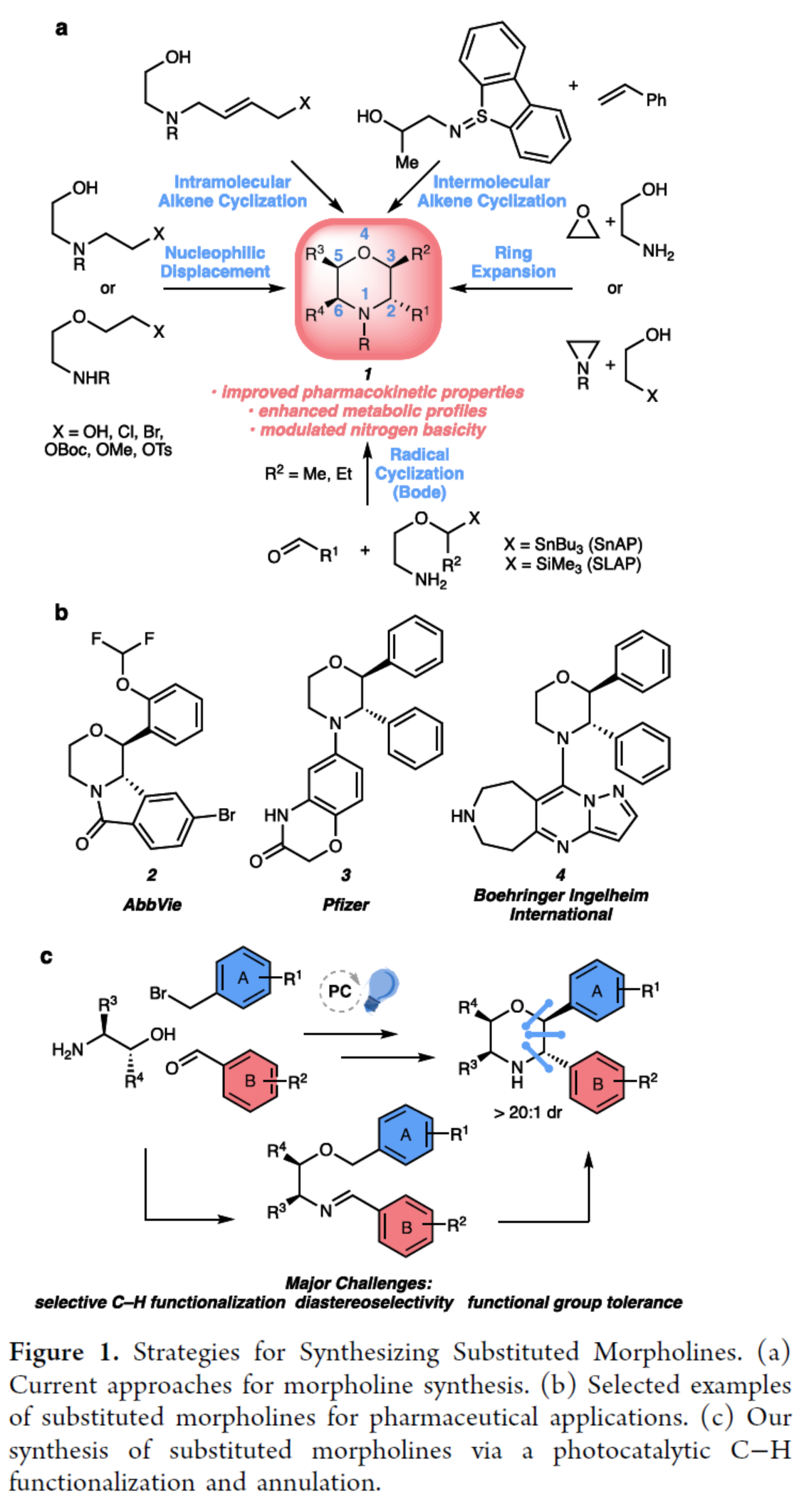
N-杂环骨架广泛存在于各类已上市的药物分子等中。其中,吗啉(1)具有许多类似药物的物理性质,如良好的溶解性、渗透性和稳定性,从而使其成为具有药用价值的N-杂环化合物(Figure 1a)。前期,化学家们开发了多种合成取代吗啉的方法,如亲核置换、环扩张、分子内和分子间烯烃的环化以及自由基环化(Figure 1a)。然而,上述的反应常需在氮原子上引入保护基团,并且仅能形成一个手性中心。此外,2,3-trans-二取代吗啉(2−4)在药物发现中是一类先导化合物。目前,吗啉的非对映选择性合成领域最先进的方法是Bode团队开发的SnAP(锡胺策略)和SLAP(硅胺策略)反应,这些方法避免了上述合成途径的局限性(Figure 1a)。然而,该策略依赖经锡基和硅基基团预官能团化的试剂,且需经多步合成,从而限制了吗啉产物中官能团的类型及取代模式。同时,Bode方法在底物范围中存在一个显著缺点,即无法以高度非对映选择性的方式合成2,3-二取代吗啉类化合物,而这类结构对于获得二取代吗啉分子(2−4)至关重要。近日,美国德克萨斯大学西南医学中心Uttam K. Tambar与比利时鲁汶大学Ludovic Troian-Gautier团队开发了一种模块化策略,利用易得起始原料可直接制备具有多样化取代模式的官能团化吗啉衍生物(Figure 1c)。该策略通过非对映选择性的光催化C–H键官能团化/成环反应,实现了对多个未保护官能团化吗啉的快速合成,并为复杂吗啉骨架的构建提供了通用断键策略。此外,该策略还可实现其它N-杂环化合物的合成,如哌啶和吡咯烷衍生物。欢迎下载化学加APP到手机桌面,合成化学产业资源聚合服务平台。
(图片来源:J. Am. Chem. Soc.)
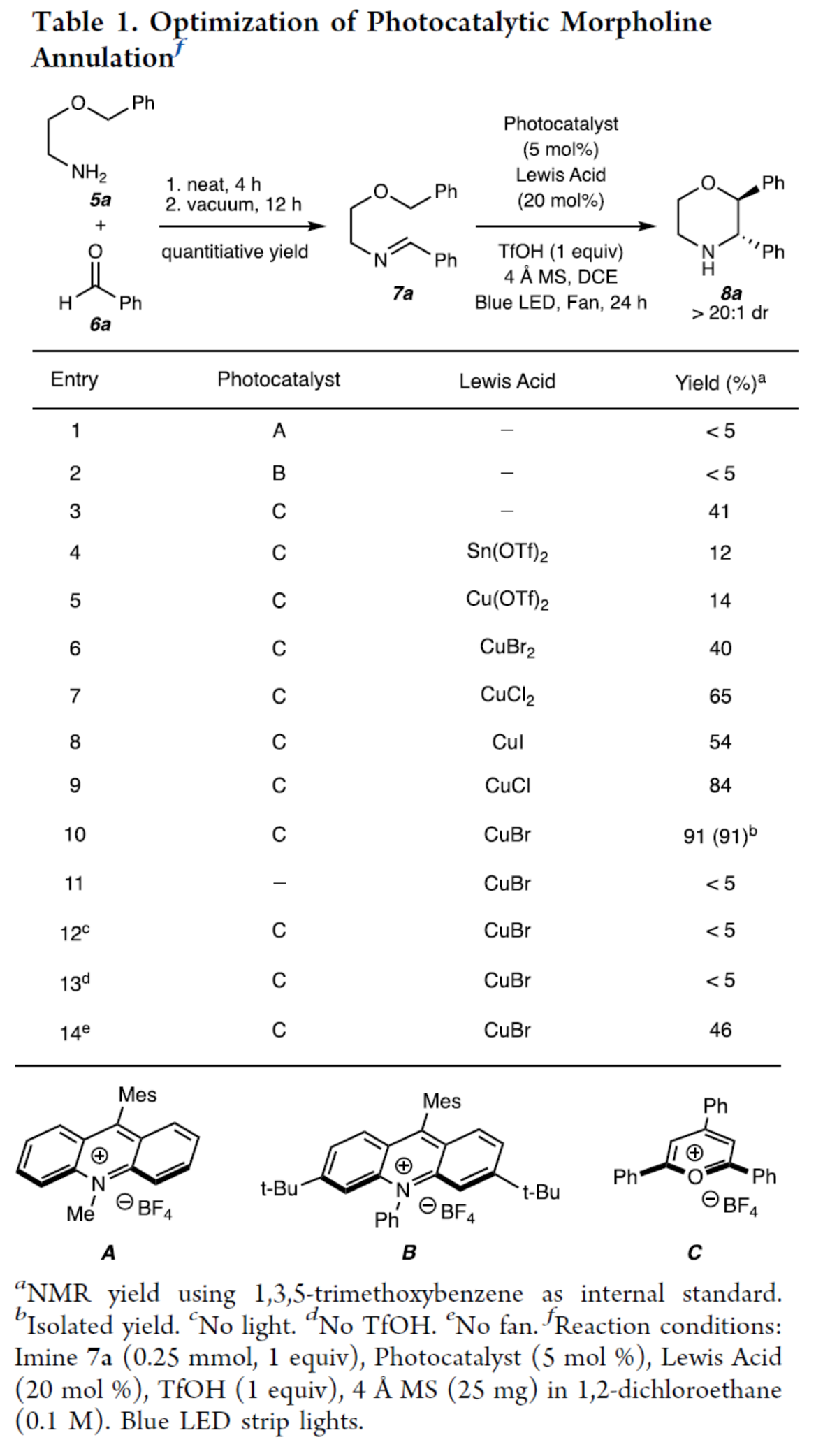
首先,作者以2-苄氧基-1-乙胺(5a)与苯甲醛(6a)经缩合反应生成的亚胺中间体(7a)作为模型底物,对反应条件进行了筛选(Table 1)。当以2,4,6-三苯基吡喃鎓四氟硼酸盐(C,TPP·BF4)(5 mol %)作为光催化剂,CuBr(20 mol %)作为Lewis酸,TfOH(1.0 equiv)作为Brønsted酸,4 A MS作为添加剂,蓝色LED(467 nm)作为光源,在DCE溶剂中反应,可以91%的收率得到吗啉产物8a,dr > 20:1。
(图片来源:J. Am. Chem. Soc.)
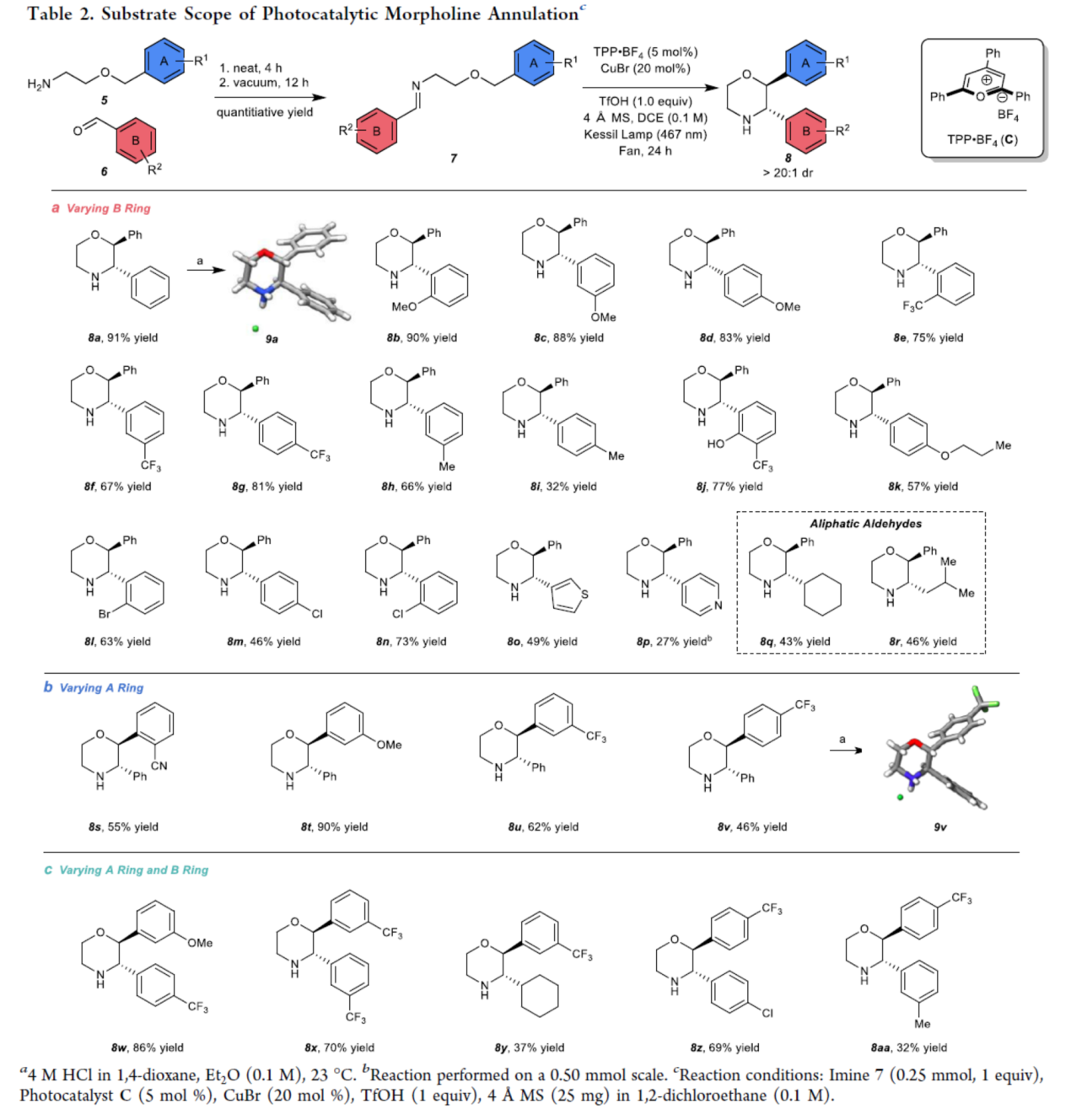
在获得上述最佳反应条件后,作者对底物范围进行了扩展(Table 2)。首先,一系列不同电性取代的苯甲醛与杂芳基醛,均可顺利反应,获得相应的产物8a-8p,收率为27-91%。同时,脂肪族醛,也是合适的底物,如8q(收率为43%)和8r(收率为46%)(Table 2a)。其次,当2-苄氧基-1-乙胺底物5中的芳基上含有-CN、-OMe与-CF3时,也能够顺利进行反应,获得相应的产物8s-8v,收率为27-91%。其中,吗啉产物8v主要非对映异构体的相对立体化学通过9vHCl盐的X-射线晶体分析得到证实(Table 2b)。此外,作者还合成了其它几种2,3-二取代吗啉,其中A和B环都被取代,如8w-8z和8aa,收率为32-86%(Table 2c)。
(图片来源:J. Am. Chem. Soc.)
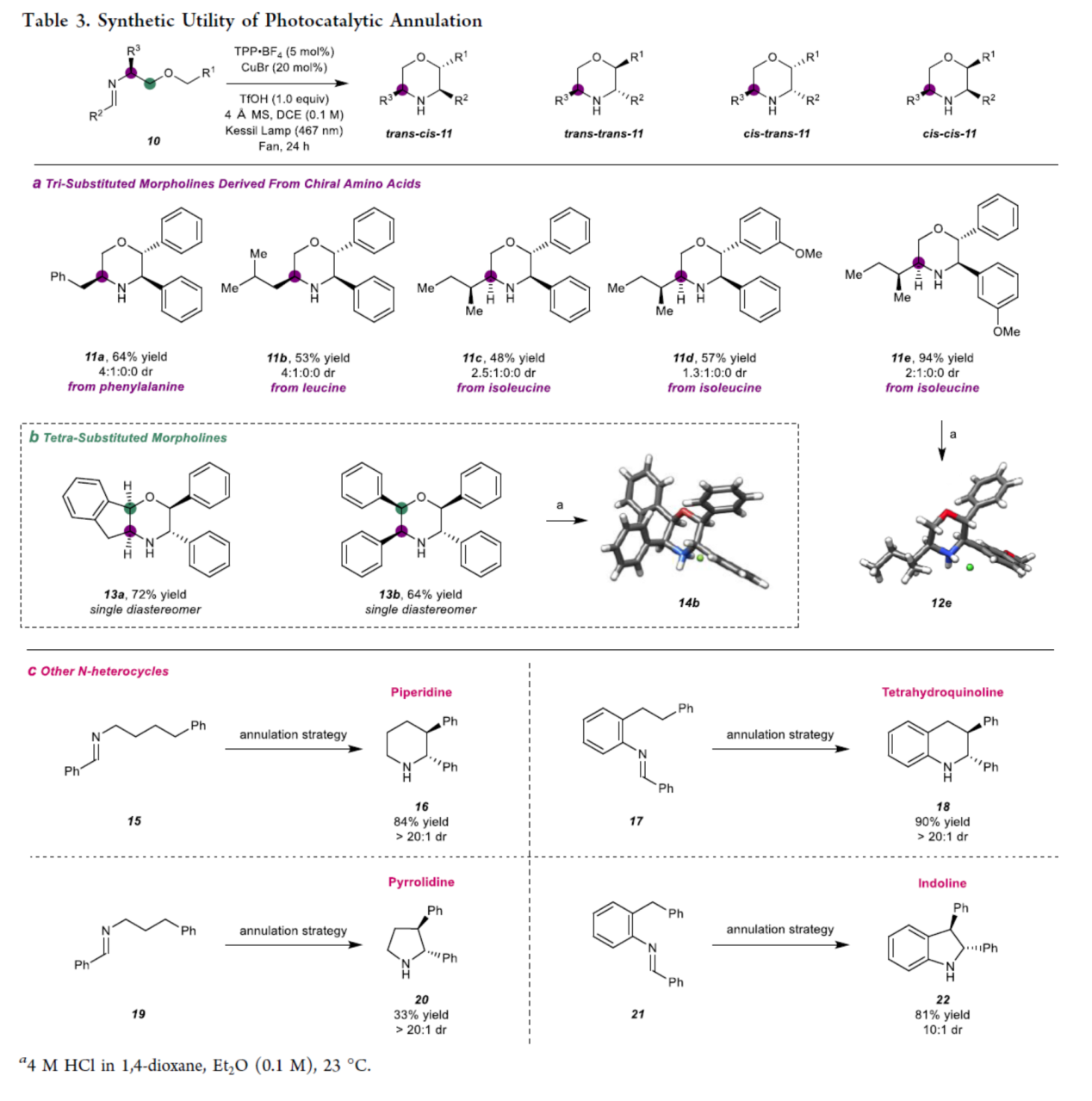
紧接着,作者对反应的实用性进行了研究(Table 3)。首先,采用手性氨基酸生成的亚胺中间体(10)为底物,可进一步合成三取代吗啉(11)中4种潜在立体异构体,如trans−cis、trans−trans、cis− trans和cis−cis。例如,苯丙氨酸、亮氨酸、异亮氨酸衍生的亚胺中间体,均可顺利进行反应,获得相应的三取代吗啉产物11a-11e,收率为48-94%,dr为1.3:1:0:0-4:1:0:0(Table 3a)。其次,采用(1R,2S)-(+)-cis-1-氨基-2-茚醇衍生的亚胺中间体为底物,还可以72%的收率得到单一非对映体的四取代吗啉产物13a。类似的,采用(1R,2S)-(−)-2-氨基-1,2-二苯乙醇为底物,可以64%的收率得到单一非对映体的四苯基取代吗啉产物13b(Table 3b)。此外,利用上述的环化策略,作者还合成了几种N-杂环化合物,如无保护的哌啶(16)、四氢喹啉(18)、吡咯烷(20)和吲哚啉(22)(Table3c)。
(图片来源:J. Am. Chem. Soc.)
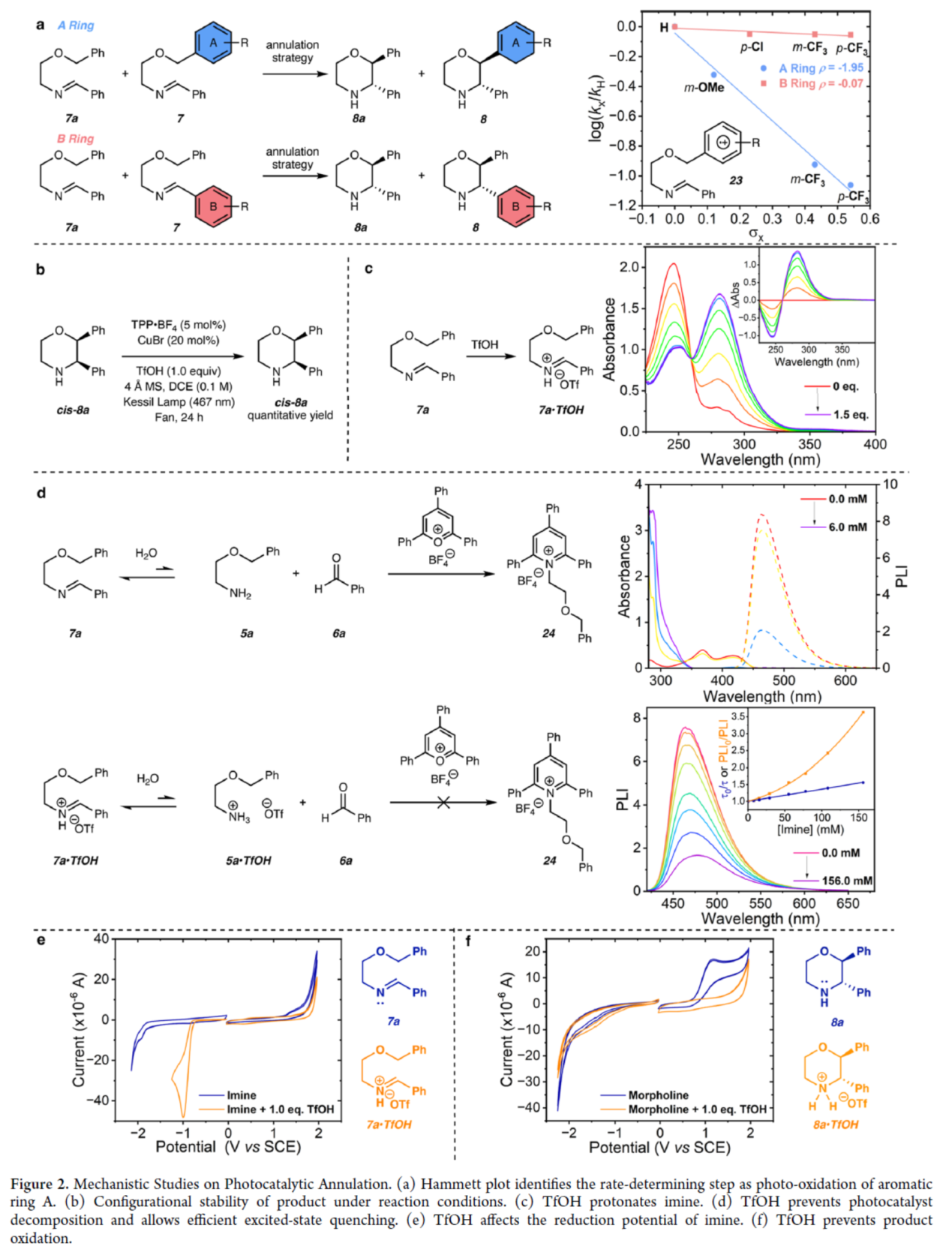
随后,作者还对反应机理进行了进一步的研究(Figure 2)。首先,Hammett图研究结果表明,反应的速率决定步骤是A环光化学氧化时形成自由基阳离子中间体(23)的过程(Figure 2a)。反应条件下产物的构型稳定性研究结果表明,trans-吗啉类化合物的高非对映选择性并非源自光催化的差向异构化(Figure 2b)。其次,UV−vis滴定实验表明,TfOH可完全质子化亚胺(7a),形成亚胺离子(7a·TfOH)(Figure 2c)。同时,TfOH可以防止光催化剂分解,并允许有效的激发态淬灭(Figure 2d)。此外,CV实验结果表明,TfOH可能会影响亚胺(7a)的还原电位(Figure 2e),并且TfOH可防止吗啉产物的氧化(Figure 2f)。
(图片来源:J. Am. Chem. Soc.)
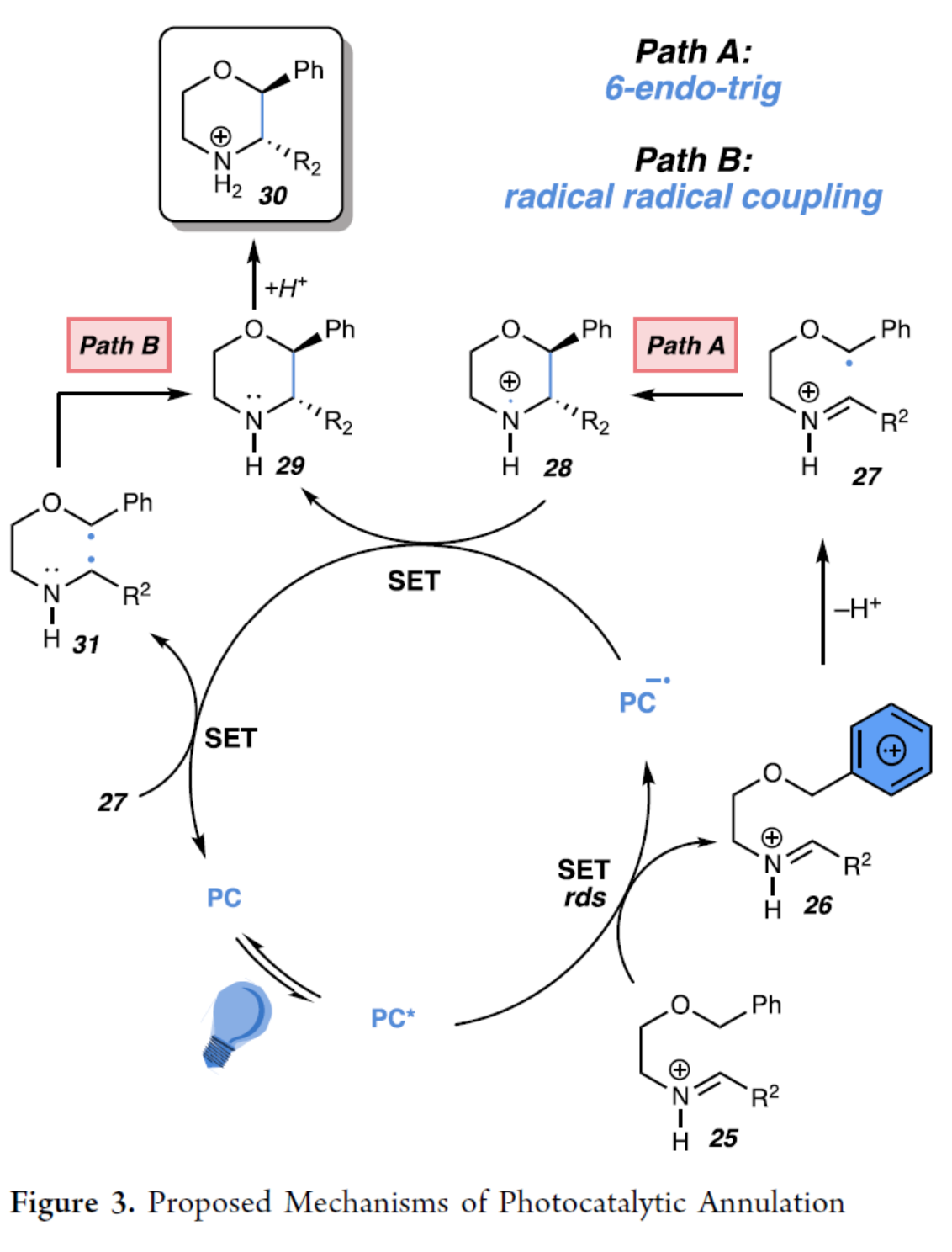
基于上述的研究以及相关文献的查阅,作者提出了一种合理的催化循环过程(Figure3)。首先,在TfOH存在下,亚胺(7a)质子化后生成亚胺离子(25)。光催化剂C的激发态寿命足以与亚胺离子(25)进行双分子电子转移,生成单还原光催化剂和氧化自由基阳离子(26),其中自由基位于A环上。Hammett图分析显示,氧化自由基阳离子(26)的形成是速率决定步骤。其次,自由基阳离子(26)经去质子化,生成形成苄基自由基(27)。现阶段,作者提出了两种可能得途径。在Path A中,苄基自由基(27)经6-endo-trig环化,生成氮基自由基阳离子(28)。随后,通过单电子还原从而生成吗啉产物(29),并再生光催化剂C,以完成催化循环。吗啉与TfOH的质子化产生中间体(30),可防止产物发生不希望的氧化。在Path B中,苄基自由基(27)经单电子还原以,生成双自由基中间体(31),并再生光催化剂C。随后,双自由基中间体(31)经自由基-自由基偶联,从而获得吗啉产物(29)。此外,基于热力学上有利氮基自由基阳离子的生成、光诱导电子转移后生成低浓度的自由基将有利于分子内6-endo-trig环化以及亚胺离子在热力学上不利于还原等因素,Path A更为合理。
(图片来源:J. Am. Chem. Soc.)
总结
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn