

(图片来源:J. Am. Chem. Soc.)
正文
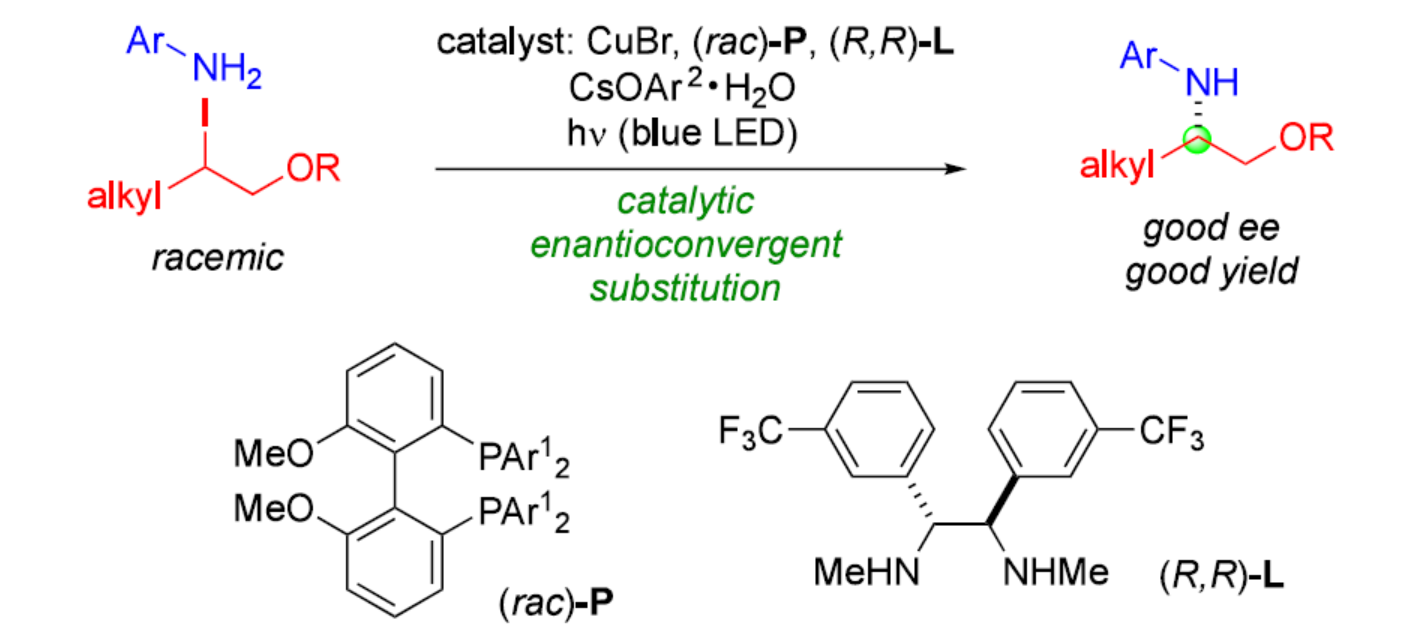
N-烷基化是有机合成中构建C-N键最常用的方法之一,但此类反应通常仅限于反应性的烷基亲电试剂,可能会导致过度烷基化。相比之下,采用氮亲核试剂对非活化的二级或三级亲电试剂进行取代反应时,通常会受到H-X(X为离去基团)的E2消除等副反应影响。近年来,化学家们开发了多种过渡金属催化的策略,弥补了经典途径(如SN1和SN2)用氮亲核试剂取代烷基卤化物的一些局限性。同时,采用二级或三级亲电试剂进行N-烷基化反应时,对于被取代碳的立体化学控制也具有挑战。尽管对于过渡金属催化活化烷基亲电试剂的对映汇聚性N-烷基化反应已取得了重大进展,但仅有一篇涉及非活化亲电试剂(如一级羧酰胺为亲核试剂)成功的报道(Nature 2021, 596, 250.)。此外,对映体富集的苯胺,包括N-芳基β-氨基醇及其衍生物,因其广泛的生物活性而成为重要靶标(Figure 1A)。其中,对映体富集胺的N-芳基化反应,是制备此类化合物的一种经典策略(Figure 1B)。然而,对于对映体富集的亲电试剂与苯胺的立体专一性取代反应或者外消旋亲电试剂与苯胺的对映汇聚性取代反应,目前尚未有相关的研究报道。近日,加州理工学院Gregory C. Fu课题组报道了一种光诱导铜催化苯胺与外消旋/非活化的烷基亲电试剂的对映汇聚性N-烷基化反应,合成了一系列N-芳基β-氨基醇衍生物(Figure 1C)。欢迎下载化学加APP到手机桌面,合成化学产业资源聚合服务平台。
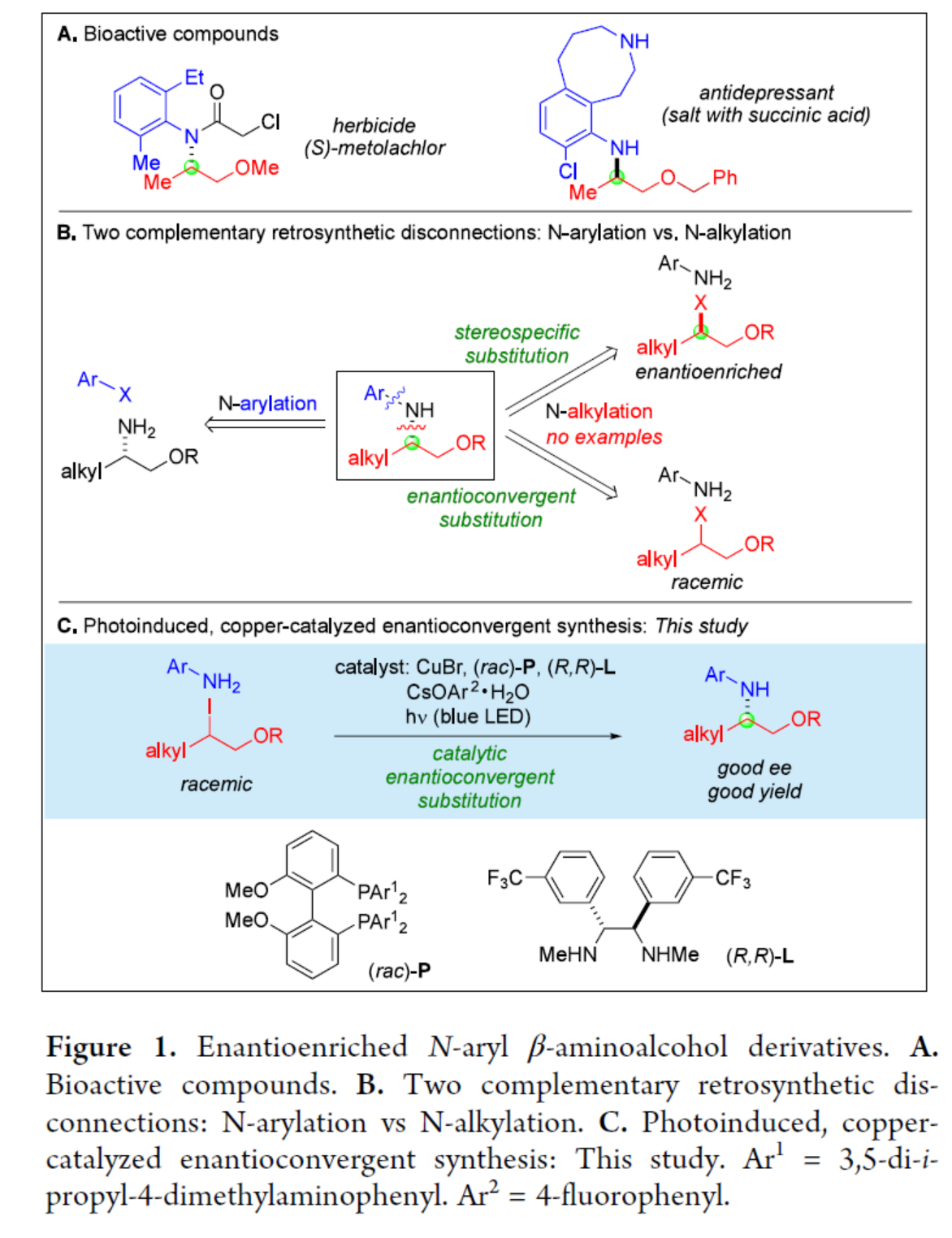
(图片来源:J. Am. Chem. Soc.)
首先,作者以4-甲氧基苯胺与2-碘-1-甲氧基戊烷作为模型底物,进行了相关反应条件的筛选(Table S1)。当以CuBr(12 mol %)作为催化剂,rac-P(2.5 mol %)与(R,R)-L(20 mol %)作为配体,CsOAr•H2O(Ar= 4-氟苯基,1.5 equiv)作为添加剂,440 nm蓝色LED作为光源,在iPr2O溶剂中-5oC反应,可以93%的收率得到N-芳基β-氨基醇产物,ee为90%。
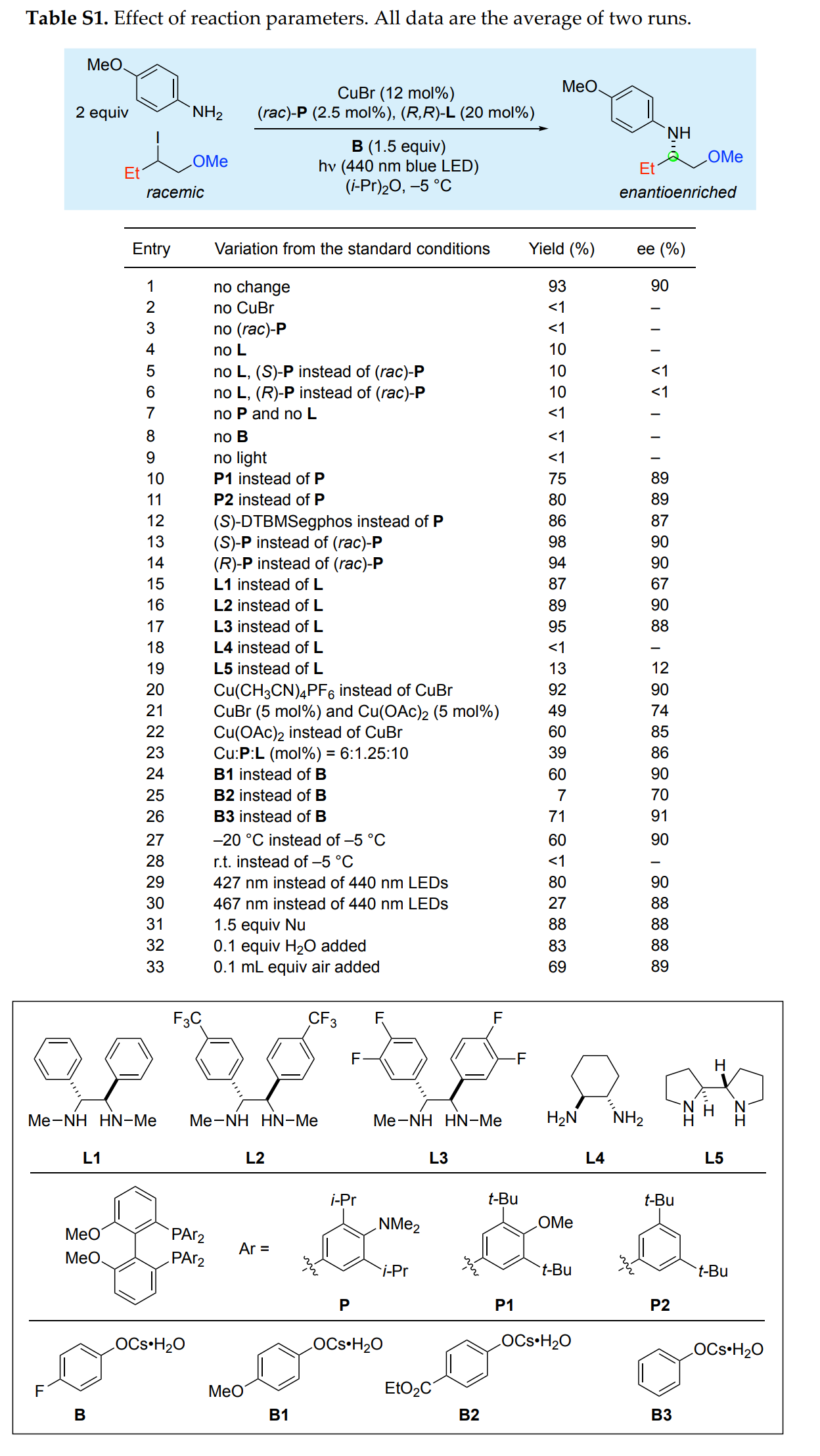
(图片来源:J. Am. Chem. Soc.)
在获得上述最佳反应条件后,作者对外消旋/非活化的烷基亲电试剂的底物范围进行了扩展(Table 2)。首先,当亲电试剂底物中的R为乙基、甲基、异丙基等烷基时,均可与4-甲氧基苯胺顺利进行反应,获得相应的产物1-7,收率为41-94%,ee为81-90%。同时,当使用相反构型的手性配体时,可获得具有相似的收率以及相反构型的产物,如8。其次,当亲电试剂底物中的OR1为-OEt、-OCH2Ph、-Oi-Pr、-Ot-Bu和-OPh时,也能够顺利进行反应,获得相应的产物9-13,收率为60-99%,ee为81-88%。然而,当亲电试剂底物中的OR1为-OTBS时,仅以23%的收率得到产物14,ee为60%。此外,3-碘-1,1-二甲氧基丁烷,也是合适的底物,可以78%的收率得到产物15,ee为62%。
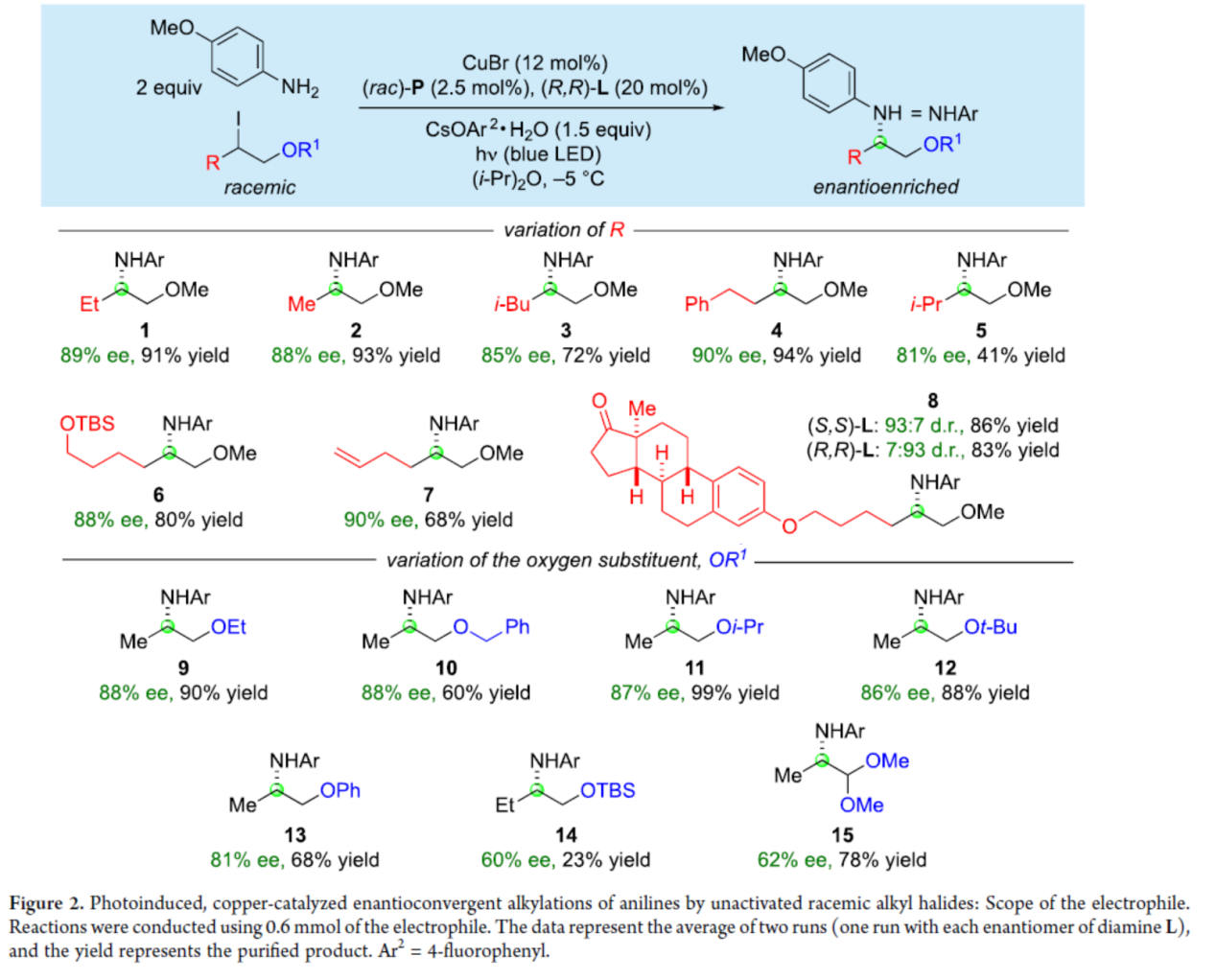
(图片来源:J. Am. Chem. Soc.)
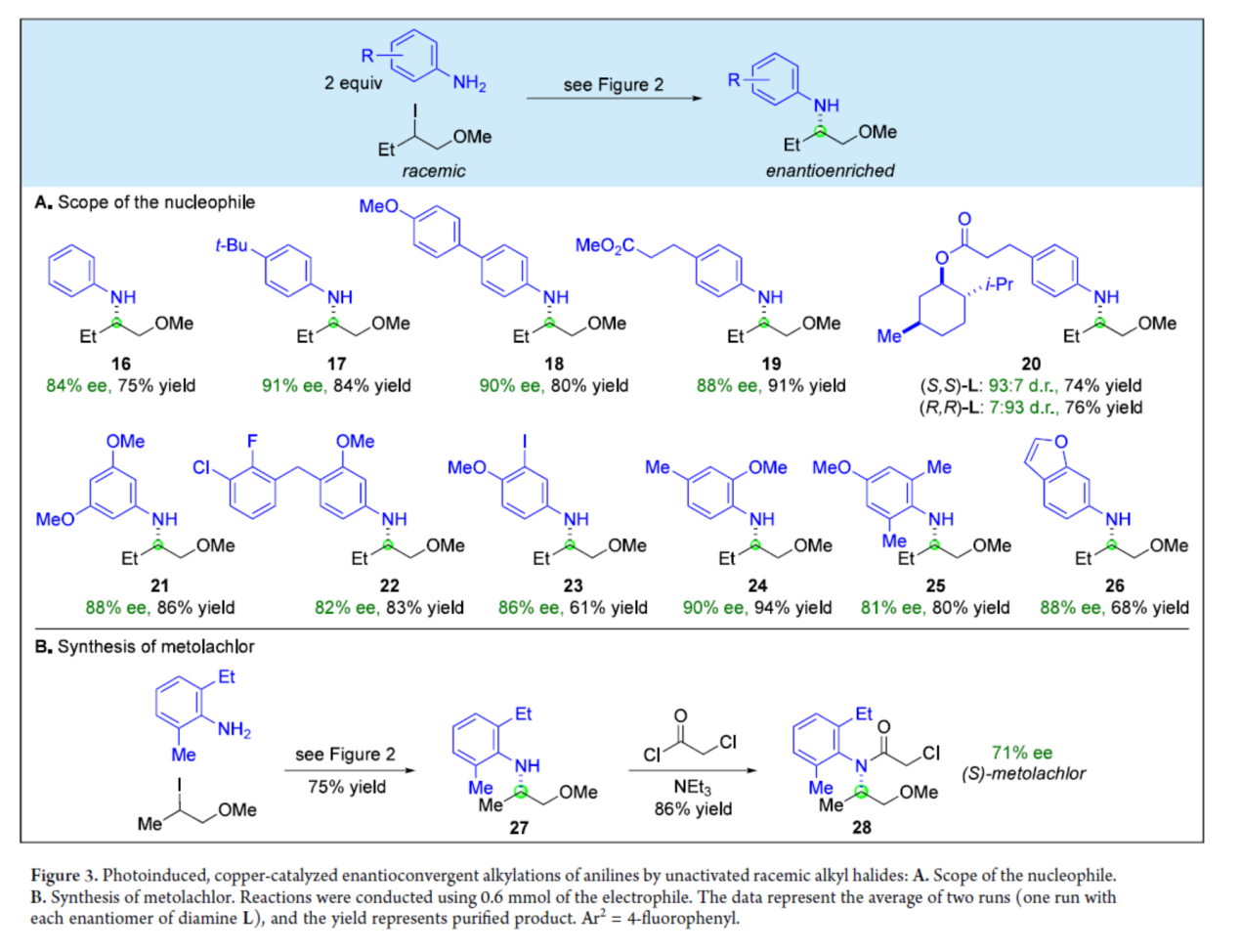
紧接着,作者对亲核试剂的底物范围进行了扩展(Figure 3)。研究结果表明,一系列不同取代的苯胺衍生物,均可顺利进行反应,获得相应的产物16-26,收率为61-94%,ee为81-91%。同时,当使用相反构型的手性配体时,可获得具有相似收率以及相反构型的产物,如20。然而,对于高度缺电子的苯胺(如4-氨基苯甲酸乙酯),不能有效的参与反应。值得注意的是,利用上述的策略,可以75%的收率合成N-芳基β-氨基醇产物27,其在碱性条件下可继续进行取代反应,从而可以86%的收率获得手性(S)-异丙甲草胺28,ee为71%(除草剂中的活性成分)。
(图片来源:J. Am. Chem. Soc.)
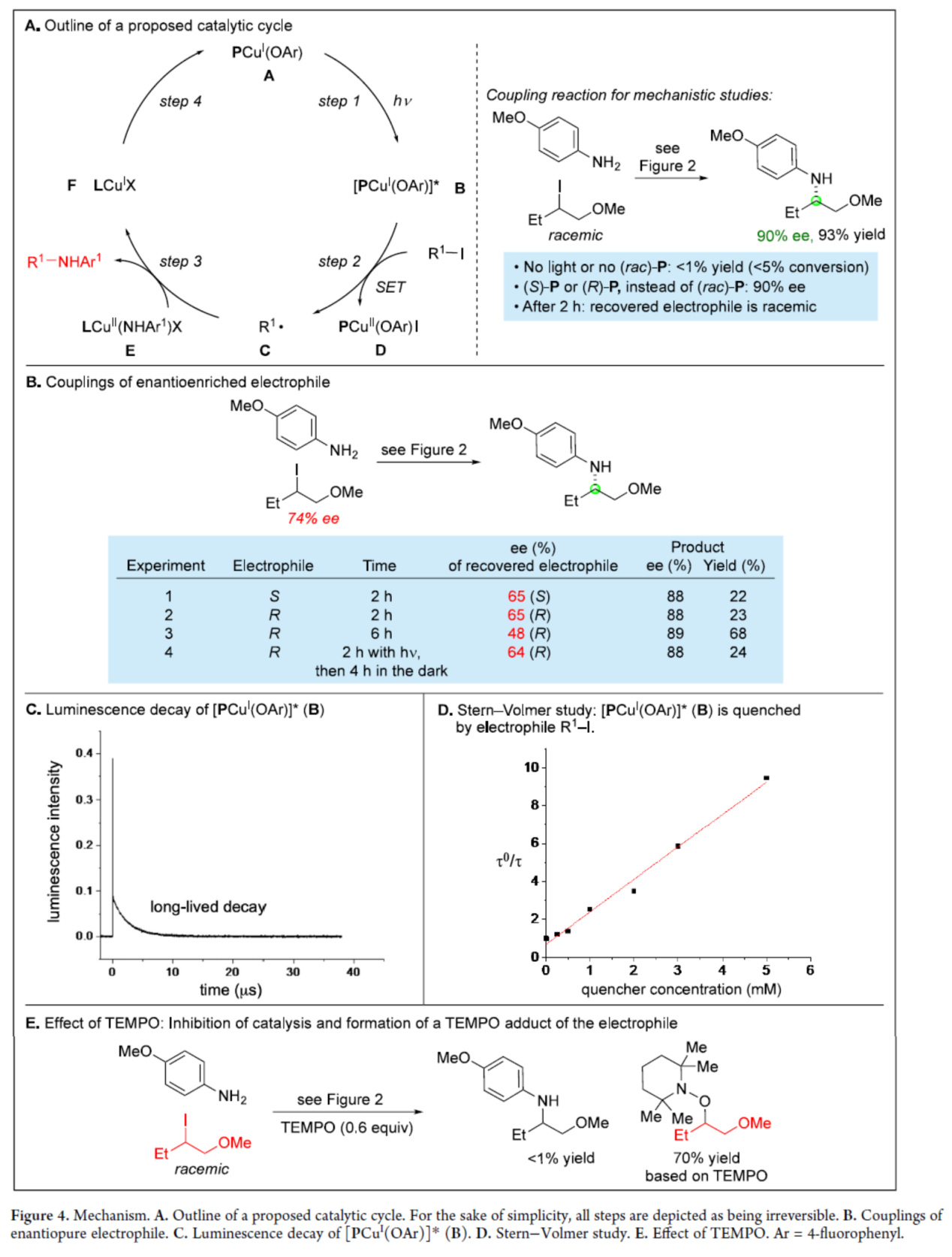
随后,作者对反应机理进行了进一步的研究(Figure 4)。首先,作者提出了一种合理的催化循环过程(Figure4A)。在光照条件下,PCuI(OAr)(A)可生成激发态配合物[PCuI(OAr)]*(B),其可与亲电试剂R1−I进行单电子转移(SET),生成有机自由基R1•(C)和PCuII(OAr)I(D)。自由基(C)可继续与手性铜(II)-苯胺基配合物(E)反应,生成对映体富集的C-N偶联产物R1−NHAr1和铜(I)配合物F。配合物F经配体交换以再生配合物A,从而完成催化循环的过程。其次,通过对手性亲电试剂的偶联反应研究发现,回收亲电试剂的ee值衰减幅度高度一致,证明体系中不存在亲电试剂的动力学拆分过程;而亲电试剂ee值随时间持续降低的现象,则与催化剂对碘化物的攫取存在部分可逆性密切相关(Figure4B)。此外,通过对假定中间体[PCuI(OAr)]*(B)的研究发现,[PCuI(OAr)]*(B)可被亲电试剂R1−I淬灭,具有二阶速率常数(Figure4C和Figure4D)。通过对假定中间体(C)的研究发现,反应生成了亲电试剂(R1-I)的TEMPO加合物,从而证明了反应涉及自由基机理的过程(Figure4E)。
(图片来源:J. Am. Chem. Soc.)
总结
美国国家科学院院士、美国艺术与科学院院士、加州理工学院Gregory C. Fu课题组报道了一种光诱导铜催化苯胺与外消旋/非活化烷基亲电试剂的对映汇聚性偶联反应,合成了一系列N-芳基β-氨基醇衍生物。在这种N-烷基化策略中,C-N键的形成和立体化学的控制是同时实现的,为获得此类目标分子(如通过手性纯胺类化合物的N-芳基化反应)提供了互补性合成路径。机理研究表明,铜/双膦/芳氧基配合物是光催化剂,而手性铜/二胺配合物与有机自由基通过偶联实现了C-N键的对映选择性控制。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn