

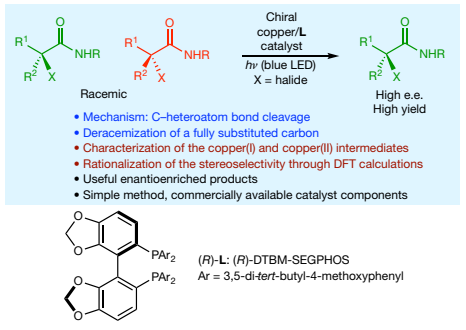
(图片来源:Nature)
正文
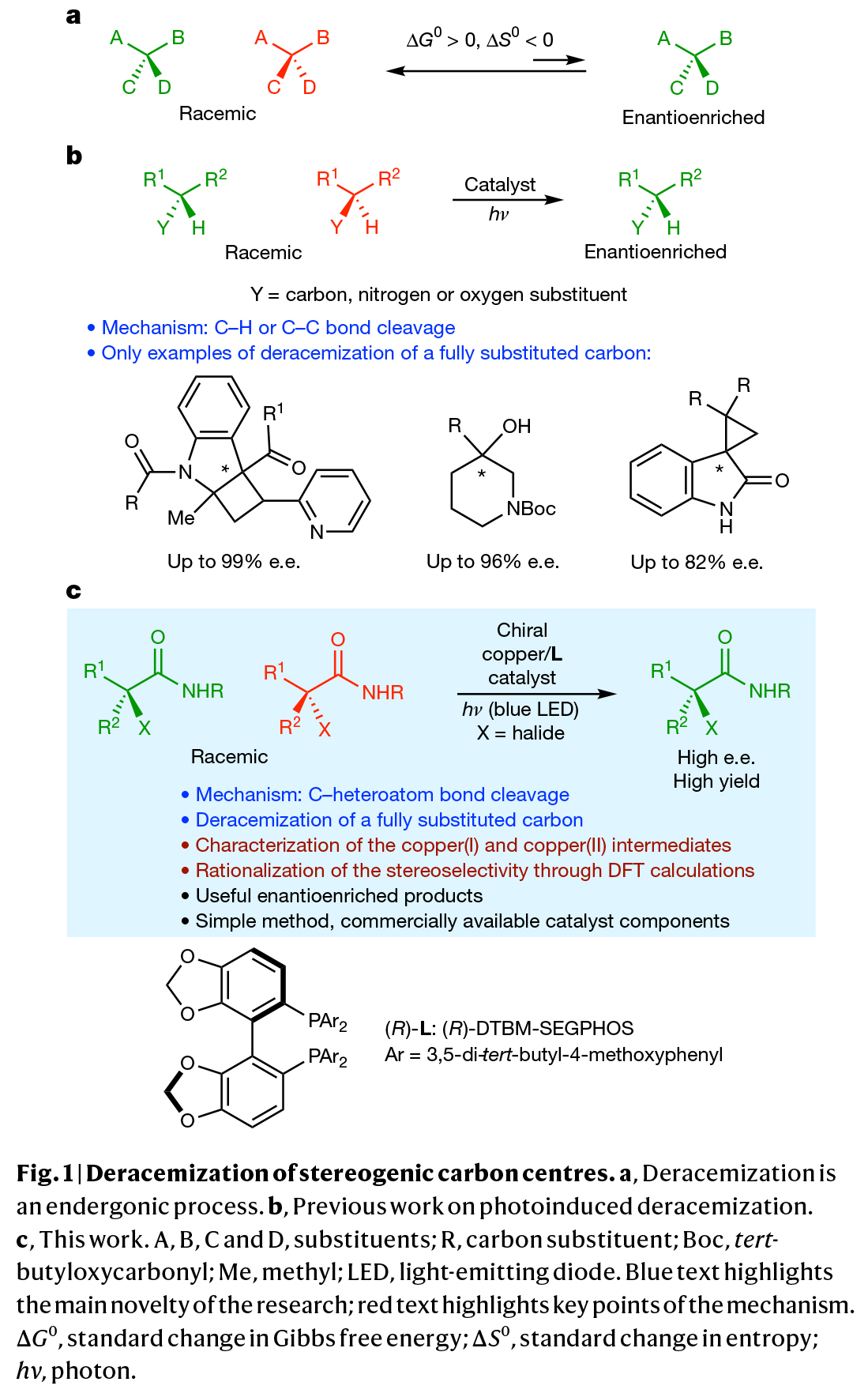
(图片来源:Nature)
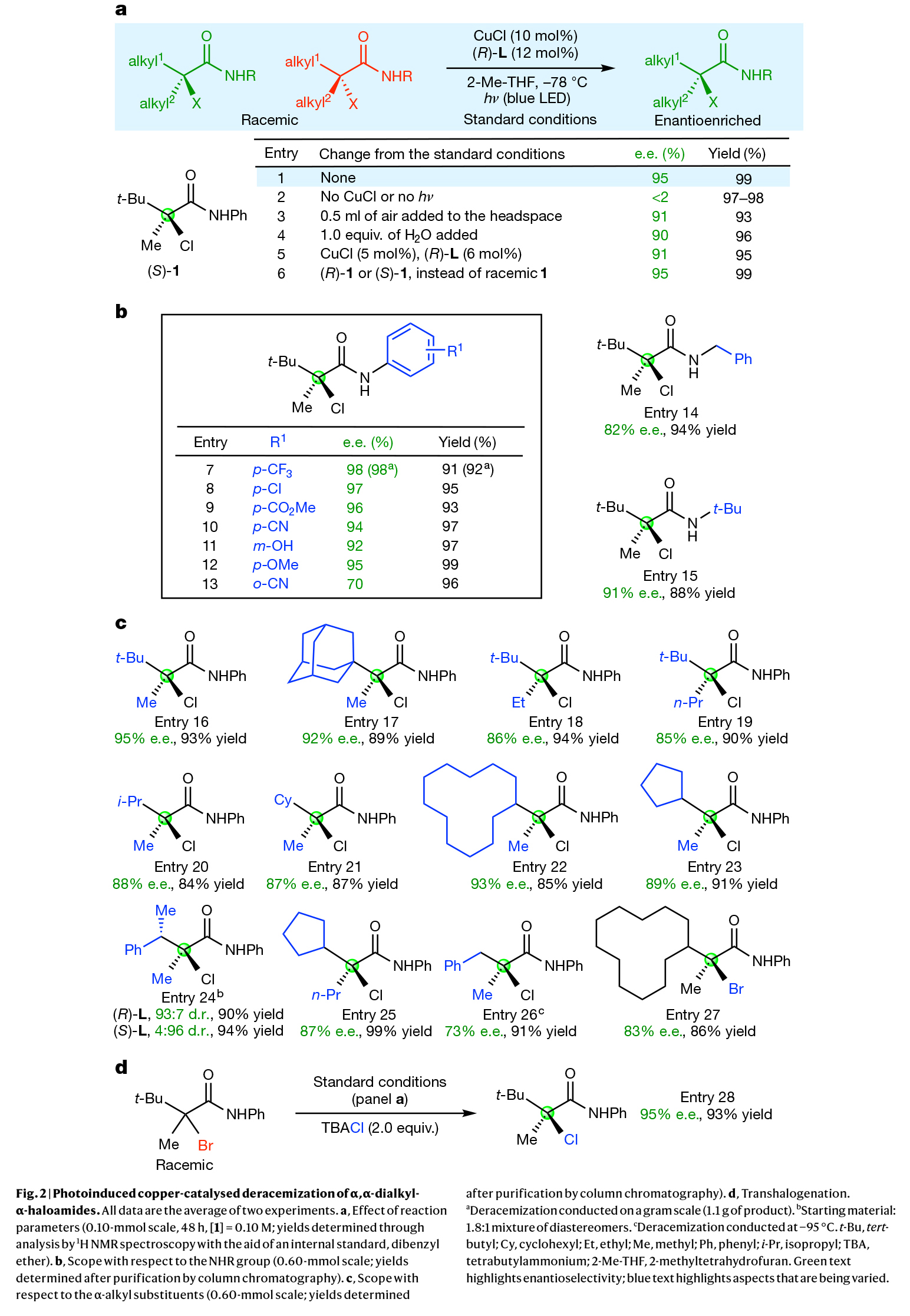
首先,作者以简单易得的消旋三级α-卤代羰基化合物作为模板底物对反应条件进行了考察。通过一系列条件筛选,作者发现当使用CuCl (10 mol%),(R)-L(12 mol%),在2-Me-THF中,蓝光照射下-78 oC反应可以以99%的产率,95% ee得到相应的对映体富集产物。控制实验表明,在没有CuCl存在以及光照条件下去消旋化过程并未发生。此外,少量水或氧气的存在以及降低催化剂的用量并未显著影响产率和对映选择性(Fig. 2a)。在得到了最优反应条件后,作者分别对NHR部分(Fig. 2b)以及α-烷基取代基的兼容性(Fig. 2c)进行了考察。实验结果表明一系列不同的取代基(包括三氟甲基、卤素、氰基、游离羟基、烷氧基、金刚烷基、环己基、环戊基等)均可兼容此转化。值得注意的是,除了烷基氯以外,烷基溴也可实现此类过程(Fig. 2d)。当在体系中加入2.0 equiv TBACl时可以以93%的产率和95% ee得到相应的去消旋化产物。
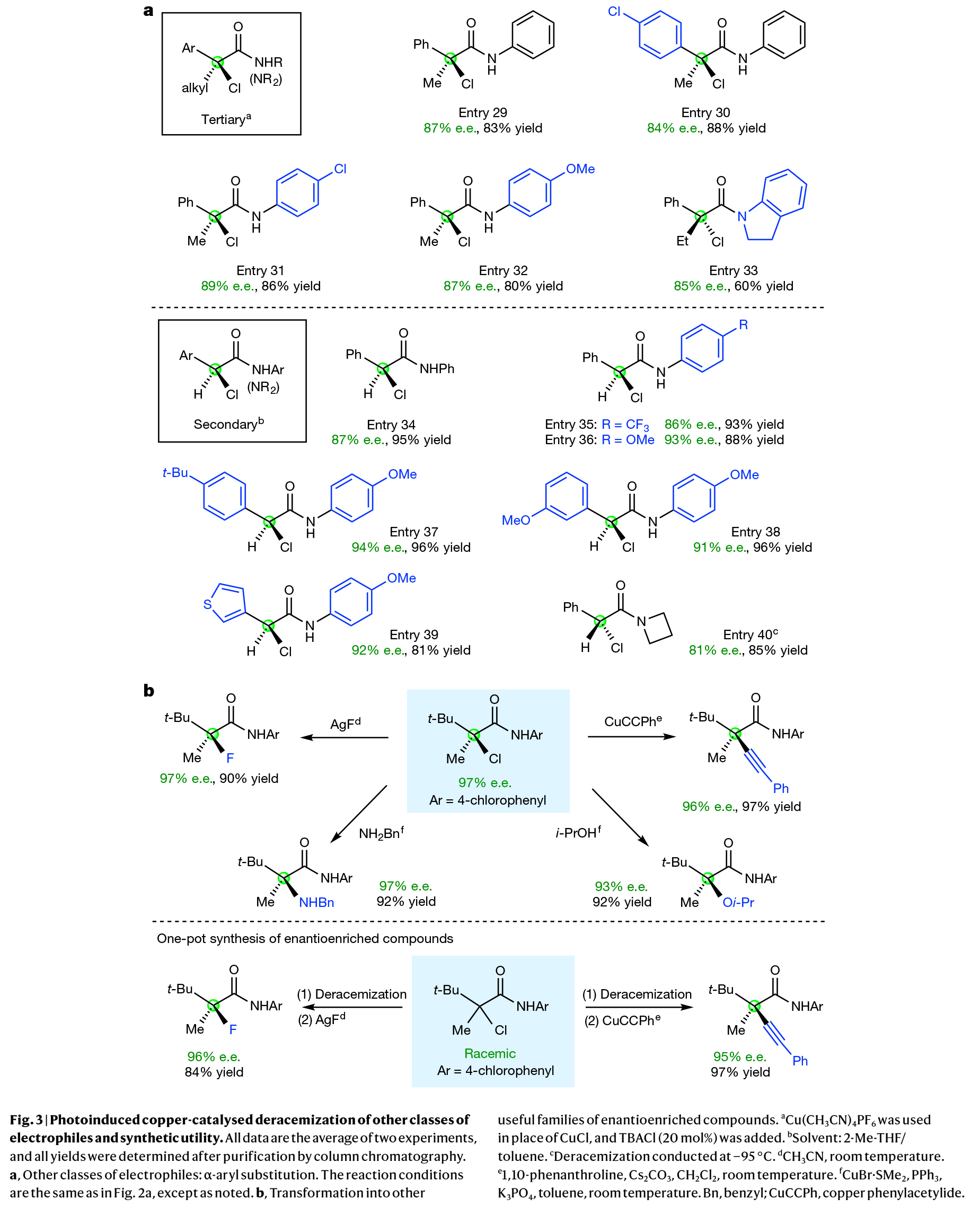
(图片来源:Nature)
除了α,α-双烷基取代亲电试剂的去消旋化这一极具挑战性的转化以外。作者还探究了α-烷基-α-芳基取代亲电试剂的光诱导去消旋化过程,发现这类结构特异的叔烷基卤化物同样适用于铜/L催化体系,能在多种取代基存在的条件下以良好对映选择性获得目标产物(Fig. 3a)。实验表明无论是含缺电子芳环还是富电子芳环的底物,亦或是仲与叔酰胺类亲电试剂,均能实现高效去消旋化(在标准反应条件下,含α-烷基取代的仲亲电试剂对映选择性较低),以60-96%的产率,81-94% ee得到相应的产物(entry 29-40)。值得关注的是,该体系不仅对含吸电子或给电子取代基的芳环表现出优异的对映选择性,对杂芳环取代底物及叔酰胺类化合物同样有效。
接下来,作者对产物进行了合成转化(Fig. 3b)。其碳-氯键可被碳-氟、碳-碳、碳-氮或碳-氧键等高立体选择性地取代,从而拓展出多类有价值的手性化合物库。此外,通过"一锅法"连续反应制备的两种衍生物,其产率与对映选择性均可媲美分步合成策略。
(图片来源:Nature)
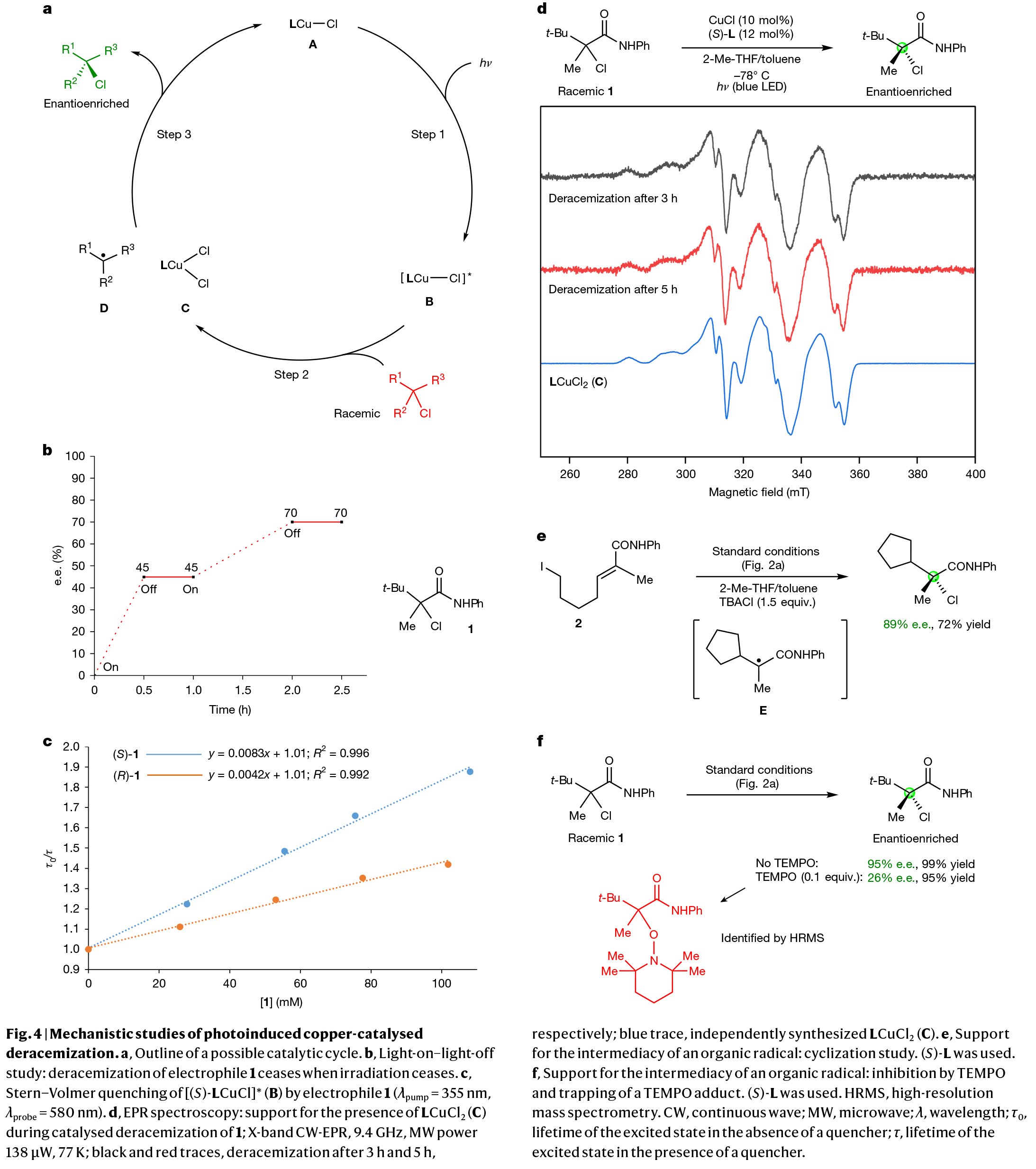
紧接着,作者对此过程的机理进行了探索(Fig. 4)。作者认为反应经历了如果过程:首先,铜(I)配合物A在光照条件下生成激发态配合物B,该激发态与叔烷基氯发生电子转移反应,生成铜(II)配合物C和有机自由基D。随后,铜(II)配合物C中的氯原子通过卤素原子转移反应与有机自由基D结合,在对映选择性控制下生成手性富集的烷基氯化合物,同时再生铜(I)催化剂A(Fig. 4a)。作者通过光开关控制实验证实,去消旋化反应在停止光照时基本终止,而恢复光照后反应重新启动(Fig. 4b),这一现象充分证明了光催化过程的必要性。此外,通过Stern-Volmer研究,作者证实了烷基氯1能淬灭B的发光,且亲电试剂的(S)-对映体反应速率快于(R)-对映体(Fig. 4c);这种反应活性差异与内球电子转移机理相符,该路径也得到DFT计算的支持。
为了探究去消旋化过程中铜(II)物种的存在形式,作者进行了电子顺磁共振(EPR)波谱研究。光照3小时和5小时后获得的EPR谱图基本一致(Fig. 4d)。通过与标准样品的比对,作者将这些信号归属为LCuCl2(C)。通过自旋定量分析,估算反应混合物中约3%的铜以配合物C的形式存在。为验证有机自由基D作为中间体的可能性,作者在TBACl存在下考察了烷基碘2在标准条件下的反应(Fig. 4e)。若两个过程共享相同的自由基中间体E,则该反应表现出与Fig. 2c entry 23相同的对映选择性(89% ee),且实验结果与此预期完全吻合。此外,当加入自由基捕获剂TEMPO时会抑制去消旋化反应,并且通过高分辨质谱可检测到有机自由基的TEMPO加合物(Fig. 4f)。
(图片来源:Nature)
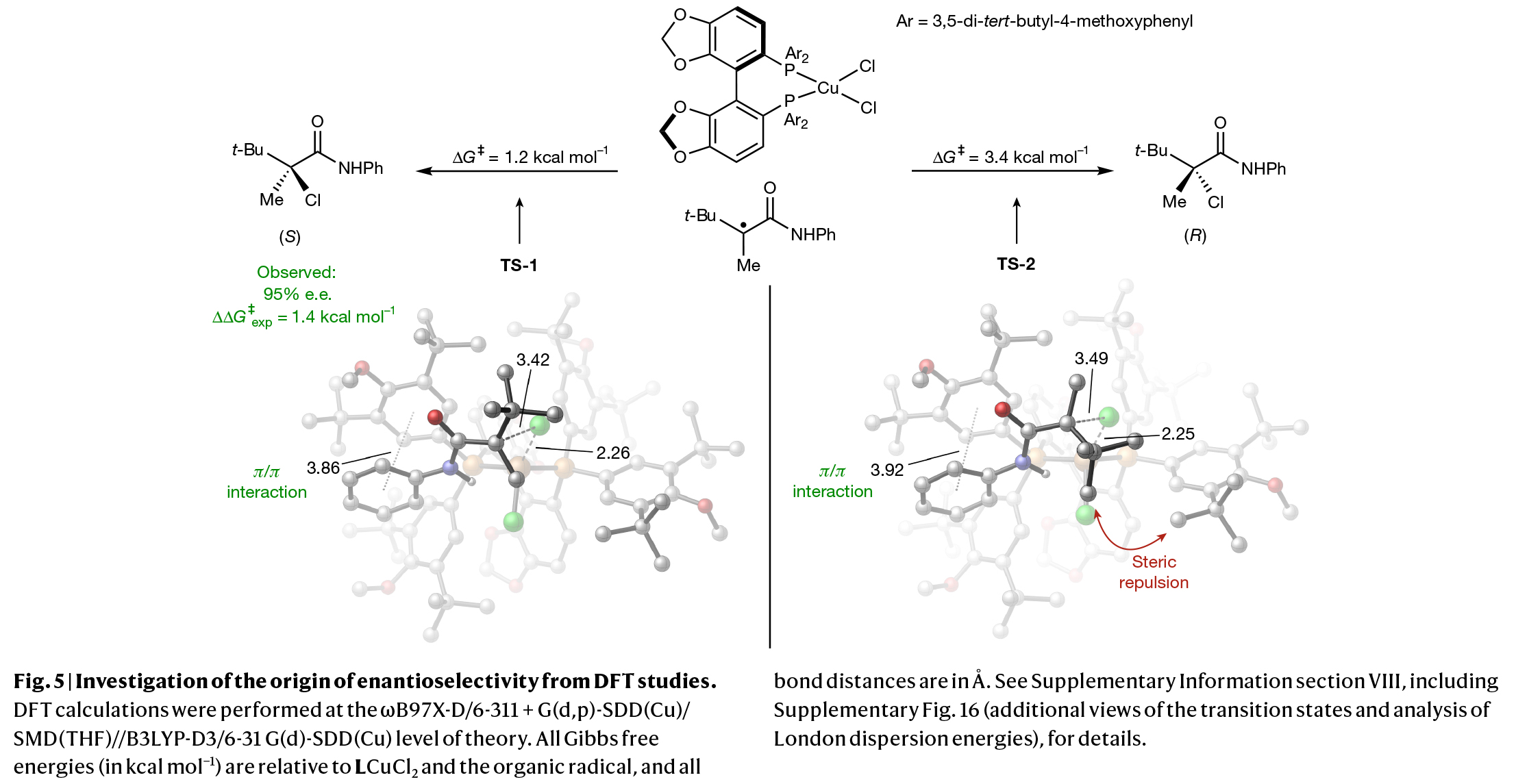
为了探究光诱导铜催化去消旋化反应中对映选择性的来源,作者进行了DFT计算(Fig. 5)。计算结果表明:在高度放热的氯原子转移过程中(吉布斯自由能变ΔG≈ -23 kcal mol⁻¹),生成(S)-和(R)-产物对映体的最低能垒过渡态分别为TS-1和TS-2,其活化能垒分别为1.2 kcal mol⁻¹和3.4 kcal mol⁻¹。该计算结果与实验观察到的对映选择性规律一致,即在-78oC条件下获得的95% ee对应于1.4 kcal mol⁻¹的活化自由能差。在TS-1中,底物的苯环与配体的芳基形成了稳定的π/π堆积作用,从而稳定了过渡态。而在TS-2中,底物的叔丁基与配体的叔丁基产生空间排斥作用,从而导致能量升高。因此这些非共价相互作用共同促进了(S)-构型产物的生成。
(图片来源:Nature)
总结
Gregory C. Fu课题组与刘鹏课题组利用光诱导铜催化成功实现了叔(及仲)烷基卤化物的去消旋化,其中包括具有挑战性的α,α-双烷基-α-卤代羰基化合物及其衍生物。通过该策略获得的手性产物可进一步与氟、碳、氮及氧亲核试剂发生立体选择性反应,转化为多种高价值对映富集目标分子。该方法操作简便,仅需两种市售试剂即可原位生成活性手性催化剂。相较于光诱导去消旋化这一新兴领域的前期研究,本工作的创新性体现在:(1)以碳-杂原子键断裂作为关键步骤;(2)成功构建四取代立体中心;(3)可制备多类重要的对映富集化合物。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn