


正文
环蕃烷(英文名,cyclophane)是指含有芳环和交叉连接的烷烃链(亦称ansa链)结构的分子。当芳香环上含有较大取代基且ansa链长度合适时,芳环平面围绕大环面的旋转受阻,其对称性发生破缺,从而产生平面手性。光学活性的平面手性环蕃烷在药物研发、手性材料合成和催化剂创制等领域具有广泛的应用前景,研究催化不对称构筑该类结构的新方法并揭示其结构与构象/构型稳定性之间的关系是合成化学领域的重要科学问题。目前,稳定环蕃烷构象有如下几种途径:(1)芳环上引入大位阻基团(图1A,type I),(2)缩短 ansa 链的长度(图1A,type II),(3)ansa链上引入手性基团(图1A,type III)。其中,构象稳定的III型环蕃烷是众多生物活性分子(如天然产物Fijiolide A和药物Lorlatinib)的核心结构(图1B)。然而,现有合成III型环蕃烷的方法依赖于底物诱导的非对映选择性大环化反应,鲜有同时控制对映选择性、阻转选择性和非对映选择性的合成该类结构的报道。
北京师范大学赵常贵课题组聚焦于环蕃烷化学方向的研究,发展了多种催化不对称合成平面手性环蕃烷的新方法,包括手性磷酸催化的不对称氢转移反应(ACS Catal.2023, 13, 14155–14162),过渡金属催化前手性环蕃烷的不对称C–H键活化反应(Angew. Chem. Int. Ed.2023, 62, e202315603;J. Org. Chem. 2024, 89,15374–15379;Chem. Eur. J. 2025,31,e202404610),不对称大环化反应(J. Am. Chem. Soc. 2024, 146, 29214–29223;Org. Lett.2024, 26, 1040–1045)和NHC催化的动态动力学拆分策略(Nat. Commun. 2024,15,2338)等。
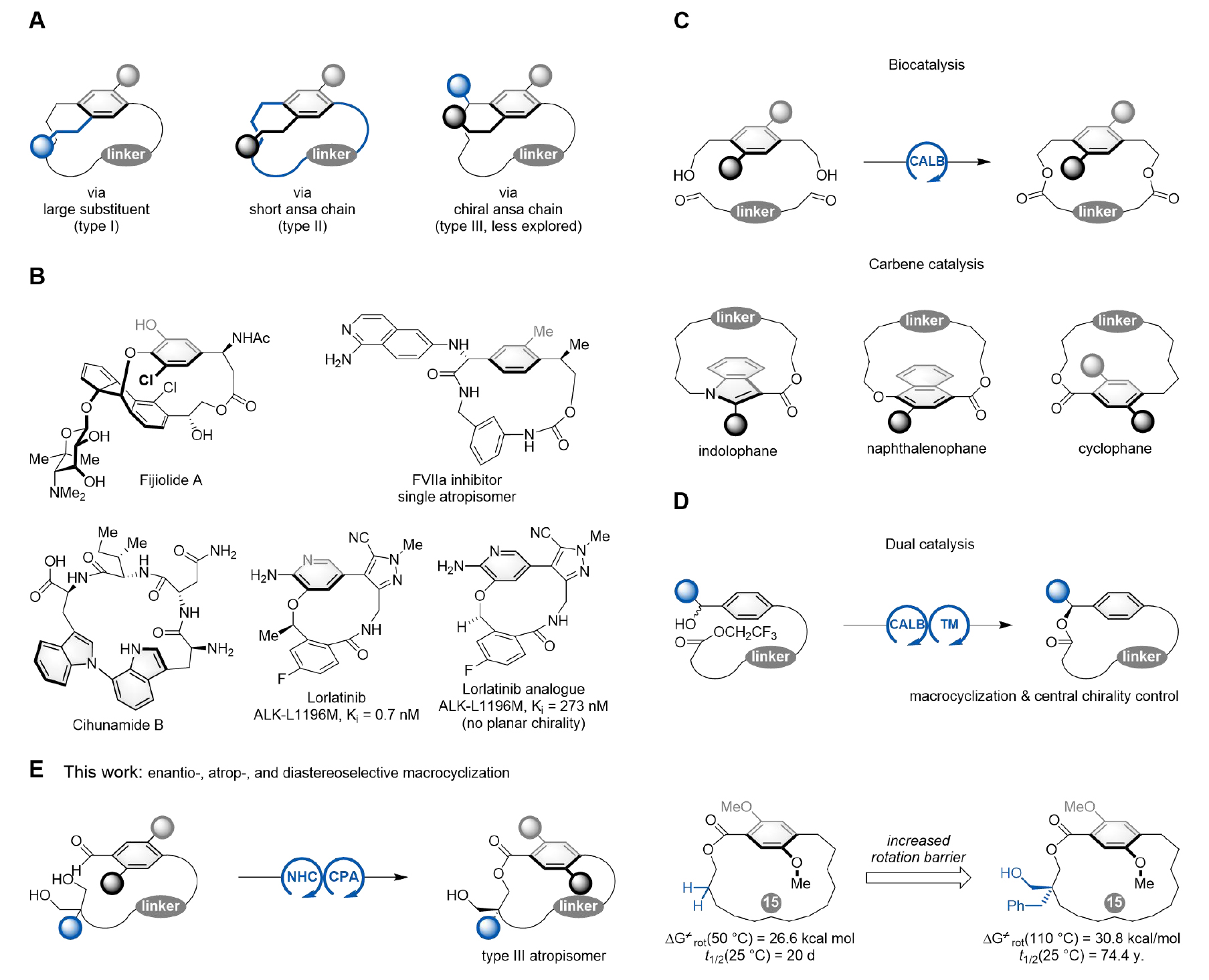
图1. 研究背景介绍
在前期工作的基础上,作者提出氮杂环卡宾(NHC)和手性磷酸(CPA)协同催化的1,3-二醇去对称化策略,以对映选择性、阻转选择性和非对映选择性的大环内酯化反应构建III型环蕃烷(图1E)。该策略利用CPA与1,3-二醇形成的氢键作用稳定中间体构型,并通过NHC与底物形成的的非共价相互作用有效限制芳环的自由旋转并促进大环化过程,从而实现对平面手性和中心手性的控制。
作者首先对NHC催化剂种类进行了筛选,发现N-2,6-(Et)₂C₆H₃取代的NHC催化剂在立体选择性和产率方面表现最佳。进一步引入手性磷酸(CPA)后,反应的非对映选择性得到了显著提升。随后,通过筛选溶剂与碱的种类,最终确定了以四氢呋喃(THF)为溶剂、K₂CO₃为碱、3,3',5,5'-四叔丁基二苯醌(DQ)为氧化剂的最优条件。

图2.底物适用性研究
在获得最优条件后,作者对该反应的底物适用范围进行了研究。首先,作者对多种1,3-二醇底物进行了考察,发现具有甲基、苄基、萘甲基等取代基的底物均能以良好的产率和立体选择性生成目标环蕃烷(图2,3-12)。此外,更改底物苯环上的取代基,如苯基、呋喃基、吡啶基等,均可实现向目标产物的高效转化,进一步体现了该反应的广泛适用性(图2,13-21)。同时,作者对具有不同长度以及种类的ansa链也进行了考察,具有不同链长的底物均可以以一定的产率以及良好的立体选择性获得具有11-15个原子ansa链的平面手性环蕃烷(图2,22-30)。值得注意的是,当ansa链长度超过15个原子时,环蕃烷的平面手性逐渐消失,通过计算,确定具有16个原子ansa链的平面手性环蕃烷化合物31的旋转能垒为21.9 kcal/mol,对应半衰期为11.0 mins,表明苯环围绕大环的翻转较为迅速。此外,17和18个原子的ansa链则导致平面手性完全消失(图2,32–33)。

图3.应用研究及热力学实验
随后,作者进一步探究了该化合物的应用价值。通过将环蕃烷2中的伯醇基团进行Dess-Martin氧化反应,制备了醛类化合物34,且该合成转化未发生立体选择性损失(图3A)。此外,通过对化合物2进行官能团修饰,得到了III型环蕃烷衍生的硫脲催化剂35。尽管35在构建八元环反应中催化活性较低,但其为优化催化剂设计提供了潜在思路。
热力学实验表明,III型环蕃烷在高温下会发生平面手性的消旋化,其旋转能垒与ansa链手性取代基的位阻相关,通过开环实验可以证实该外消旋化过程源于苯环旋转导致的平面手丢失(图3B)。进一步研究发现,非环状产物41的ee值为93:7,表明在31的形成过程中,中心手性得到了有效控制(图3C)。

图4. 平面手性环蕃烷构象稳定性及DFT理论计算
作者通过热力学实验结合DFT理论计算(该部分由济宁学院刘涛教授团队完成),揭示了ansa链上手性取代基稳定环蕃烷构象的作用机制。计算结果表明化合物43、26、27及30的过渡态的能垒呈现TSrot(43) < TSrot(26) < TSrot(27) < TSrot(30)的递增趋势(图4B),与实验结果高度吻合。对这些过渡态的几何结构分析显示,ansa 链上手性取代基的存在会缩小C1−C2−C3键角,且取代基体积越大,键角缩减程度越显著(119.02° < 115.64° < 115.40° < 115.14°)(图4C)。键角减小导致ansa链整体缩短,从而抑制苯环的旋转过程。值得注意的是,C7−O−C8键角的扭曲以及C4−C5−C6−C7/C4−C10−C9−C7二面角的增大程度基本一致。此外,手性取代基与酯基间的空间位阻也可能是TSrot(27)与TSrot(30)能垒升高的原因。通过非共价相互作用分析,进一步证实了关键空间位阻排斥作用的存在。
总结
作者发展了一种基于氮杂环卡宾(NHC)和手性磷酸(CPA)双催化的对映选择性、阻转选择性和非对映选择性的大环内酯化策略,该策略将大环的构建和手性的控制融为一体,丰富了合成环蕃烷的催化模型,拓展了稳定环蕃烷构象/构型的方法,为揭示[n]对环蕃烷手性产生与ansa取代基大小、位置之间的关系提供了关键数据。
上述工作发表在Nature Communications,北京师范大学赵常贵副教授和济宁学院刘涛教授(理论计算)为本文共同通讯作者,赵常贵副教授课题组博士研究生王佳明和济宁学院吕康副教授为共同第一作者。
作者简介
赵常贵,北京师范大学化学学院副教授、博士生导师。于2014年6月在兰州大学功能有机分子国家重点实验室获得博士学位(导师:厍学功教授)。2014年7月至2019年12月先后在清华大学药学院(导师:汪舰教授)和美国威斯康星大学麦迪逊分校药学院(导师:Weiping Tang 教授)从事博士后研究。2020年7月,作为引进人才回国,入职北京师范大学化学学院,任副教授,博士生导师。研究领域为不对称催化,已在Science, J. Am. Chem. Soc., Angew. Chem. Int. Ed., Nat. Commun., ACS Catal., Org. Lett.等刊物上发表多篇论文。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn