

akuammiline家族吲哚类生物碱由于其复杂多样的化学结构和各种潜在的生物活性一直都是科学研究的热点,推动了合成化学、药物化学和化学生物学的发展。akuammiline家族吲哚类生物碱也吸引了众多的有机合成化学家去合成研究,包括Garg, Smith, MacMillan, Snyder, 祝介平以及国内的秦勇教授、马大为教授、李昂研究员、杨玉荣研究员等(化学加曾于20160225解读过,回复w30可查看)。在众多该家族成员中,calophyline A结构最为复杂,合成极具挑战性:该天然产物以罕见的内盐形式存在,结构上包含6/5/6/5并环体系、一个含氮[3.2.2]桥环、一个含氧[3.2.1]桥环以及多个连续的手性中心,目前还未有全合成报道。
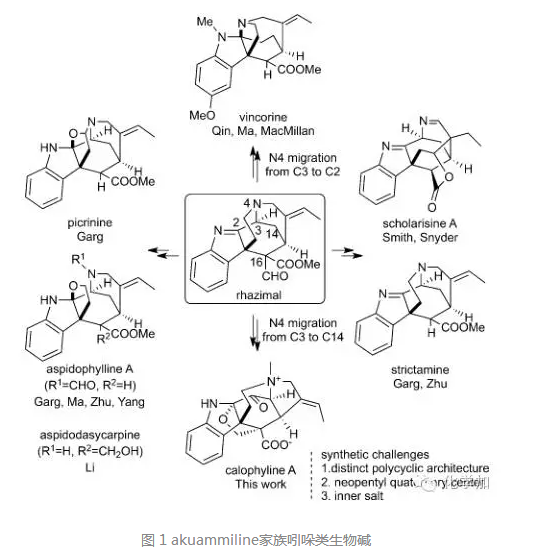
近期,清华大学药学院的祖连锁课题组成功实现了对calophyline A的首次化学全合成。文章发表在国际著名化学类杂志德国应化(Angew. Chem. Int. Ed)上,文章DOI: 10.1002/anie.201604770。作者以本课题组独立发展的氮杂片呐醇重排策略(aza-pinacol rearrangement)为关键步骤,并且在合成后期通过高难度的late-stage aldol反应引入了关键的季碳中心。
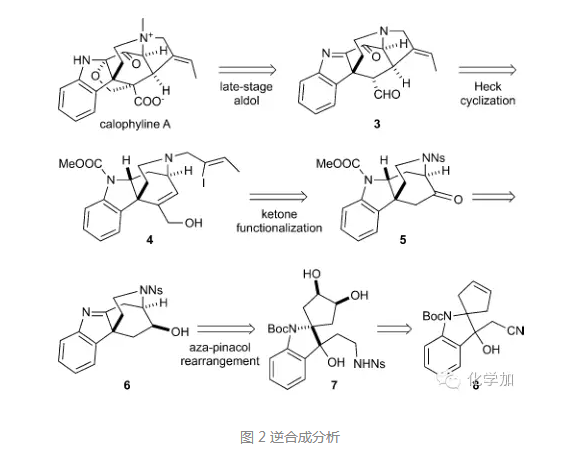
首先看逆合成分析,对于氧杂环,可以在合成的后期通过Aldol反应构建,逆推至化合物3,3中带有环外双键的四氢吡咯环通过分子内Heck反应构建,而前体化合物4通过化合物5中酮羰基的官能团化得到,5的前体化合物6则由氮杂片呐醇重排得到,逆推至简单化合物8。
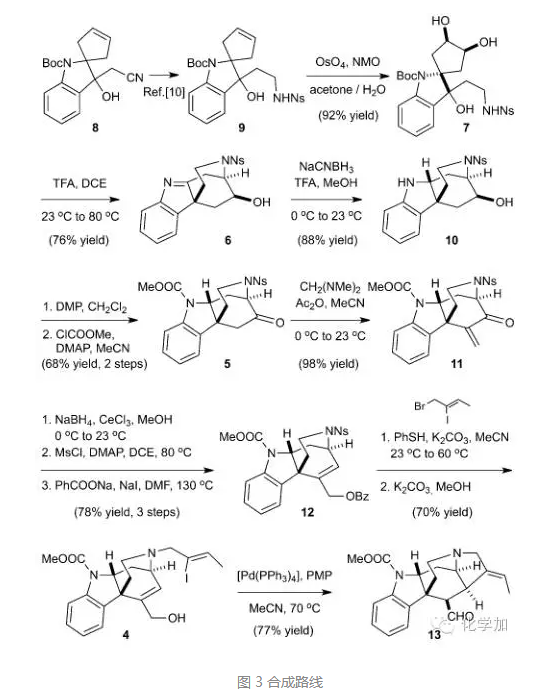
从已知化合物8出发,一锅法还原氰基并保护得到化合物9,双羟化后得到重排前体7,再在三氟乙酸作用下原位脱保护并发生氮杂片呐醇重排/消除反应/氮杂Michael反应得到化合物6,氮杂[3.2.2]桥环得以构建,产率良好并且手性中心得到较好控制。还原亚胺得到化合物10,DMP氧化二级羟基到酮,甲酸酯保护吲哚上氮得到化合物5,酮羰基α-位引入亚甲基得到化合物11,Luche还原并Ms保护烯丙位羟基,苯甲酸负离子发生SN2’反应,以三步78%的高收率得到化合物12,脱去氮上Ns保护基并引入烯基碘侧链,碳酸钾甲醇条件下脱去Bz保护,再在钯催化剂作用下发生分子内Heck反应构建了笼状骨架,得到醛化合物13,为后续的Aldol反应做好了铺垫。
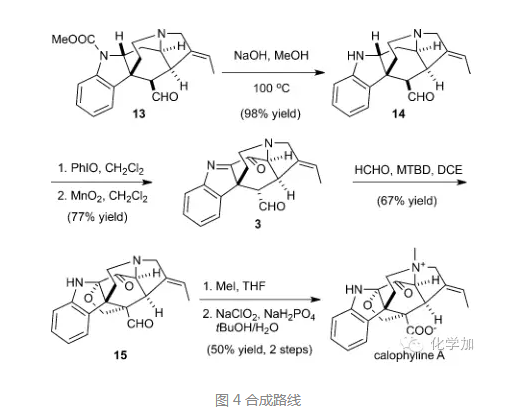
氢氧化钠甲醇条件下脱去吲哚氮上的甲酸酯保护基,并用PhIO氧化得到亚胺,同时在亚胺的α-位氧化出羟基,进而二氧化锰氧化得到酮,值得注意的是在氧化过程中,醛羰基的α-位也发生了差向异构化,这也是Aldol反应所需要的构象。通过条件筛选,化合物3和甲醛在大位阻碱7-methyl-1,5,7-triazabicyclo[4.4.0]dec-5-ene(MTBD)作用下发生Aldol反应,生成的氧负离子对亚胺1,2-加成构建了氧杂环,得到化合物15,最后三级胺和碘甲烷反应生成季胺盐,醛发生Pinnick氧化得到羧基,得到内盐,从而完成了分子calophyline A的首次化学全合成。
总结:祖连锁课题组在对calophyline A分子结构深入解析的基础上,以本课题组独立发展的氮杂频哪醇重排反应、分子内Heck反应、合成后期的Aldol反应等为关键步骤,简洁高效地完成了分子calophyline A的首次化学全合成,这对于akuammiline家族吲哚类生物碱的合成和生物活性的研究都具有重要意义。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn