- 首页
- 资讯
四川大学张鑫课题组Science Advances:有机催化硫手性分子合成新方法
来源:四川大学 2024-10-10
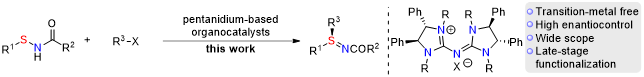
导读:近年来,硫立体中心的不对称合成方法的快速发展,为其在药物发现中的广泛应用奠定了基础。四川大学华西生物治疗全国重点实验室/华西公共卫生学院(华西第四医院)张鑫研究员团队一直致力于有机不对称催化以及硫手性化学研究(Science, 2019, 363, 400; Nature 2022, 604, 298; JACS Au 2023, 3, 700; Chem, 2021, 7, 1451)。在这些研究基础上,开发了一种高效的次磺酰胺不对称烷基化的方法,可以高效合成手性硫亚胺,该方法显示出硫相对于氮的独特化学选择性和高对映选择性(图2)。该论文发表在国际权威学术期刊 Science Advances。
图1. 不对称S-烷基化反应
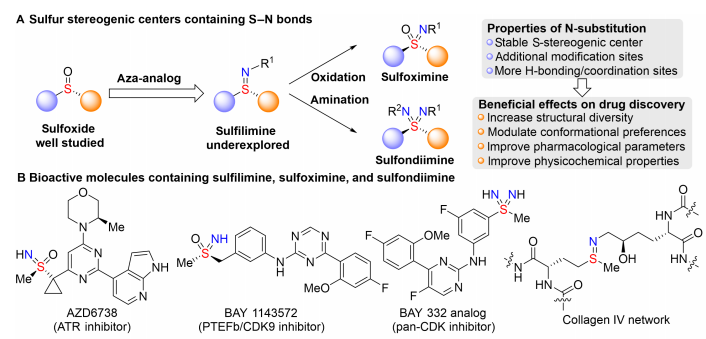
硫立体中心的不对称合成方法不断发展,为其在药物发现中的广泛应用奠定了基础。其中,亚砜是一个被长期研究且研究充分的S(IV)立体中心,在一些已上市的药物如埃索美拉唑和阿莫达非尼中是一个重要的部分,而硫亚胺是亚砜的氮杂类似物,它在药物发现中被大大低估了(图1A),它是一种多功能的合成中间体,也是生物活性分子的重要组成部分,氮原子的引入可以增加其结构多样性,并调节构象,从而大大提高一些候选药物的药理特性。最近的一些药物研究也证实了含有硫氮键的结构在生物活性分子中的重要性(图1B)。然而,硫亚胺在药物发现中的应用还未得到完全的开发,可能是由于其合成方法有限且由此导致的物理化学性质不明确。在条件筛选过程中,相对于传统的非手性催化剂四丁基溴化铵来说,使用手性催化剂PN1具有更好的化学选择性,对于乙氧基羰基,甲氧基羰基和苄基氧羰基等保护基的次磺酰胺都只生成S-烷基化的产物。当次磺酰胺的保护基为叔丁基羰基时,能够得到高收率和高对映选择性的目标产物。在此基础上,研究了反应条件对产率和对映体选择性的影响。仔细考察了催化剂、碱、溶剂和温度等参数,最终,在3 mol% PN1的催化作用下,溶剂为甲苯,碱为50%氢氧化钾水溶液,在-20°C下反应24小时,能够以99%的收率和93%的ee值得到目标产物2h。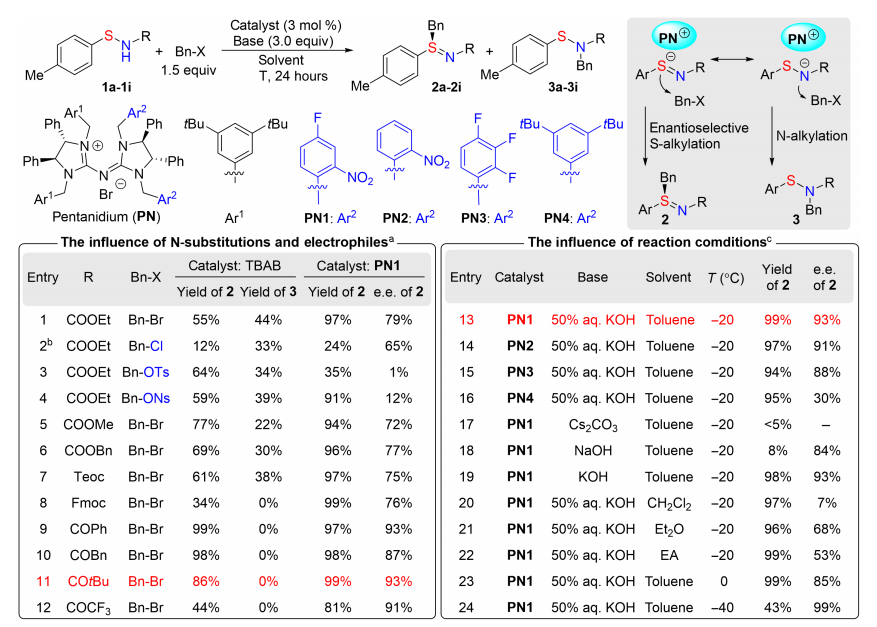 利用优化后的反应条件,对底物范围进行了探索(图4)。研究了一系列不同取代的芳基和烷基次磺酰胺(图4A)。首先,苯基及几种被不同取代的芳基次磺酰胺,包括空间受阻的2-甲基、3,5-二甲基和4-叔丁基,均能顺利发生硫烷基化反应,以优异的收率和对映选择性得到硫亚胺(2j-2m)。对于强给电子基甲氧基取代的芳基次磺酰胺,用叔丁基酰基和三氟乙酰基保护都能成功反应(2n和2o),有优秀的收率和对映选择性。该反应也能有效地得到多种不同位置被卤素原子取代的硫亚胺2p-2u。而且,吸电子基三氟甲基、酯基、醛基和硝基的耐受性都不错,产物2v-2y具有较高的产率和对映选择性。空间位阻较大的萘基,富电子和贫电子杂环次磺酰胺都可得到相应的硫亚胺(2z-2ac),产率高,对映选择性高。接着,一级、二级和三级烷基次磺酰胺都很好地得到预期的硫亚胺(2ad-2aj)。该反应还研究了不同的烷基卤化物(图4B)。用不同卤素原子及氰基取代的溴苄基反应,得到了具有高收率和高对映选择性的产物(2ak-2ao)。2-(溴甲基)萘和3-溴甲基噻吩也是优良的烷基化试剂,得到产物2ap和2aq,其ee值分别为97%和92%;被两个三氟甲基取代及间位被硝基取代的溴化苄(2ar,2as)的耐受性也良好。但是,在标准条件下使用了烯丙基溴化物,未能获得预期的硫烯丙基化产物2at,该产物通过[2,3]-σ重排迅速异构化为非手性氮烯丙基化产物2at’。当末端碳被苯基取代时,得到了高对映选择性的硫亚胺产物2au和2av。与1-溴-2-丁炔反应得到2aw和2ax的产物分别为88%和90%的 ee值。除此之外,作者还对药物伐地考昔和塞来昔布进行了后期修饰(图4C)。这些药物的非手性磺酰胺基团成功地用S(IV)立体中心进行了修饰,以良好的收率和高对映选择性得到药物衍生物2ay和2az。
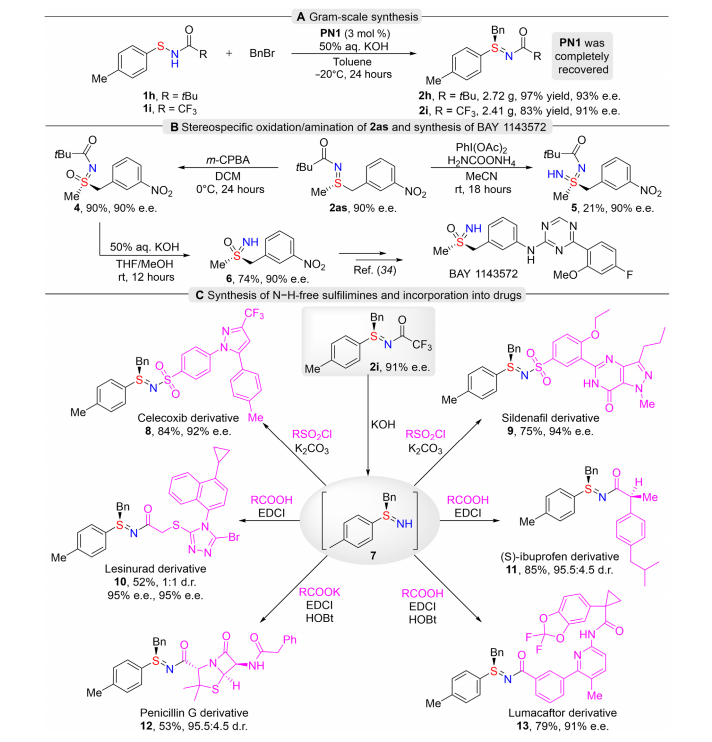
利用优化后的反应条件,对底物范围进行了探索(图4)。研究了一系列不同取代的芳基和烷基次磺酰胺(图4A)。首先,苯基及几种被不同取代的芳基次磺酰胺,包括空间受阻的2-甲基、3,5-二甲基和4-叔丁基,均能顺利发生硫烷基化反应,以优异的收率和对映选择性得到硫亚胺(2j-2m)。对于强给电子基甲氧基取代的芳基次磺酰胺,用叔丁基酰基和三氟乙酰基保护都能成功反应(2n和2o),有优秀的收率和对映选择性。该反应也能有效地得到多种不同位置被卤素原子取代的硫亚胺2p-2u。而且,吸电子基三氟甲基、酯基、醛基和硝基的耐受性都不错,产物2v-2y具有较高的产率和对映选择性。空间位阻较大的萘基,富电子和贫电子杂环次磺酰胺都可得到相应的硫亚胺(2z-2ac),产率高,对映选择性高。接着,一级、二级和三级烷基次磺酰胺都很好地得到预期的硫亚胺(2ad-2aj)。该反应还研究了不同的烷基卤化物(图4B)。用不同卤素原子及氰基取代的溴苄基反应,得到了具有高收率和高对映选择性的产物(2ak-2ao)。2-(溴甲基)萘和3-溴甲基噻吩也是优良的烷基化试剂,得到产物2ap和2aq,其ee值分别为97%和92%;被两个三氟甲基取代及间位被硝基取代的溴化苄(2ar,2as)的耐受性也良好。但是,在标准条件下使用了烯丙基溴化物,未能获得预期的硫烯丙基化产物2at,该产物通过[2,3]-σ重排迅速异构化为非手性氮烯丙基化产物2at’。当末端碳被苯基取代时,得到了高对映选择性的硫亚胺产物2au和2av。与1-溴-2-丁炔反应得到2aw和2ax的产物分别为88%和90%的 ee值。除此之外,作者还对药物伐地考昔和塞来昔布进行了后期修饰(图4C)。这些药物的非手性磺酰胺基团成功地用S(IV)立体中心进行了修饰,以良好的收率和高对映选择性得到药物衍生物2ay和2az。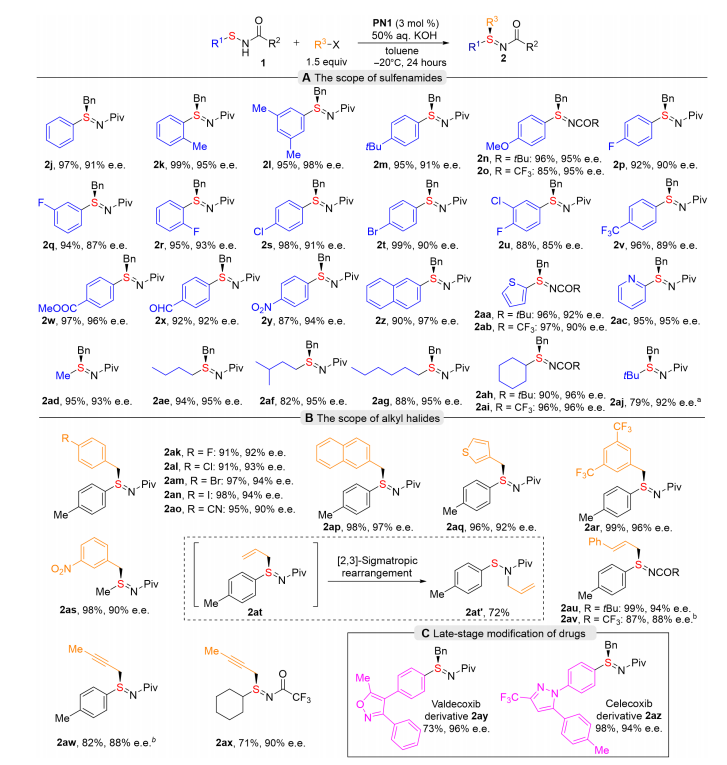 作者通过硫亚胺的克级实验和进一步的转化展示了该反应在有机合成中的应用(图5)。叔丁基酰基和三氟乙酰基保护的次磺酰胺在克级反应上没有损失产率和对映选择性,分别得到2.72g和2.41g的产物(图5A)。值得注意的是,该手性催化剂可以通过柱层析分离完全回收(>99%),并可以继续催化对映选择性反应而不失去反应性。对亚胺2as进行立体专一性氧化和胺化,也能得到富对映体的亚砜亚胺(sulfoximine)4和sulfondiimine 5(图5B)。并且,在简单条件下脱去亚砜4的保护基,得到无保护硫亚胺6,这是合成BAY 1143572的手性中间体。更有意义的是,去除硫亚胺2i的三氟乙酰保护基,得到无保护的硫亚胺7可直接进行下一步,无需进一步纯化(图5C)。硫亚胺7的N原子是后期的理想反应位点,可与含有磺酰氯或含羧酸的药物进行缩合,得到塞来昔布、西地那非、雷西那德、布洛芬、青霉素、鲁马卡托等药物分子的衍生物,进一步证明了该方法的实用性,促进了新型硫手性结构在药物研发中的应用。张鑫团队开发了一种高效的基于手性阳离子催化剂的次磺酰胺选择性硫烷基化方法。该方法对硫对氮具有独特的化学选择性和对映选择性,获得了多种对映体富集的硫亚胺。温和的条件和广泛的底物耐受性使该反应适合于药物的后期修饰。利用所建立的方法,塞来昔布和伐地考昔的非手性磺胺基团有效地被对映富集硫亚胺基取代。克级反应以及与磺酰氯或含羧酸药物的缩合也证明了对映体富集硫亚胺产物的实用性。上述工作主要由四川大学生物治疗全国重点实验室博士生王富城和硕士生向万兴共同完成,华西生物国重创新班谢奕廷参与了本研究工作。感谢中央高校基本科研业务费专项资金项目的资助。张鑫,特聘研究员,博士生导师,国家海外高层次青年人才,四川省高层次人才,四川大学华西生物治疗全国重点实验室和华西公共卫生学院(华西第四医院)共聘专家。2014年本科毕业于中国科学技术大学, 2019年于新加坡南洋理工大学获得博士学位,随后进行了博士后研究工作,于2022年加入四川大学开展独立研究工作,研究方向包括有机化学、药物化学、新型催化剂设计与合成、抗纤维化药物的合成与修饰等,目前以第一作者/通讯作者身份在在Science、Nature、Chem、JACS Au、Science Advances等著名国际期刊发表多篇文章。
作者通过硫亚胺的克级实验和进一步的转化展示了该反应在有机合成中的应用(图5)。叔丁基酰基和三氟乙酰基保护的次磺酰胺在克级反应上没有损失产率和对映选择性,分别得到2.72g和2.41g的产物(图5A)。值得注意的是,该手性催化剂可以通过柱层析分离完全回收(>99%),并可以继续催化对映选择性反应而不失去反应性。对亚胺2as进行立体专一性氧化和胺化,也能得到富对映体的亚砜亚胺(sulfoximine)4和sulfondiimine 5(图5B)。并且,在简单条件下脱去亚砜4的保护基,得到无保护硫亚胺6,这是合成BAY 1143572的手性中间体。更有意义的是,去除硫亚胺2i的三氟乙酰保护基,得到无保护的硫亚胺7可直接进行下一步,无需进一步纯化(图5C)。硫亚胺7的N原子是后期的理想反应位点,可与含有磺酰氯或含羧酸的药物进行缩合,得到塞来昔布、西地那非、雷西那德、布洛芬、青霉素、鲁马卡托等药物分子的衍生物,进一步证明了该方法的实用性,促进了新型硫手性结构在药物研发中的应用。张鑫团队开发了一种高效的基于手性阳离子催化剂的次磺酰胺选择性硫烷基化方法。该方法对硫对氮具有独特的化学选择性和对映选择性,获得了多种对映体富集的硫亚胺。温和的条件和广泛的底物耐受性使该反应适合于药物的后期修饰。利用所建立的方法,塞来昔布和伐地考昔的非手性磺胺基团有效地被对映富集硫亚胺基取代。克级反应以及与磺酰氯或含羧酸药物的缩合也证明了对映体富集硫亚胺产物的实用性。上述工作主要由四川大学生物治疗全国重点实验室博士生王富城和硕士生向万兴共同完成,华西生物国重创新班谢奕廷参与了本研究工作。感谢中央高校基本科研业务费专项资金项目的资助。张鑫,特聘研究员,博士生导师,国家海外高层次青年人才,四川省高层次人才,四川大学华西生物治疗全国重点实验室和华西公共卫生学院(华西第四医院)共聘专家。2014年本科毕业于中国科学技术大学, 2019年于新加坡南洋理工大学获得博士学位,随后进行了博士后研究工作,于2022年加入四川大学开展独立研究工作,研究方向包括有机化学、药物化学、新型催化剂设计与合成、抗纤维化药物的合成与修饰等,目前以第一作者/通讯作者身份在在Science、Nature、Chem、JACS Au、Science Advances等著名国际期刊发表多篇文章。文献详情:
Synthesis of chiral sulfilimines by organocatalytic enantioselective sulfur alkylation of sulfenamidesFucheng Wang, Wanxing Xiang, Yiting Xie, Linge Huai, Luoqiang Zhang, Xin Zhanghttps://www.science.org/doi/10.1126/sciadv.adq2768
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn