

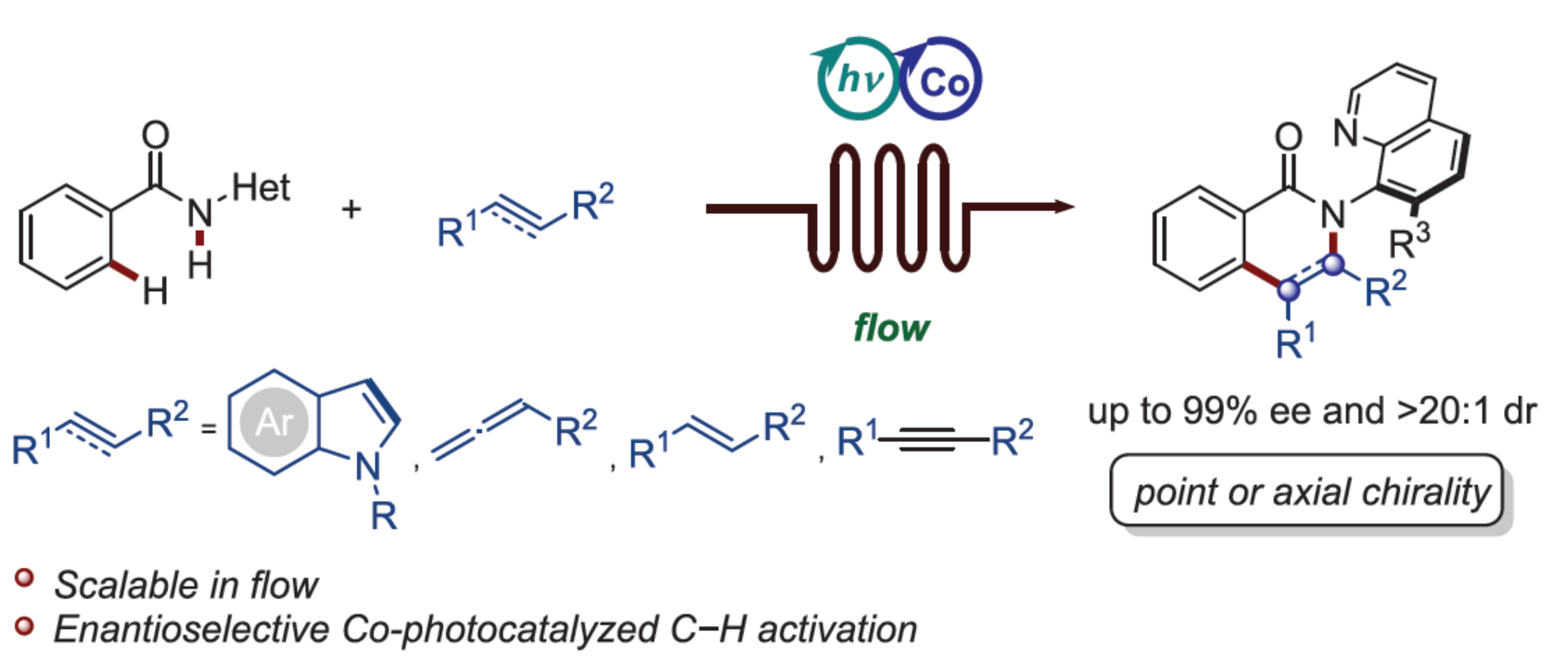
正文

(图片来源:J. Am. Chem. Soc.)
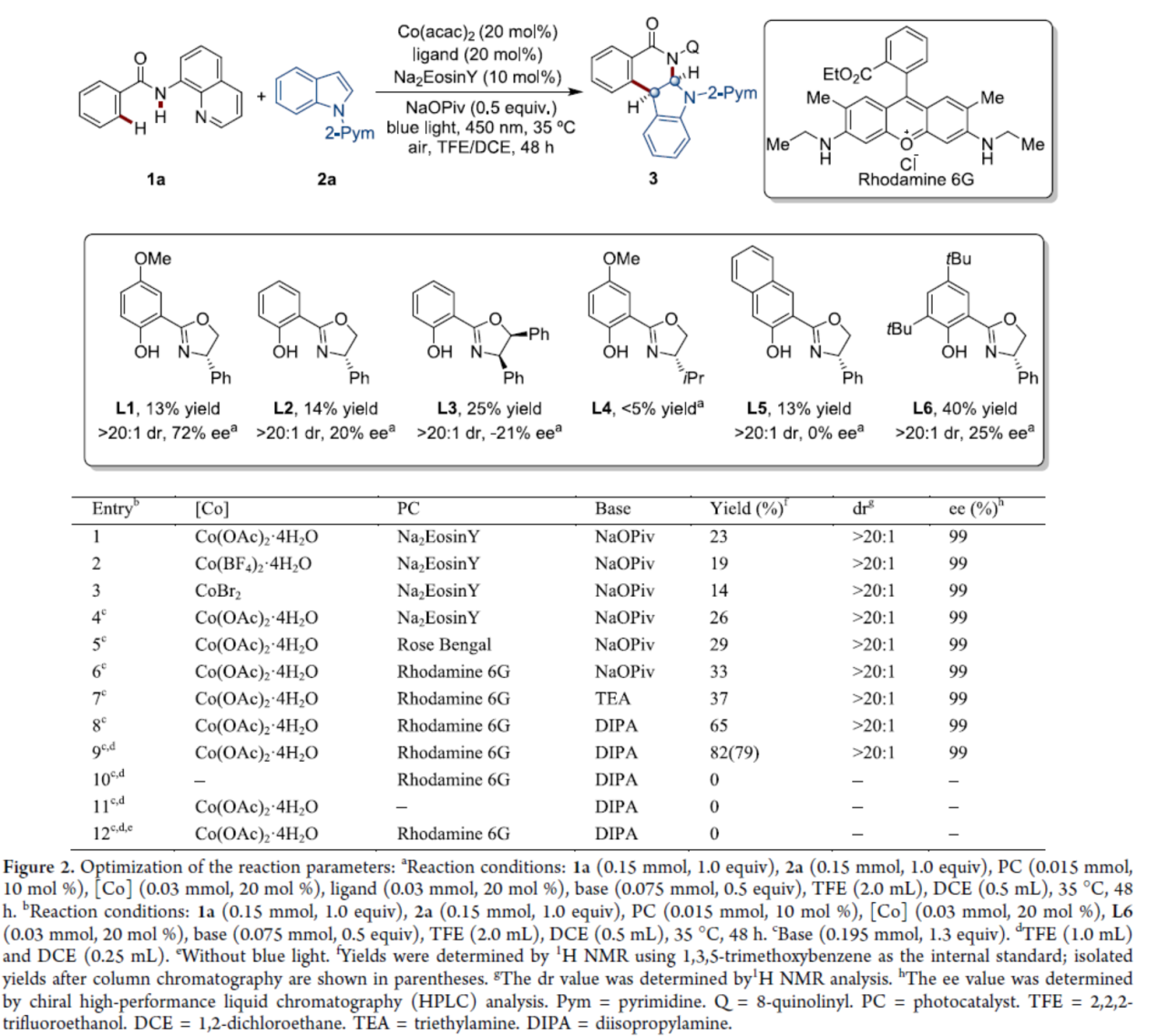
首先,作者以苯甲酰胺衍生物1a与吲哚衍生物2a作为模型底物,进行了相关反应条件的筛选(Figure 2)。当Co(OAc)2·4H2O(20 mol %)作为金属催化剂,Rhodamine 6G(10 mol %)作为光催化剂,L6(20 mol %)作为手性配体,二异丙胺(DIPA,1.3 equiv)作为碱,蓝色LEDs(450 nm)作为光源,在TFE/DCE(体积比为4:1)混合溶剂中35 oC反应48 h,可以79%的分离收率得到产物3,dr > 20:1,ee为99%。
(图片来源:J. Am. Chem. Soc.)
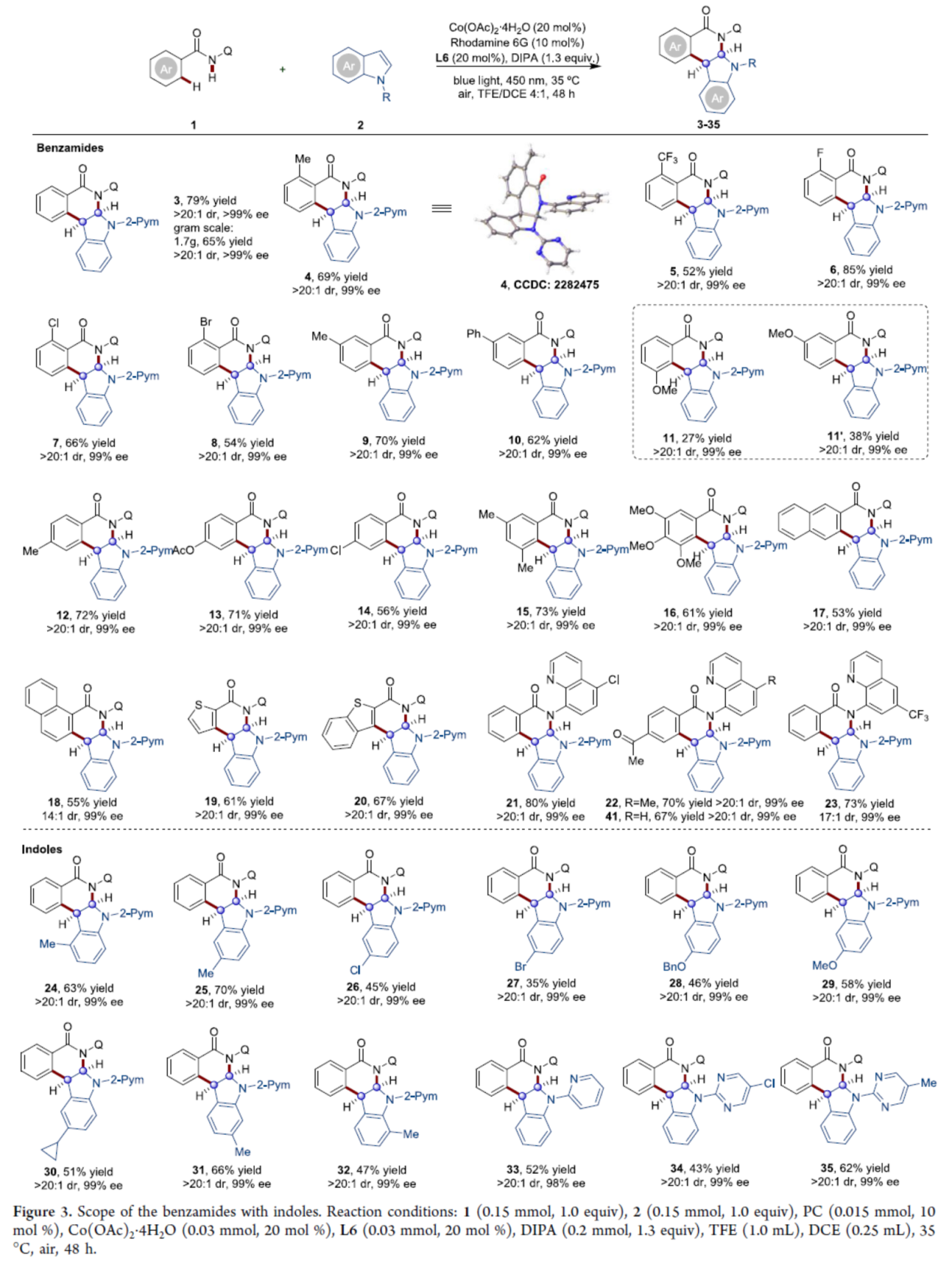
在获得上述最佳反应条件后,作者对底物范围进行了扩展(Figure 3)。首先,当苯甲酰胺底物1中的芳基上含有不同电性基团时,可以中等至良好的收率获得所需的产物4-14,作为单一的非对映异构体,具有优异的对映选择性。其中,对于间甲氧基取代的底物1i,由于甲氧基的强给电子效应和弱的导向能力,获得了区域异构体混合物11(27%收率,99% ee)和11′(38%收率,>99% ee)。二/三取代的N-喹啉基苯甲酰胺以及具有潜在配位硫的杂芳基化合物,也是合适的底物,获得相应的产物15-20,收率为53-73%,dr为14:1->20:1,ee均为99%。5-Cl、5-Me和6-CF3基团取代的氨基喹啉,可以优异立体选择性获得相应的产物21-23,收率为70-80%。其次,一系列不同取代的吲哚衍生物,均可顺利进行反应,获得相应的产物24-35,收率为53-73%,dr > 20:1,ee为98-99%。
(图片来源:J. Am. Chem. Soc.)
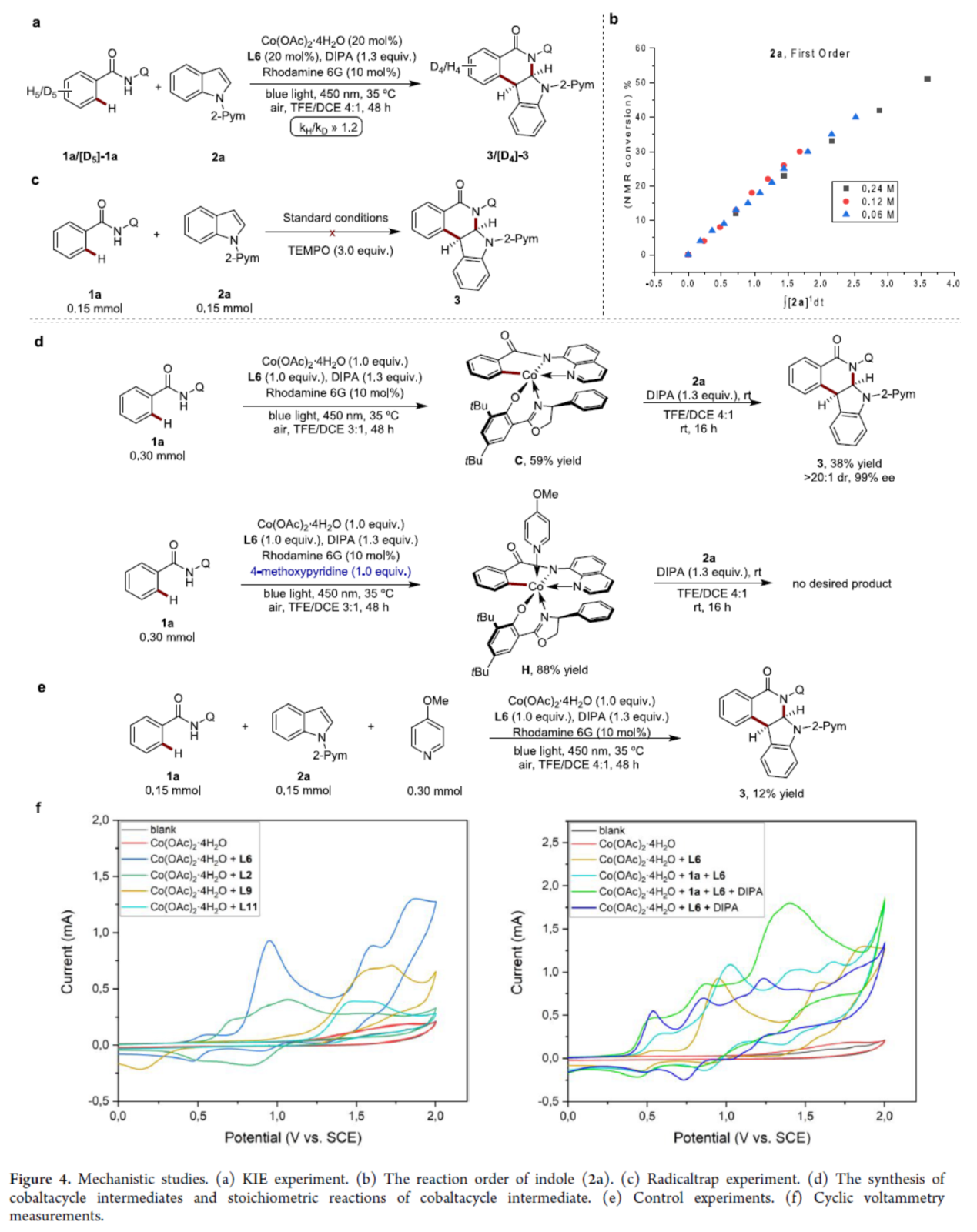
紧接着,作者还对反应机理进行了进一步的研究(Figure 4)。KIE实验结果表明,C-H断裂不参与速率决定步骤(Figure 4a)。吲哚2a的一级速率依赖性结果表明,速率决定步骤中涉及插入或还原消除的过程(Figure 4b)。自由基捕获实验结果表明,反应涉及自由基中间体的形成(Figure 4c)。钴环中间体的合成及其化学计量反应研究结果表明,中间体C参与催化循环的过程(Figure 4d)。当向标准反应中加入吡啶时,仅获得12%收率的产物3,表明吡啶具有竞争性配位(Figure 4e)。CV实验结果表明,L6增强了钴(II/III)体系的敏感性(Figure 4f)。
(图片来源:J. Am. Chem. Soc.)
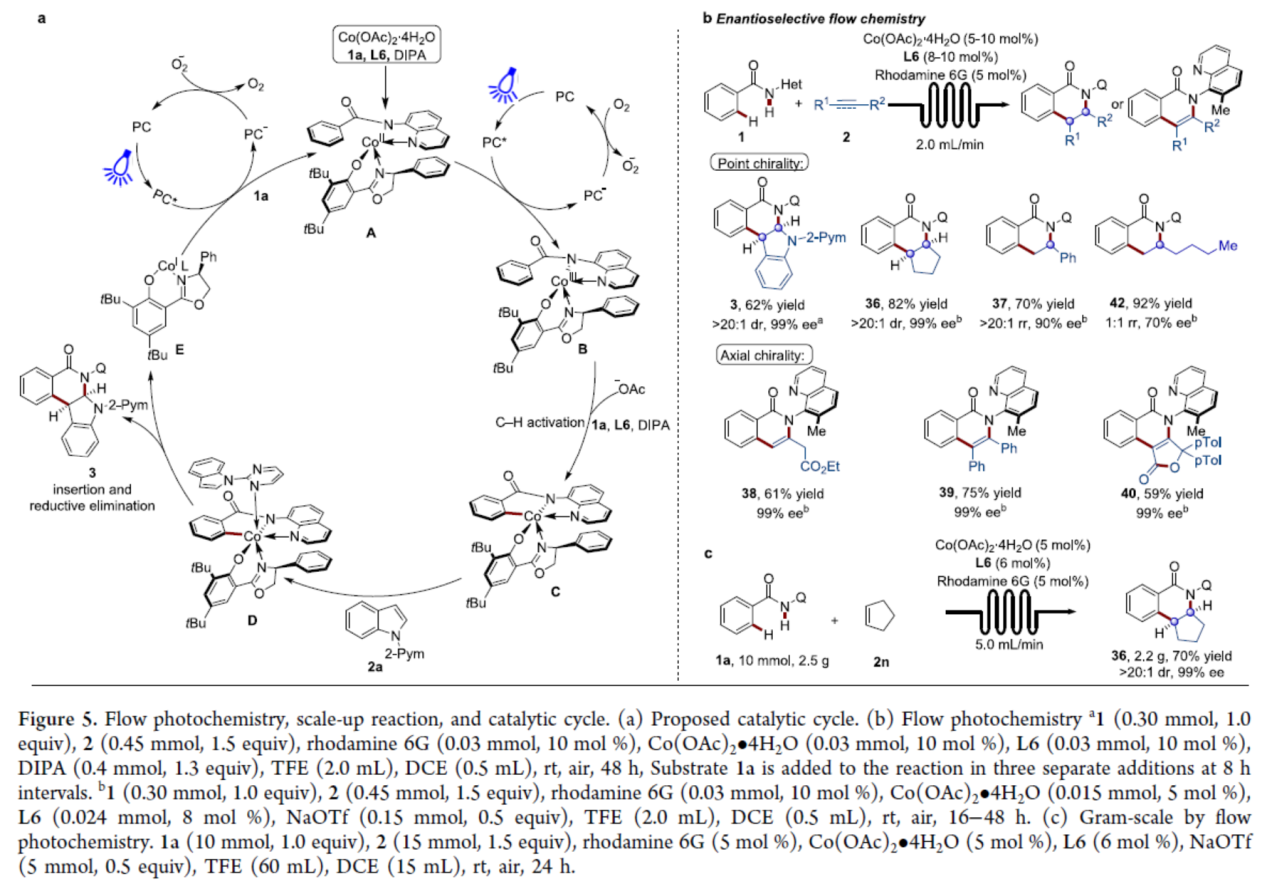
基于上述的研究以及相关文献的查阅,作者提出了一种合理的催化循环过程(Figure 5a)。首先,在1a、L6和DIPA的存在下,光激发的Rhodamine 6G氧化钴(II),生成手性八面体钴(III)配合物B。其次,通过对映选择性决定碱辅助的C-H活化过程,生成钴环中间体C。随后,在嘧啶导向基团下,中间体C与2a进行区域选择性迁移插入以及还原消除,生成目标产物3和钴(I)配合物E。此外,在空气氧的存在下,通过Rhodamine 6G在照射下将钴(I)配合物再氧化为钴(II) 配合物,从而再生活性钴(II)催化剂。
最后,作者对反应的实用性进行了研究(Figure 5b)。首先,反应在连续流动条件下成功进行,可以62%的收率得到产物3,dr >20:1,ee 为99%。对于其它的烯烃(如环戊烯和苯乙烯),也可以良好的收率和优异的对映选择性获得相应的产物36和37。值得注意的是,这种连续流动条件对于使用联烯和炔烃构建C-N轴手性也是有效的,如38-40。非活化的烯烃也是合适的底物,尽管对映选择性有所降低(42)。此外,1a和2n的连续流克级规模实验,同样可以70%的收率得到产物36,dr >20:1,ee 为99%,进一步证明了反应的实用性。
(图片来源:J. Am. Chem. Soc.)
总结
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn