

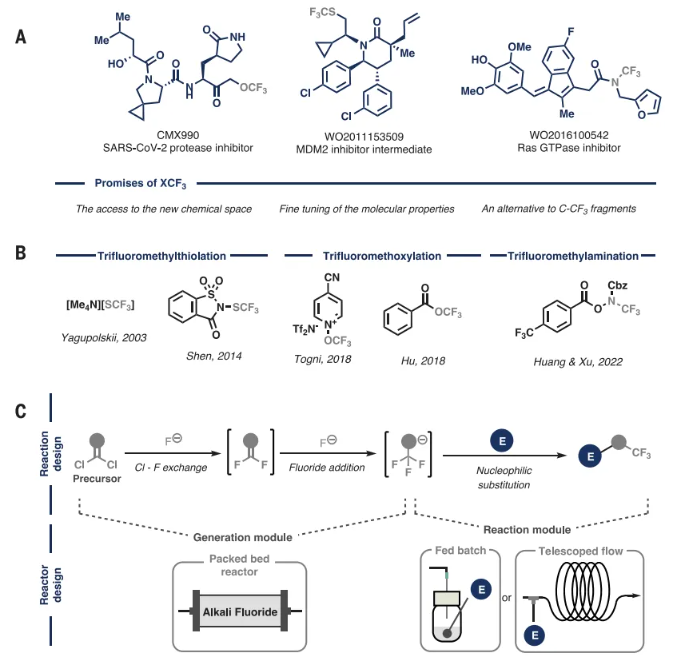
图1. 研究背景(图片来源:Science)
最近,人们对加入与杂原子相连的三氟甲基的兴趣日益浓厚,如三氟甲氧基(OCF3)、三氟甲硫基(SCF3)和N-三氟甲基(NCF3)(图1A)。这些新兴的氟化单元进一步调节亲脂性、抗氧化性和酸碱性。尽管这些片段很有吸引力,但它们在API中的代表性却远远不足,占总含CF3药物的不到10%。主要障碍在于缺乏将它们整合到分子骨架中的合成方法(图1B)。此外,这些定制试剂的制备通常涉及多个步骤的繁琐过程,从而产生大量氟化废物。因此,开发在合成后期从简单的非氟化有机分子合成这些单元的方法至关重要。理想情况下,这将涉及使用廉价且广泛可用的碱性氟化物源,以避免进一步污染。化学加——合成化学产业资源聚合服务平台。
本文的策略旨在开发一种多功能方案,该方案能够按需生成N-、S-和O-CF3阴离子并促进它们立即用作亲核试剂(图1C,反应设计)。该策略需要使用碱性氟化物盐作为氟源,结合每个单元的适当前体来制备三氟甲基杂原子阴离子。前体应(i)实验台稳定,(ii)可商购或易于制备,(iii)具有高原子经济性。从概念上讲,作者设想的机制涉及通过两个连续的氯-氟交换反应从这些前体中顺序制备三氟甲基,最终添加氟化物以产生所需的亲核试剂。然后,这些活性物种将立即与合适的亲电试剂反应以形成新的C-N、C-S或C-O键。
作者基于之前对氯化硫中氯氟交换的研究,决定利用流动化学技术进行这些转化(图1C,反应器设计)。由于表面积增加,有机中间体与不溶性氟化物盐之间的混合得到改善,这种设计提高了多次氟化物添加的效率。这种方法提供了更高的安全性,因为所有形成的中间体都包含在微流体系统中。此外,通过在CF3X阴离子发生器下游集成一个反应模块,实现了阴离子与亲电试剂的无缝反应,为带有杂原子-CF3单元的分子衍生化提供了一个发散且精简的平台。
研究始于引入NCF3片段。作者推断受保护的亚胺基二氯(图2,1-3)可作为合适的前体,通过与氟源反应生成NCF3(PG)阴离子,从而通过三个连续的碳氟键形成获得亲核物种。这些前体可以从廉价且易得的起始原料中获得,以克为单位,带有不同的保护基(Ts 1 >30 g、Cbz 2 >4 g、Boc 3 7 g)。此外,15N标记的亚胺基二氯也很容易合成[(15N)Ts 1 >3 g],从而可以获得同位素标记的含15NCF3的产品。由于试剂1是固体,而试剂2和3是液体,因此它们与光气的结构相似性引起的安全问题在一定程度上因其物理状态而得到缓解。此外,1具有良好的热稳定性,仅在温度高于180 °C时才会发生分解。
初步批量实验表明,将对甲苯磺酰基保护的亚胺基二氯1与9当量的氟化铯(CsF) 在乙腈中混合后,2小时后即可通过19F NMR观察到目标三氟甲氨基阴离子物种。随后将苄基溴添加到粗反应混合物中,在80 °C下反应2小时后,以63%的产物得到三氟甲基胺4。
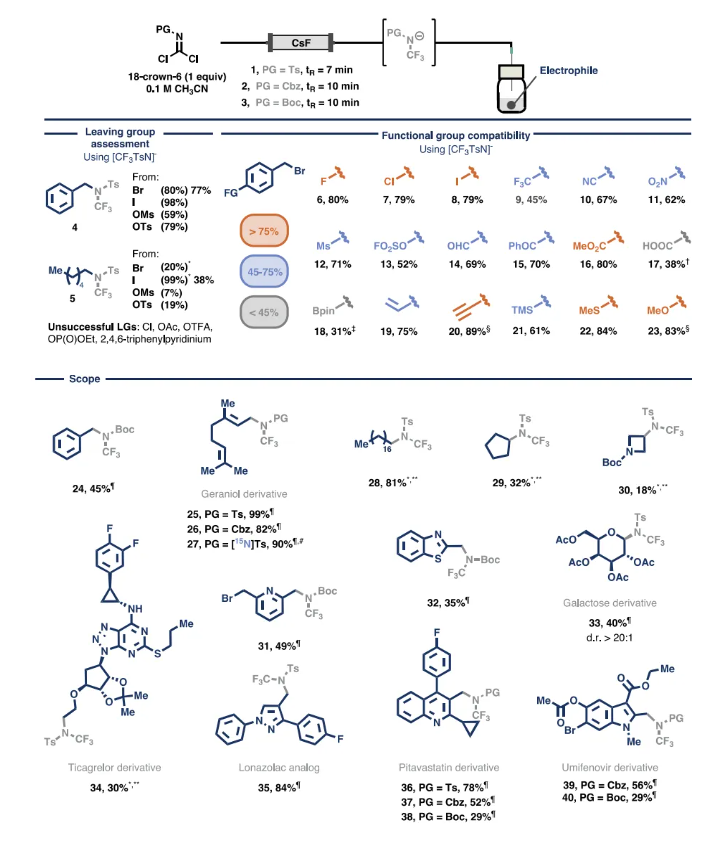
图2. 按需生成NCF3(PG)阴离子及其与亲电试剂的反应(图片来源:Science)
接下来,将这种方法转变为作者设计的流动系统。为了在保持最佳亲核性的同时缓解α-脱氟化,将18-冠-6与本文的前体结合使用。这种方法使铯阳离子能够络合,防止它们与氟原子相互作用并稳定所需的阴离子种类。因此,将亚胺基二氯1和18-冠-6 (1当量)的溶液流过装有CsF的墨盒,可将NCF3(Ts)阴离子的生成加速至仅7分钟。
在确认了模块化的良好结果后,继续通过离去基团评估来评估阴离子物种的反应性(图2,离去基团评估)。结果表明,需要有效的离核剂才能使反应顺利进行。对于苄基基准底物,氯化物、乙酸酯、三氟乙酸酯和Katritzky盐亲电试剂未能产生所需产物。而溴化物、碘化物、甲磺酸酯和对甲苯磺酸酯衍生物是形成产物4的合适底物,产率59%- 98%。对于正己基底物,含碘底物在三氟甲磺酸银存在下发生了令人满意的取代,从而形成了烷基胺 5,而溴化物、甲磺酸酯和对甲苯磺酸酯类似物仍然提供了适合药物化学应用的目标产物。
随后,作者着手研究生成的NCF3(Ts)阴离子与不同官能团的兼容性(图2,官能团兼容性)。具有卤素取代基和强吸电子基团(如三氟甲基、腈和硝基)的衍生物以良好的产率高效地转化为相应的产物。羰基衍生的官能团(如醛、苯基酮和甲酯)也与三氟甲基胺化反应在很大程度上兼容。尽管具有质子性质,但游离羧酸的存在也是可以容忍的。此外,硼酸频哪酯取代的芳烃反应产率在合成上是有用的,而乙烯基和乙炔衍生物反应产率较高。最后,三甲基硅基、甲氧基和硫代甲氧基等电子给体取代基是兼容的,可以以良好至极好的产率生成取代的三氟甲基胺。
接下来,作者探索了三氟甲基胺化方案与各种亲电试剂的兼容性。NCF3片段带有不同的保护基,在80 °C下仅用2小时就成功安装在苄基和烯丙基结构单元中。本文的方法与从15N标记的前体开始直接引入同位素标记的 15NCF3(PG)片段进一步兼容。对于这种转化,阴离子的生成和取代步骤都是批量进行的,突出了该方法的通用性。接下来,一级和二级烷基碘化物都经历了有效的三氟甲基胺化,还以中等至良好的产率获得了含氮杂环和乙酰基保护的半乳糖基溴化物。最后,作者将此方案应用于各种API中间体,包括源自密集功能化的替格瑞洛、氯那唑酸类似物、匹伐他汀和乌米非韦的中间体,证明了与复杂分子结构的兼容性以及不同N保护基团的结合。
在NCF3(PG)阴离子生成流动系统取得成功的基础上,作者继续研究如何按照按需生成策略加入基于硫属元素的三氟甲基片段。对于三氟甲硫基阴离子[(SCF3)-]的按需流动生成,选硫光气41为前体。对于三氟甲氧基阴离子[(OCF3)-],选择双光气42作为前体。与受保护的亚胺基二氯化物的过程类似,与氟化铯和选择的前体的反应最初会分别产生气态硫羰基或碳酰氟中间体。然而,封闭的流动系统确保这些中间体迅速与另一个氟离子发生进一步反应,从而快速完全形成所需的三氟甲基硫属元素阴离子,从而减轻任何潜在的安全风险。经过短暂的优化,三氟甲硫醇阴离子的停留时间最短为5分钟,三氟甲氧基阴离子的停留时间最短为7分钟。有了这些结果,作者开始评估各种亲电配偶体。
SCF3片段可成功整合到一级(图3)和二级烷基亲电试剂中,以良好至极好的产率(高达94%)提供天然产物衍生物,如SCF3修饰的蛋氨酸、胆固醇和雄酮。与苄基和烯丙基底物(包括塞来昔布衍生物)的亲核取代反应产生了产率极高的三氟甲硫基化产物。这些转化可以以叠层流动的方式高效进行,从而将反应时间从2小时缩短到仅5分钟,同时保持几乎相同的产率。生成的阴离子也经过芳香亲核取代反应,生成Csp2-SCF3产物,以及亲核酰基取代反应,形成所需的硫酯。
在本文的亲核三氟甲氧基化方案中,二级烷基溴化物以良好的产率迅速转化为相应的产物。该反应是多功能的,可以为具有多个官能团和杂环骨架的烯丙基和苄基底物提供良好至优异的产率的产品,还适用于API中间体衍生物,如塞来昔布、匹伐他汀、乌米芬诺韦和洛那唑酸类似物。此外,三氟甲氧基阴离子也可发生SNAr型反应,且可以修饰糖基底物。
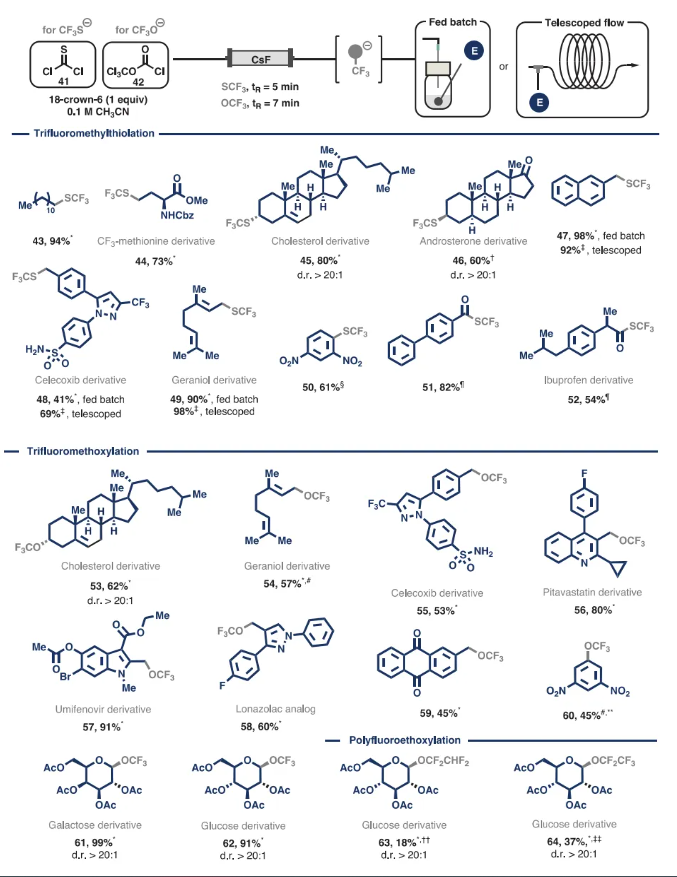
图3. 按需生成SCF3和OCF3阴离子及其与亲电试剂的反应(图片来源:Science)
此外,本文的方法可以扩展到包含更长的多氟乙氧基链。通过使氟烷基酸酐作为阴离子前体流过CsF填充床,这些底物可以首先经历酰氟形成,然后在第二次添加氟化物时形成烷氧基阴离子。利用这种策略获得了四氟乙氧基和五氟乙氧基衍生的糖基产物。
总结
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn