(图片来源:Nature)
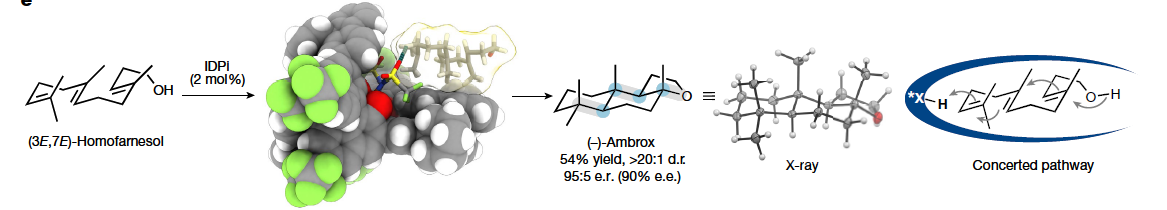
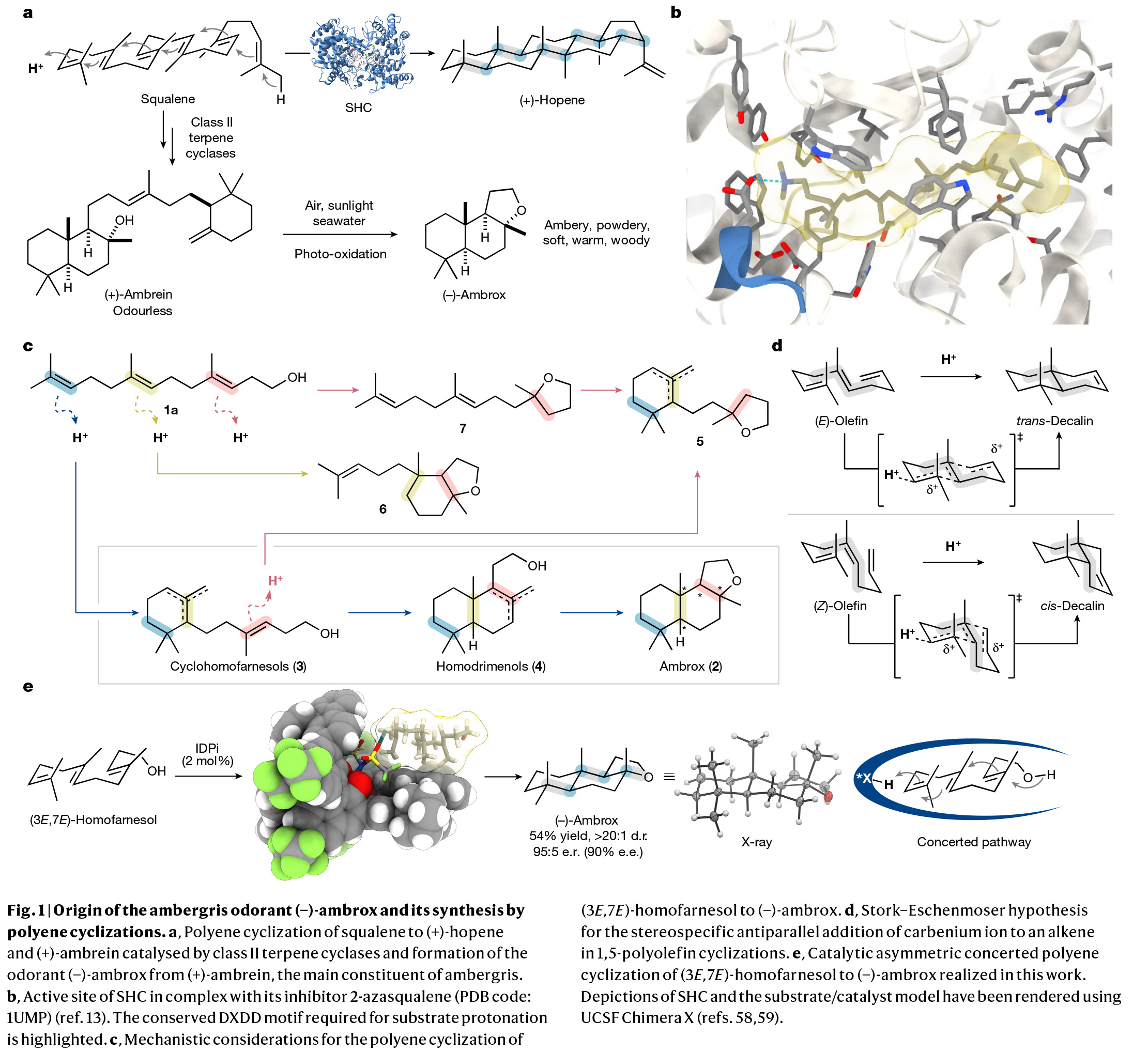
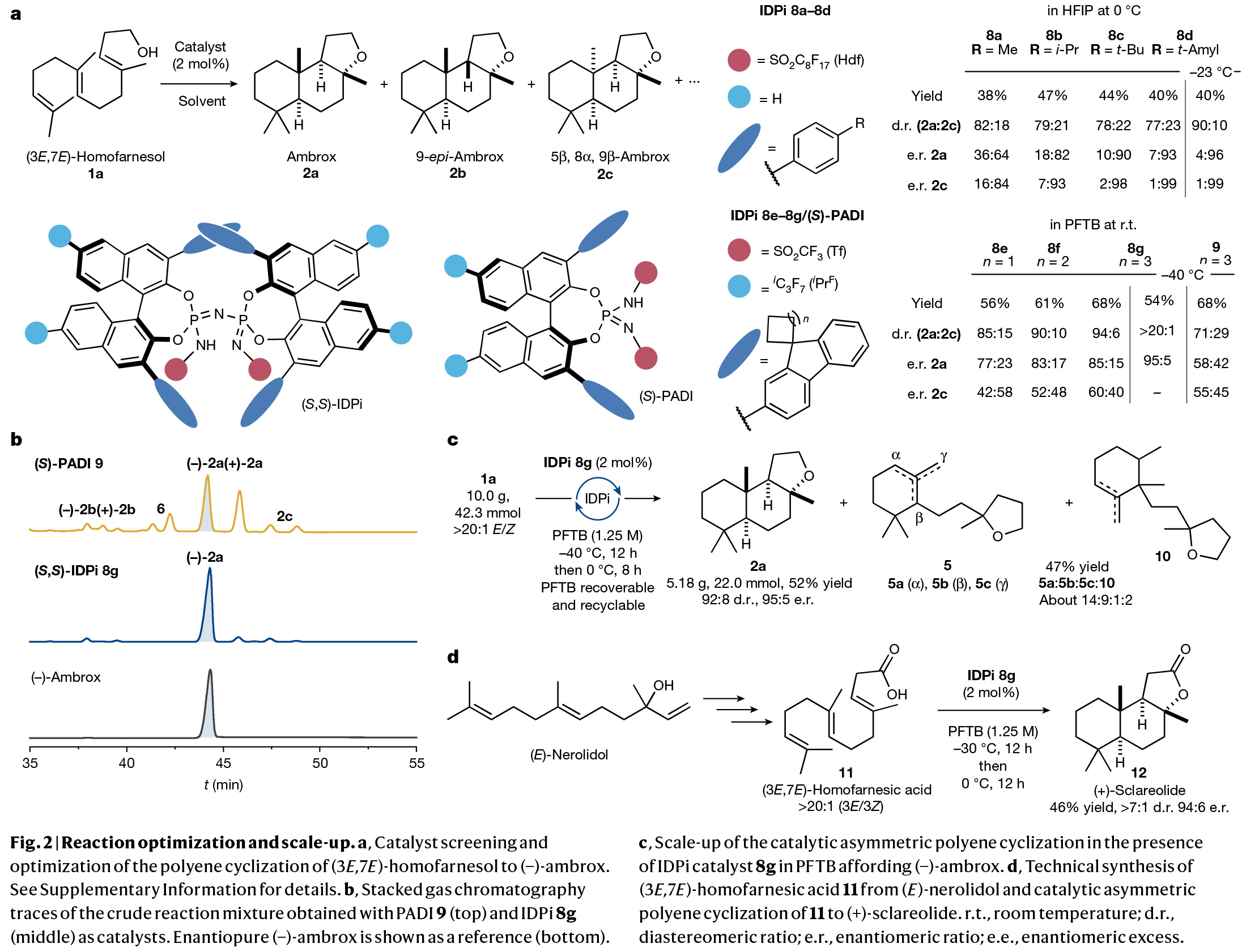
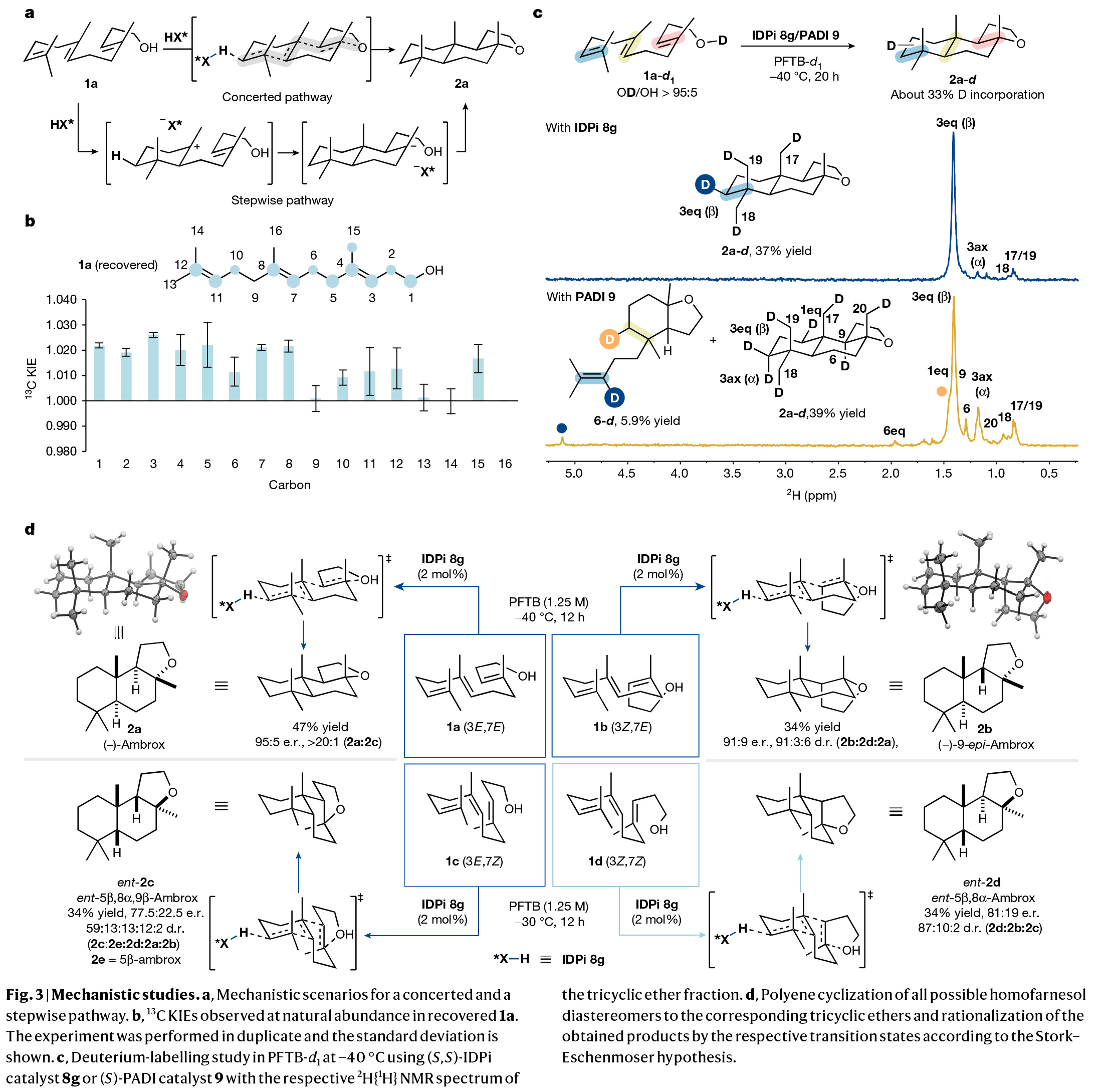
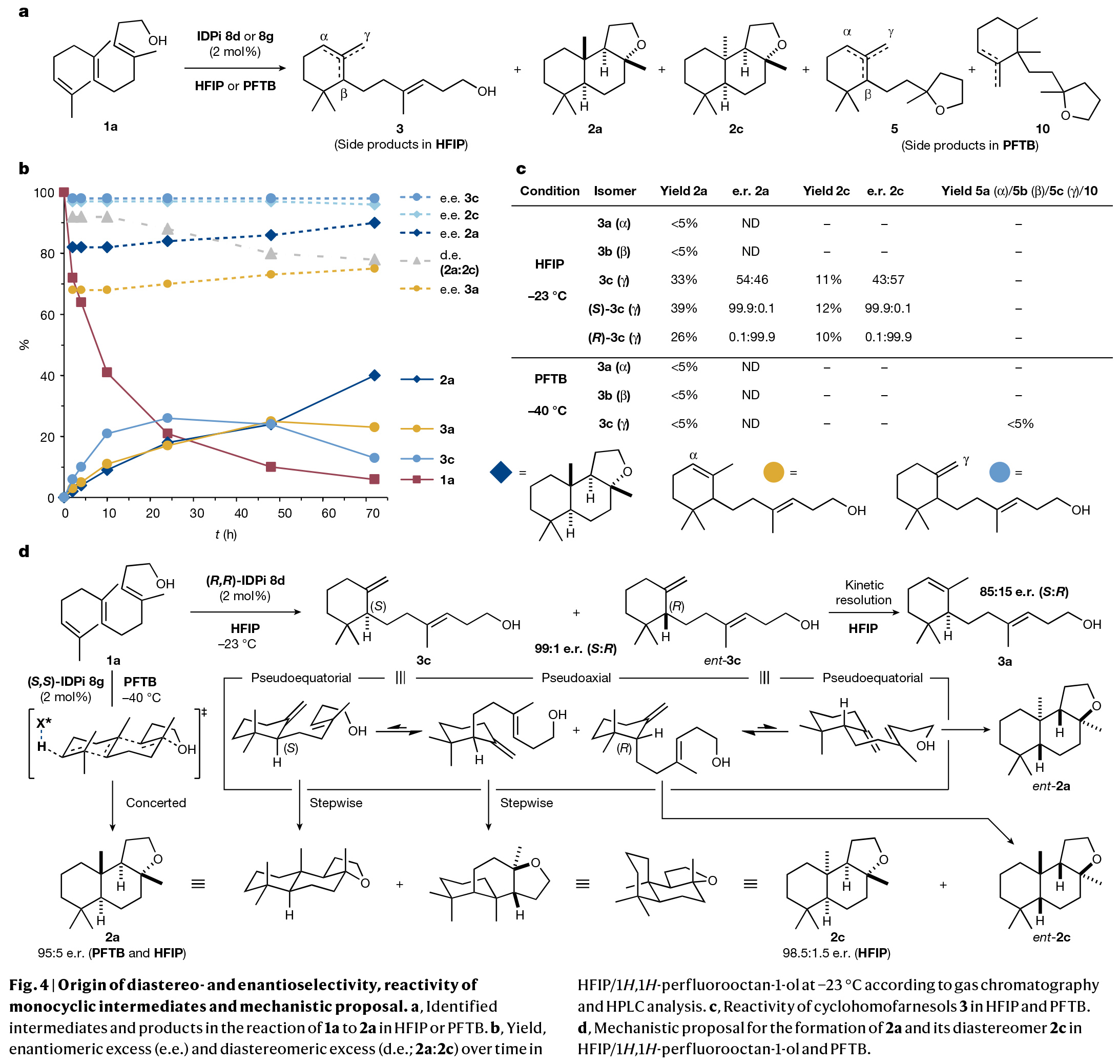
多烯环化是生物学中最复杂且最具挑战性的转化之一。其可以在一步反应中中,利用简单的非环前体实现多根碳碳键、环体系和立体中心的构建。而在构建的同时实现产物立体化学的精确控制对化学家来说是一项艰巨的任务。特别是利用(3E,7E)-homofarnesol的多烯环化来合成天然存在且具有重要价值的(−)-ambrox是化学合成中长期存在的挑战。最近,德国马克斯-普朗克研究所Benjamin List课题组报道了在氟化醇的存在下,使用具有高Brønsted酸性的IDPi催化剂,通过催化不对称多烯环化,以良好的非对映选择性和对映选择性实现了(−)-ambrox和倍半萜内酯天然产物(+)-sclareolide的合成(Fig. 1)。化学加——科学家创业合伙人,欢迎下载化学加APP关注。首先,作者以(3E,7E)-homofarnesol 1a为模板底物,对其环化过程进行了条件筛选(Fig. 2a)。实验结果表明,两种不同条件下的两种催化剂模式(IDPi 8d,HFIP;和 IDPi 8g,PFTB)成为以高产率、非对映和对映选择性提供ambrox 2a的最佳体系。此外,作者通过将IDPi催化剂8g与具有高酸性但结构约束较弱的PADI(N,N’-bistriflylphosphoramidimidate)催化剂9进行比较,后者产生了复杂的产物混合物,这进一步证明了受限活性位点的重要性(Fig. 2b)。在最优反应条件下,作者对多烯环化反应的规模化合成进行了考察。经过催化剂的定量回收和纯化,作者以52%的产率得到了5.2 g (-)-ambrox,dr = 92:8, er = 95:5,部分环化产物5和10的产率为47%(Fig. 2c)。这相当于在20小时的反应时间内有296 g l−1的理论体积生产率。目前最优的(−)-ambrox生物催化生产工艺在72小时内可实现300-450 g l−1 (3E,7E)-homofarnesol的完全转化。将(3E,7E)-homofarnesic酸(很容易从(E)-nerolidol中获得)在PFTB中的反应条件下,可以以46%的产率,>7:1 dr和94:6 er得到所需的内酯天然产物12(Fig. 2d)。为了深入了解多烯环化的机理,并探讨其高化学选择性、非映体选择性和对映体选择性的来源,作者进行了一系列控制实验。从多烯1a形成三环2a的不同机理是可以想象的。从线性多烯构建三环体系既可以通过协同的级联环化进行,也可以通过形成单环和双环中间体的完全逐步进行(Fig. 3a)。受动力学同位素效应(KIE)研究的启发,在天然丰度下探索Diels-Alder环加成的协同性质,作者设想一个类似的实验是否也可以得出对多烯环化性质的了解。在协同多烯环化的情况下,由于每根化学键的形成都涉及到速率决定步骤,因此在所有双键位置上都可能存在KIEs。在两个独立的实验中(在-40 oC下转化率分别为96%和91%),在回收的(3E,7E)-homofarnesol中的每个双键上均观察到了较小但具有统计学意义的13C KIEs,这表明质子化和C-C键的形成是同时发生的(Fig. 3b)。接下来,作者进行了氘标记研究,进一步阐明了IDPi催化多烯环化的机理,并探索了初始质子化过程的选择性。在协同多烯环化的情况下,单一氘化位点是可预期的,而多个标记位置将是逐步过程的特征。通过比较−40 °C下IDPi催化的多烯环化反应所回收的产物2a的2H{1H}和1H NMR,作者发现了一个单一的氘化位点(Fig. 3c)。这表明在低温(- 40 °C),IDPi 8g存在下所形成的(−)-ambrox大部分是由协同多烯环化产生的。根据2H{1H}NMR得出,从γ-环homofarnesol 3c在-40 °C下通过逐步途径形成(−)-ambrox的比例小于5%。而对赤道轴位置的高选择性表明在内烯烃上存在立体定向反平行加成。另一个重要的观察结果是(3E,7E)-homofarnesol的内部或近端双键的质子化或重原子化没有产生任何副产物。相比之下,从IDPi催化的多烯环化中分离出的产物2a在多个位点上观察到了氘的结合。由于在IDPi催化的多烯环化反应中并没有观察到双环副产物6,因此证实了IDPi催化剂对远端双键质子化的高选择性。接下来,作者通过将homofarnesol 1的所有可能的非对映体置于反应条件下,进一步研究了IDPi催化的多烯环化的协同性质(Fig. 3d)。对于每一种非对映体,各自的主要分离产物的形成可以用Stork-Eschenmoser假设来解释,这与协同多烯环化过程相一致。此外,需要将反应温度提高到-30 oC才能转化(3E,7Z)和(3Z,7Z)-homofarnesol (1c和1d)。作者认为在较低温度下,结构拥挤的底物,如1c和1d会无法进入受限的活性位点。最后,为了深入的理解不同非对映选择性和对映选择性的来源,作者进行了控制实验(Fig. 4)。实验结果表明IDPi的受限活性位点优先选择醇附近的更容易接近的双键,而不是拥挤的环己烯。在此进行的机理研究的基础上,作者认为催化剂8g达到所观察到的高非映体和对映体选择性的关键是协同反应途径优于逐步过程。Benjamin List课题组报道了可规模化的(3E,7E)-homofarneso不对称多烯环化,实现了重要的(−)-ambrox的合成,解决了化学合成中长期存在的挑战,并以前所未有的立体选择性提供了所需的产物。相信该方法将在相关的多烯环化中得到广泛应用,并可能加速从现成的非手性起始原料实现天然产物和药物的不对称合成。文献详情:
The catalytic asymmetric polyene cyclization of homofarnesol to ambrox. Na Luo, Mathias Turberg, Markus Leutzsch, Benjamin Mitschke, Sebastian Brunen, Vijay N. Wakchaure, Nils Nöthling, Mathias Schelwies, Ralf Pelzer, Benjamin List*. https://doi.org/10.1038/s41586-024-07757-7.