- 首页
- 资讯
河南师范大学江智勇课题组Angew:通过光氧化还原催化去消旋化实现轴手性N-芳基喹唑啉酮的模块化合成
来源:河南师范大学 2024-07-31
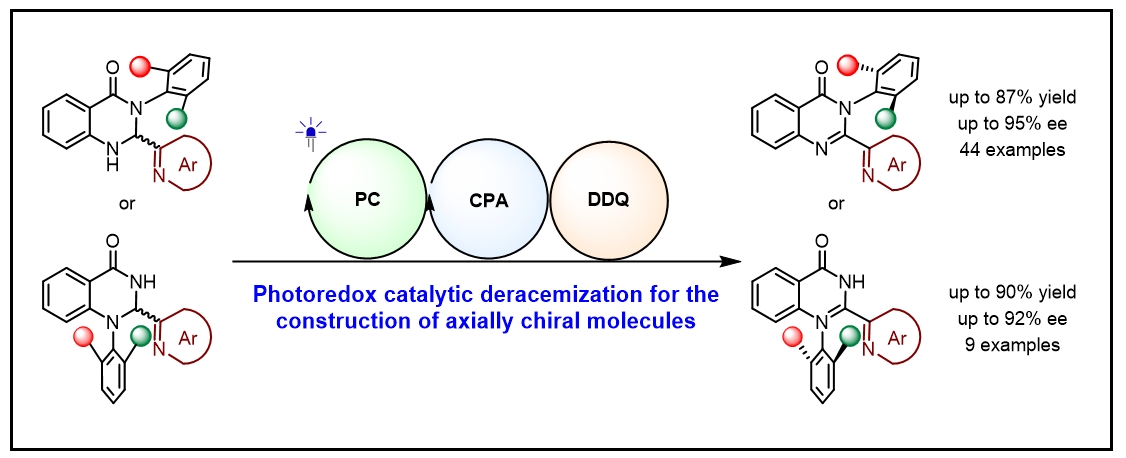
导读: 近日,河南师范大学江智勇教授课题组报道了通过光氧化还原催化去消旋化策略,高效合成有价值且难以获得的轴手性2-氮杂芳烃功能化喹唑啉酮。通过各种易制备的中心手性2,3-二氢喹唑啉-4(1H)-酮的去消旋化实现对映体富集,随后简便氧化,进而实现3-C-N轴和未报道过的1-C-N轴手性喹唑啉酮的构建,底物范围广泛。机理研究揭示了光敏剂的选择对于实现优异化学选择性的重要性,并强调了手性布朗斯特酸在实现高效对映选择性质子化以完成去消旋化方面的不可或缺性。文章链接DOI: 10.1002/anie.202411236。
(图片来源:Angew. Chem. Int. Ed)
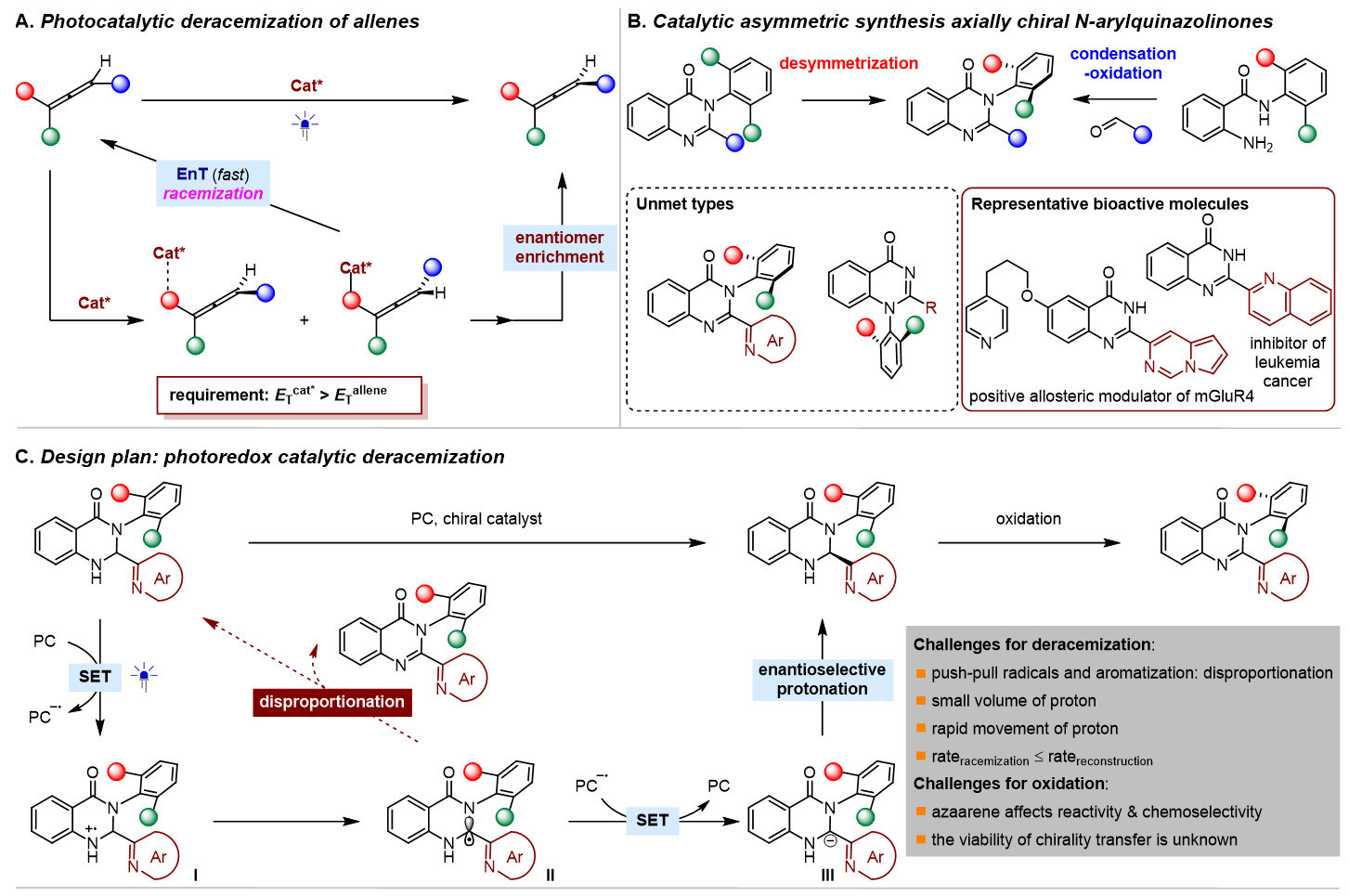
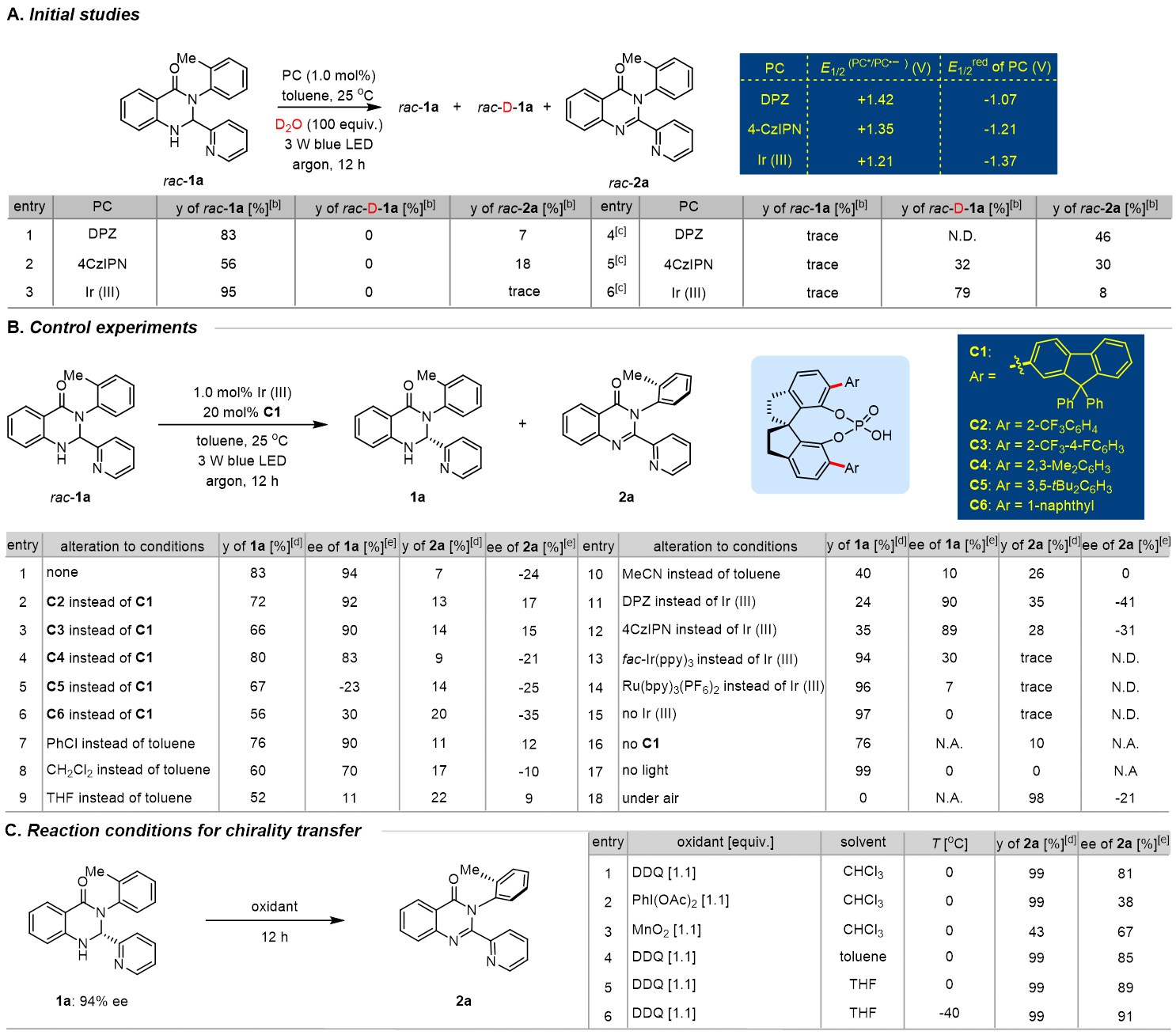
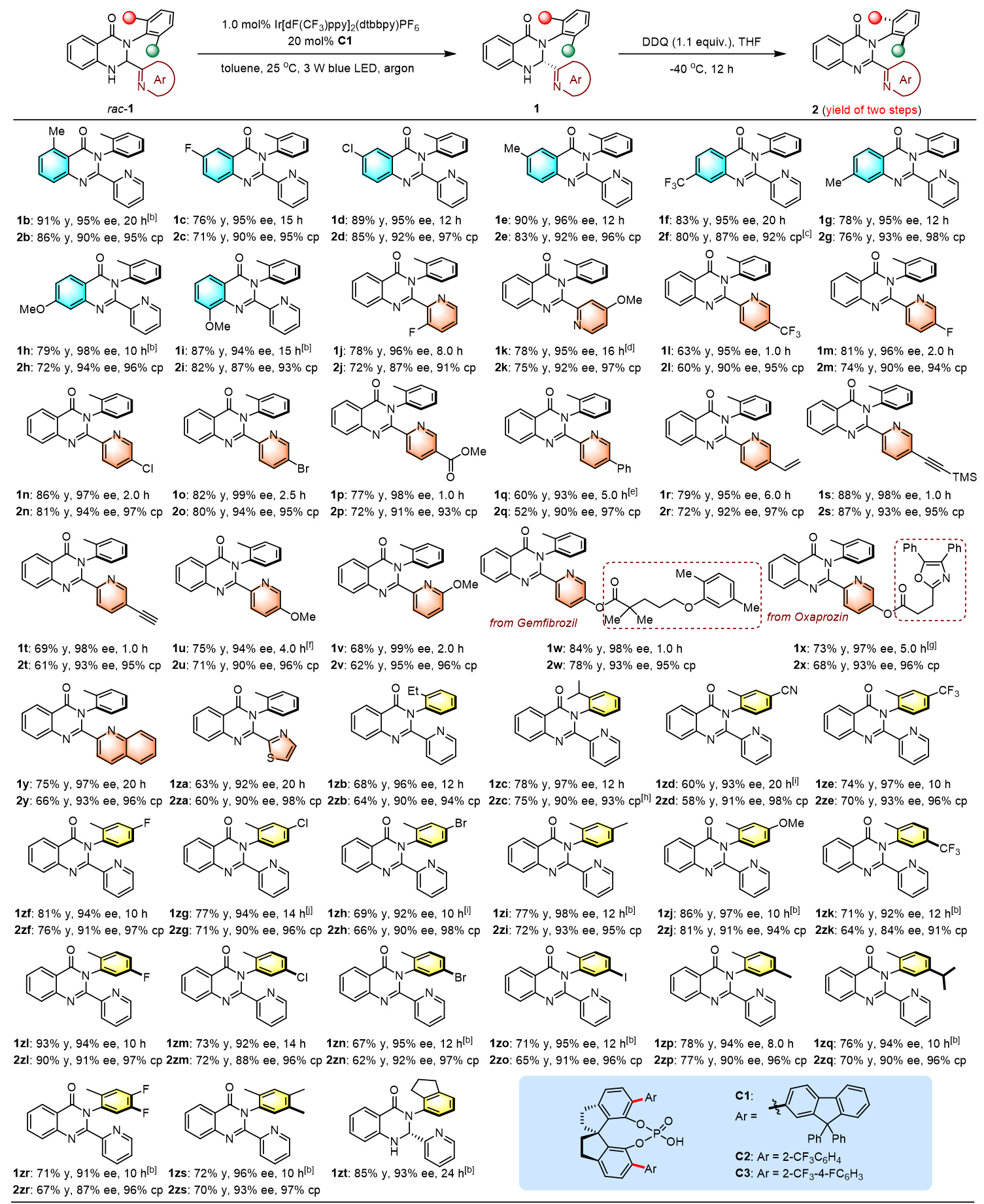
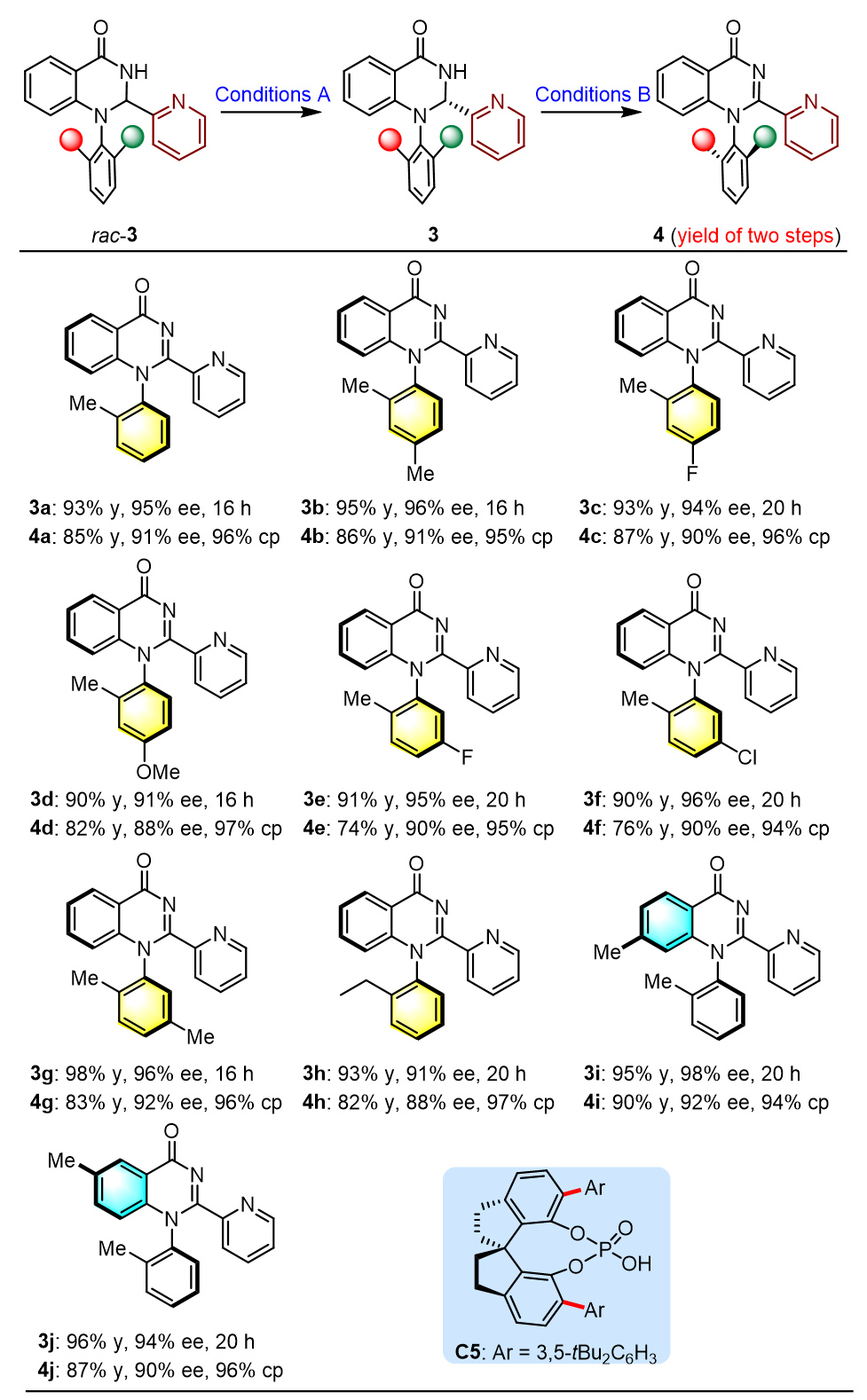
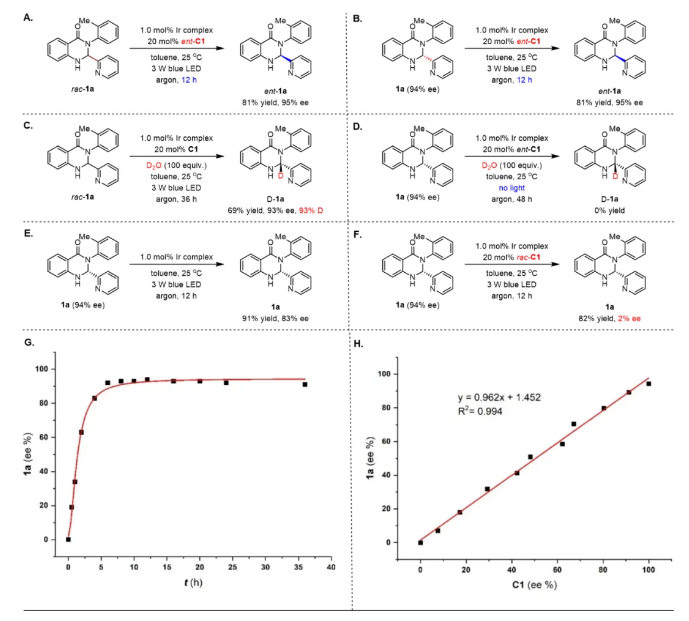
去消旋化,即外消旋分子直接转化为单一对映体,在可持续性、原子经济性和效率方面提供了理想的合成平台,已被成功地用于促进对映体富集联烯的构建(图1, A)。成功实现这些反应的关键因素在于通过三重态光催化剂和基态联烯之间的能量转移(EnT)生成三重态联烯。因此,所使用的光催化剂必须具有足够高的三重态能量,超过底物的能量,这是一个内在要求。这种基于EnT方法的轴手性底物相当受限,目前只有联烯和烯烃衍生物是光催化去消旋化的可行底物。图1. 研究背景和反应设计(图片来源:Angew. Chem. Int. Ed)在各类轴手性分子中,喹唑啉酮衍生物普遍存在于天然产物和生物活性化合物中,越来越受到化学家们的关注。迄今为止,已经开发了几种有效的方法来构建在3-位具有C-N轴的对映体富集喹唑啉酮,包括N-芳基的去对称化、邻氨基苯甲酰胺与醛的串联缩合和氧化,以及喹唑啉酮的烯丙基取代-异构化(图1, B)。值得注意的是,尽管氮杂芳烃(例如吡啶和喹啉)在药物方面有潜在应用,但目前尚无在喹唑啉酮环的2-位组装重要氮杂芳烃的报道。此外,目前也没有关于合成1-C-N轴的报道。因此开发一种高效的去消旋化策略,从而精确模块化的合成有价值的轴手性2-氮杂芳烃官能化的3-芳基和1-芳基喹唑啉酮是非常重要的。在光敏剂存在的情况下,2,3-二氢喹唑啉-4(1H)-酮(rac-1a)将通过单电子转移(SET)生成自由基阳离子I,随后生成氮杂芳烃取代的自由基II。它可以从光敏剂(PC−•)的自由基阴离子中间体获取一个单电子,以完成光氧化还原催化循环并产生关键的阴离子物种III。在手性催化剂促进的对映选择性质子化之后,形成对映体富集的中心手性产物,进一步氧化将得到所需的轴手性N-芳基喹唑啉酮(图1, C)。值得注意的是氮杂芳烃表现出的吸电子性质,连同两个氮原子的给电子性质,使得自由基II既可以发生单电子氧化也可以发生单电子还原,因此容易发生歧化反应。此过程同时再生1a并生成喹唑啉酮,其中热力学有利的芳构化进一步增强了这种竞争反应。另一方面,氮杂芳烃对中心手性向轴手性迁移过程的影响也不确定,因为氮杂芳烃和N-H键之间的分子内氢键相互作用可能潜在地影响这一过程。图2. 反应条件筛选(图片来源:Angew. Chem. Int. Ed)首先,作者选择2,3-二氢喹唑啉-4(1H)-酮(rac-1a)作为模板底物对反应进行一系列条件优化,筛选出最优的反应条件:在氩气条件下,rac-1a为底物,Ir[dF(CF3)ppy]2(dtbbpy)PF6(1.0 mol%)为光敏剂,C1(20 mol%)为手性催化剂,3 W蓝LED(波长:450-455 nm)照射,在溶剂toluene(4.0 mL)中25 °C反应12小时,以83%的产率生成去消旋化产物1a,ee值为94%(图2B,entry 1)。对照实验证实了光敏剂、手性催化剂、光源和无氧环境对于反应有效发生的必要性。随后研究了中心手性向轴手性的转移,通过条件筛选,当使用1.1当量的二氯二氰基苯醌(DDQ)作为氧化剂,在THF中将温度降至-40°C能够以99%的产率和91%的ee得到轴手性N-芳基喹唑啉酮2a。图3. 轴手性3-芳基喹唑啉酮底物拓展(图片来源:Angew. Chem. Int. Ed)在优化的条件下,作者研究了2-氮杂芳基-3-芳基取代的2,3-二氢喹唑啉-4(1H)-酮(rac-1)的去消旋化底物范围(图3)。得到的产物1b-zf,产率为60%至93%,对映体过量ee为91%至99%。观察到在两个芳香环和吡啶环上存在各种吸电子和给电子官能团,都能保持出色的对映选择性。这种方法显著的官能团耐受性突出表现在几个复杂的药物分子(即吉非罗齐(1w)和奥沙普秦(1x))在2-吡啶环上的成功兼容,以及各种重要的官能团,如酯基(例如1p)、烯烃(例如1r)、TMS(例如1s)和炔烃(例如1s和1t)。除了吡啶,其他重要的氮杂芳烃,如喹啉(例如1y)和噻唑(例如1za)可以在2,3-二氢喹唑啉-4(1H)-酮的立体中心上兼容,具有出色的收率和对映选择性。3-位上的芳基也表现出很大的多样性,包括空间位阻较小的2-甲基和较大的2-异丙基(例如1zc)。这些对映体富集分子的精确合成在制药和合成化学领域有着广阔的前景,所得到的中心手性化合物通过筛选的氧化条件可以方便的实现手性迁移。相应的产物2b-zs得以成功构建,ee值在84%至95%之间。ee值的略微降低凸显了这些2-氮杂芳基官能化分子中手性转移的复杂性。尽管如此,这些产物的两步产率都非常高,表明它们具有出色的转化效率。化合物1和2的绝对构型分别通过相应产物1o和2o的X射线晶体学分析确定。图4. 轴手性3-芳基喹唑啉酮底物拓展(图片来源:Angew. Chem. Int. Ed)受此成功的启发,作者尝试对2-(吡啶-2-基)-1-(邻甲苯基)-2,3-二氢喹唑啉-4(1H)-酮(rac-3a)进行去消旋化,以建立一种合成未报道过的轴手性1-芳基喹唑啉酮的有效途径。值得一提的是,与分子1相比,对映体富集的3a的直接催化不对称合成面临着更艰巨的挑战,原因在于其由容易获得的吡啶甲醛和2-(邻甲苯氨基)苯甲酰胺制备所需的温度较高。尽管发现rac-1的去消旋化条件不适用于rac-3a,但通过进一步的条件筛选,在-40 °C下使用催化剂C5,16小时后以93%的产率和95%的ee生成3a(图4)。随后在1-芳基底物的芳香环上组装各种取代基以评估底物范围,得到一系列产物3b-j,产率为90%至98%,ee为91%至98%。最后,使用1.5当量的AlCl3作为添加剂,1.5当量的DDQ作为氧化剂,-30°C下在THF中以91%的对映体过量生成4a。在这样的反应条件下,3b-j也能够获得令人满意的结果。化合物3和4的绝对构型通过3a-4ClBn和4a的X射线晶体学分析确定。图5. 控制实验(图片来源:Angew. Chem. Int. Ed)为了探究去消旋化策略的可能机理,作者进行了一系列控制实验。如图5所示,选择rac-1a作为代表,在标准条件下,使用20 mol%的ent-C1的情况下进行去消旋化。在12小时后以81%的产率获得了ent-1a,其ee值为95%。同时在这种条件下使用1a (94%ee),得到了相同结果的ent-1a。随后,反应体系中额外加入100当量的D₂O,以69%的产率和93%的ee值以及93%氘代率获得了D-1a。当没有光照射时,没有检测到氘代产物D-1a。这就确凿地证实了去消旋化是一种富集对映体的方法,而非依赖于动力学拆分。随后进行了Stern‒Volmer实验,从而证实了光活化的Ir(III)配合物与1a之间发生了单电子转移。比较它们的氧化电位(1a:在CH₃CN中Ep/2 = +1.07 V vs SCE)揭示了通过还原猝灭引发光氧化还原催化循环的可行性。同时研究了rac-1a去消旋化过程中ee值与反应时间的关系,值得注意的是,即使延长反应时间也未观察到ee的降低,这表明在这种协同催化平台中形成了稳定的非平衡态。还评估了C1的ee与1a的ee之间的关系,揭示了一种线性相关性,表明在C-H键的重构中仅涉及单个手性催化剂分子。基于所获得的这些结果,1和3去消旋化的机制预计与图1C中提出的方案一致。立体中心的消除应源于光氧化还原催化下Ir(III)配合物的还原猝灭。*Ir(III)对自由基II的有限氧化能力以及相应的Ir(II)配合物显著的还原能力,可能对有效抑制竞争的双重氧化和歧化起到重要作用,从而成为实现精确化学选择性的关键因素。在手性布朗斯特酸催化剂对于质子化不可或缺的情况下,它能够以对映选择性的方式促进形成立体中心。通过与Ir(III)配合物的明智选择相结合,该催化平台有效地抑制了背景反应,从而促进了高效的去消旋化。河南师范大学江智勇教授课题组报道了利用光氧化还原催化去消旋化成功合成一系列轴手性N-芳基喹唑啉酮化合物。这种策略首次实现了药学上重要的2-氮杂芳烃官能化的3-芳基和1-芳基喹唑啉酮的合成。这种去消旋化策略的成功依赖于精心选择一种有效的Ir(III)光敏剂,它能抑制竞争歧化和双重氧化,确保高化学选择性。此外,手性布朗斯特酸催化剂能够抑制背景反应,并且能够在这种具有挑战性的不对称转化中实现精准的手性控制。这一发现有望激发对各种光氧化还原去消旋化反应的进一步探索,促进合成更多理想的轴手性分子这一成果近期发表在Angewandte Chemie International Edition上,该论文的第一作者为河南师范大学化学化工学院2021级博士研究生刘乙霖,通讯作者为河南师范大学化学化工学院江智勇教授和尹艳丽教授。文献详情:
Photoredox Catalytic Deracemization Enabled Enantioselective and Modular Access to Axially Chiral N-Arylquinazolinones
Yilin Liu, Mengqi Chu, Xiangtao Li, Zheng Cao, Xiaowei Zhao, Yanli Yin, Zhiyong JiangAngew. Chem. Int. Ed. 2024https://onlinelibrary.wiley.com/doi/10.1002/anie.202411236
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn