

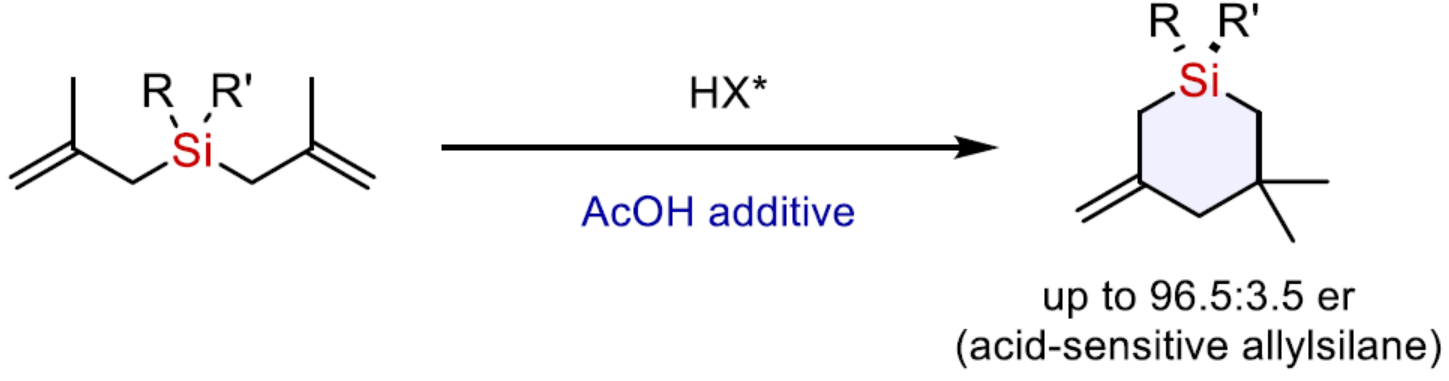
(图片来源:Nat. Commun.)
正文
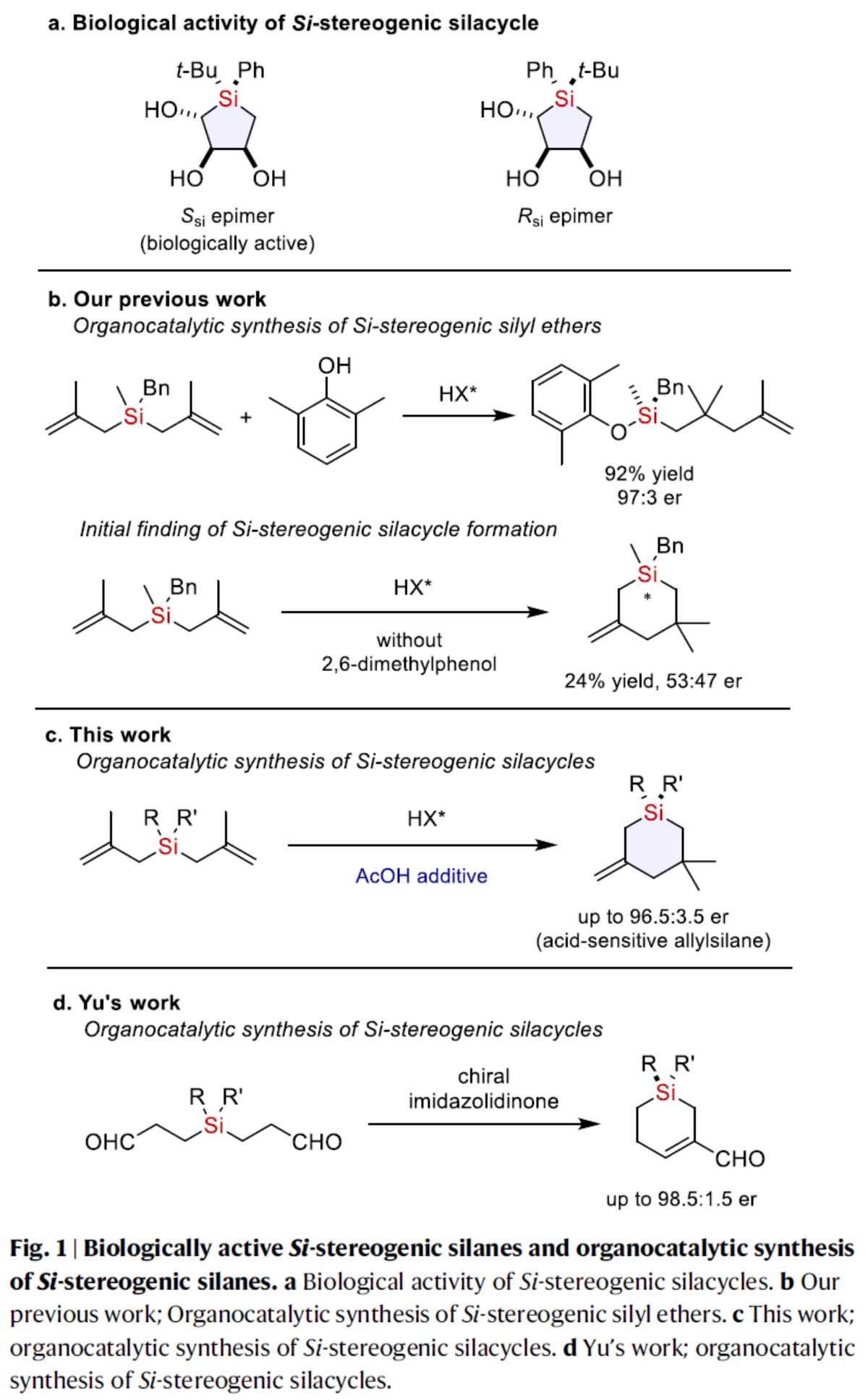
(图片来源:Nat. Commun.)
首先,作者以双(甲基烯丙基)硅烷1a作为模型底物,进行了相关反应条件的筛选(Table 1)。当以IDPi 6d(5 mol %)作为有机催化剂,乙酸(1.0 equiv)作为添加剂,在甲苯溶剂中-100 oC反应7 d,可以70%的收率得到产物2a,er为95:5。
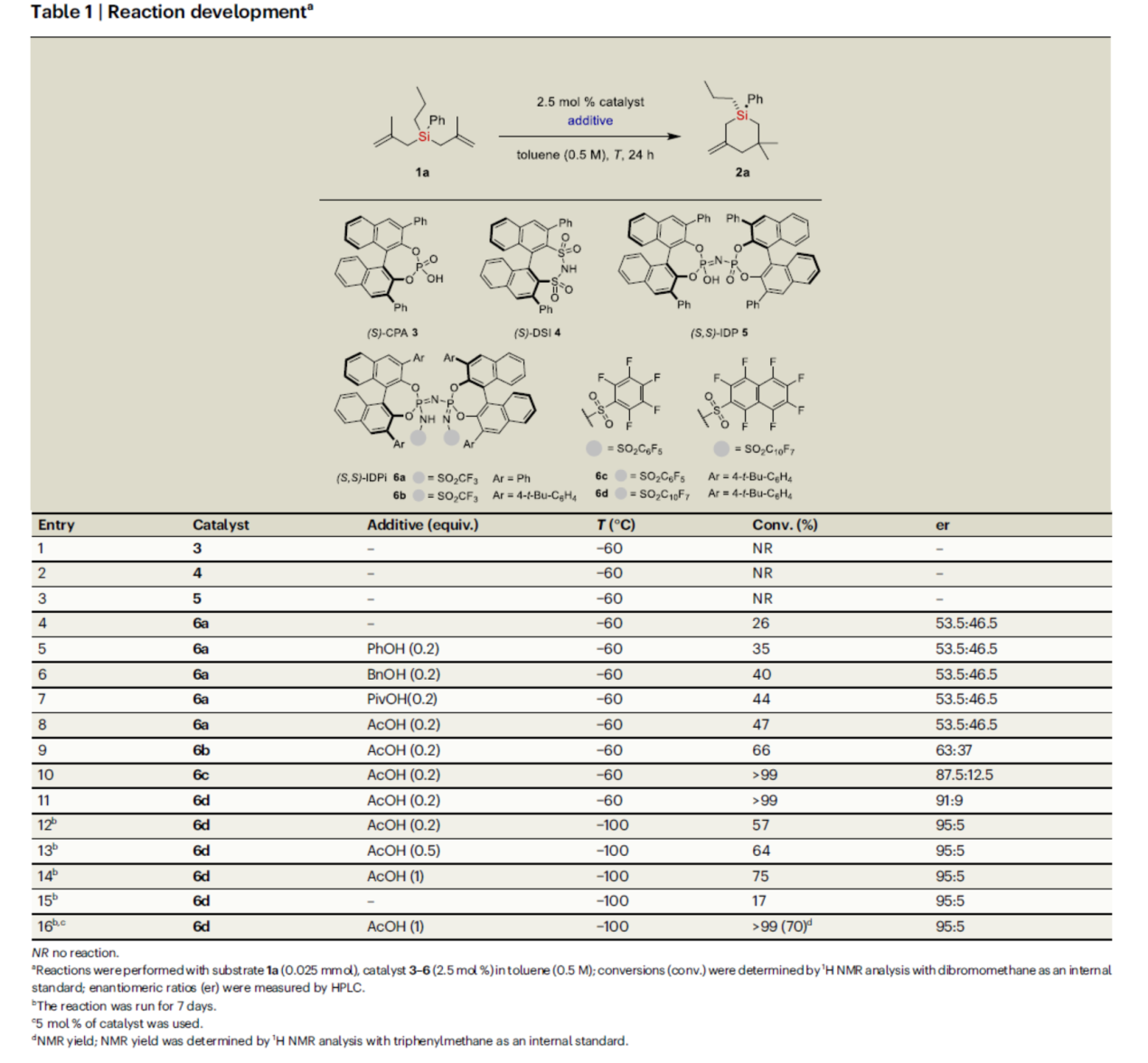
(图片来源:Nat. Commun.)
在获得上述最佳反应条件后,作者对底物范围进行了扩展(Fig. 2)。首先,含有各种烷基取代硅烷,均可顺利反应,获得相应的产物2a-2g,收率为60-70%,er为91:9-95:5。其中,随着烷基取代基的空间位阻增加,对映选择性略有降低。其次,2-萘基取代的硅烷,也是合适的底物,可以72%的收率与95:5 er得到产物2h。芳基的不同位含有甲基取代的硅烷底物,也能够顺利进行反应,但对映体选择性差异较大,获得相应的产物2i-2k,收率为68-74%,er为63:37-96:4。芳基上含有对甲氧基和氟取代的硅烷,也具有反应性,但观察到对映选择性略有降低,获得相应的产物2l(55%收率,91:9 er)和2m(60%收率,86.5:13.5 er)。值得注意的是,双(甲基烯丙基)烯丙基硅烷和三(甲基烯丙基)硅烷也是反应的可行底物,获得相应的产物2n(51%收率,96.5:3.5 er)和2o(52%收率,96.5:3.5 er)。环己基取代的硅烷,可以65%的收率与57.6:42.4 er得到产物2p。
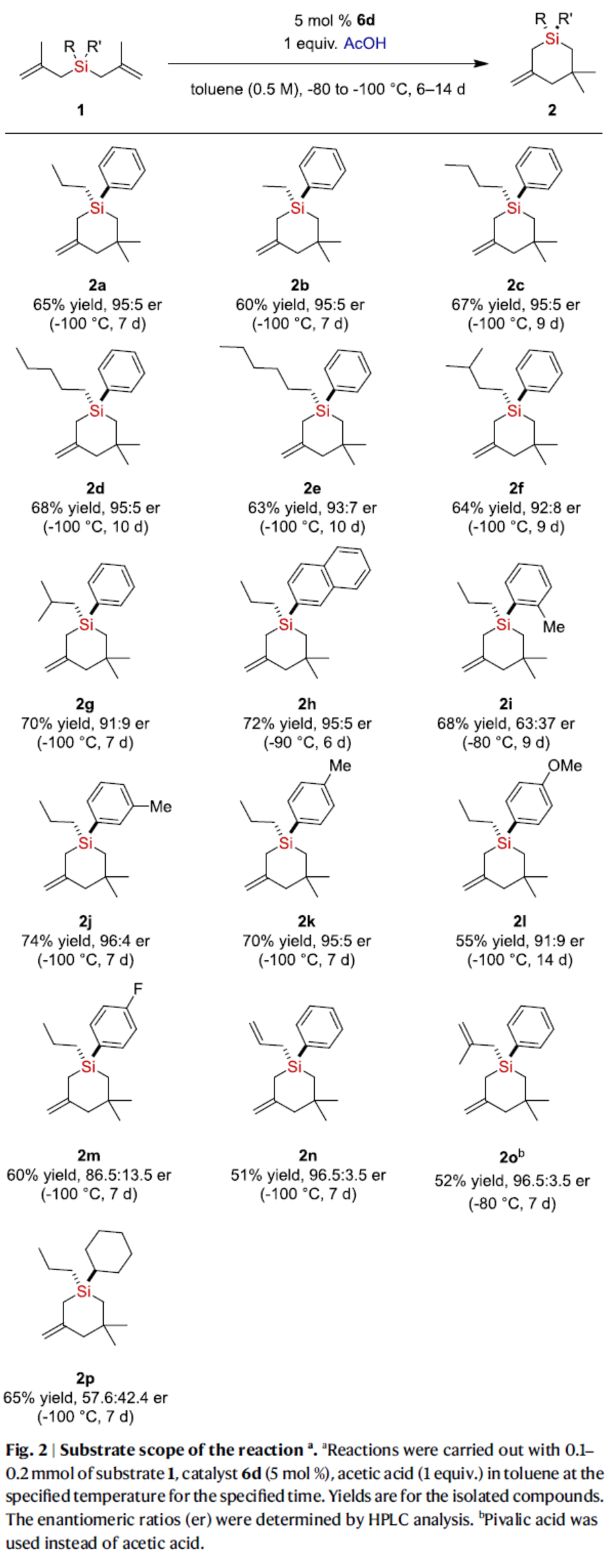
(图片来源:Nat. Commun.)
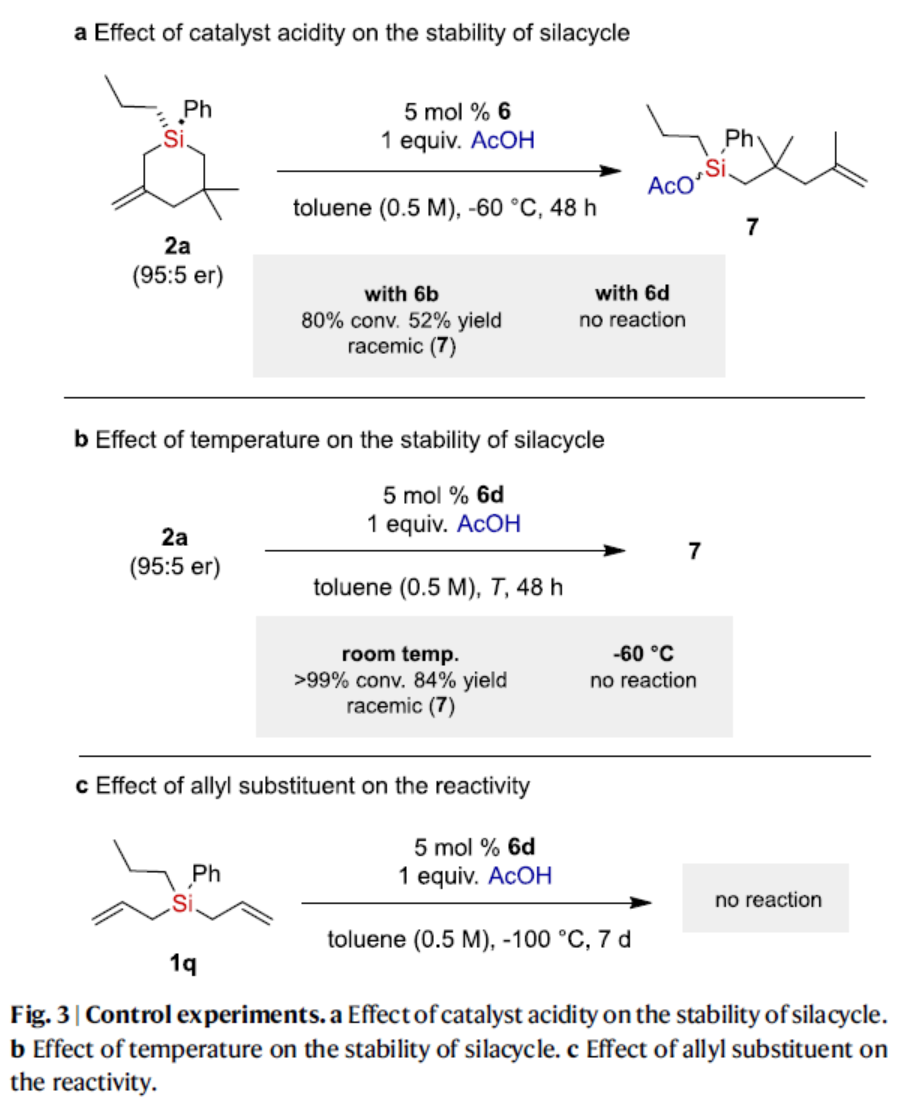
为了进一步了解反应的机理,作者进行了相关的控制实验(Fig. 3)。首先,催化剂酸度对硅杂环稳定性的研究结果表明,硅杂环在反应条件下的稳定性取决于IDPi催化剂的酸度(Fig. 3a)。其次,温度对硅杂环稳定性的研究结果表明,硅杂环稳定性依赖于温度(Fig. 3b)。此外,反应性较低的双(烯丙基)硅烷1q,未能有效的参与反应(Fig. 3c)。
(图片来源:Nat. Commun.)
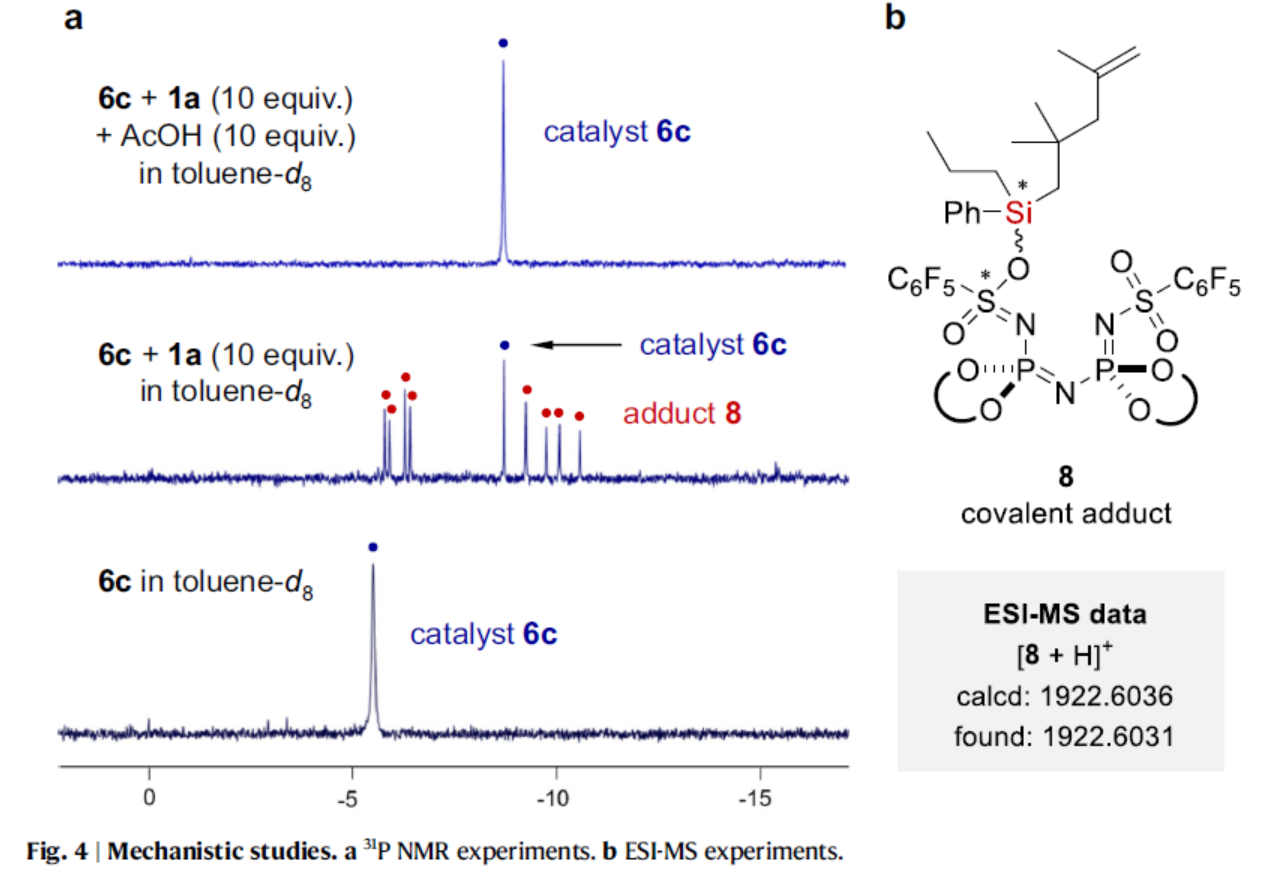
为了了解乙酸添加剂的作用,作者采用底物1a和催化剂6c进行了31P NMR研究(Fig. 4)。基于31P NMR与ESI-MS的结果发现,31P NMR中的新峰源于原位生成的共价加合物8。游离催化剂6c的磷信号明显向低场偏移。随后,向混合物中加入10当量乙酸,导致游离催化剂6c完全再生,并生成硅基乙酸酯7。虽然该反应降低了所需产物的总收率,但它使催化剂能够周转。
(图片来源:Nat. Commun.)
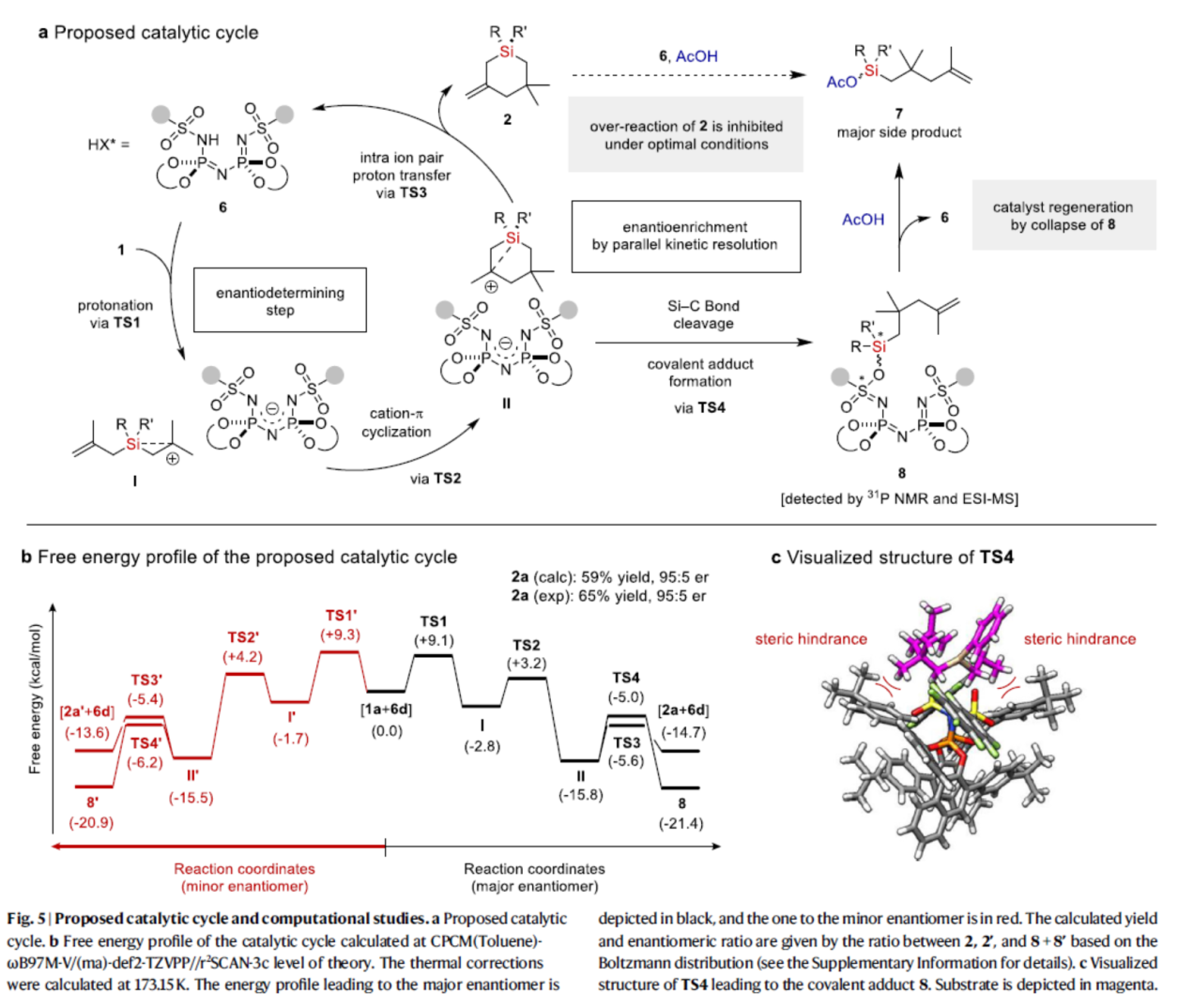
基于上述的研究以及相关文献的查阅,作者提出了一种合理的催化循环过程(Fig. 5a)。首先,烯烃的质子化(TS1),可生成由β-硅基稳定的碳阳离子和IDPi阴离子组成的离子对I。其次,离子对I经阳离子-π环化(TS2),生成离子对II。离子对II通过内离子对质子转移(TS3),生成含有硅手性中心的硅杂环2,并再生了游离催化剂6。同时,离子对II可以通过断裂,生成共价加合物8,这对催化剂的周转是有害的。然而,乙酸可将催化剂6从加合物8中释放出来,使催化剂能够周转。为了进一步了解详细的反应机理并研究观察到的对映选择性的来源,作者对底物1a和催化剂6d进行了计算研究(Fig. 5b)。计算结果表明,通过TS3进行去质子化和通过TS4形成共价加合物是观察到的高对映选择性的关键。同时,由于TS4中的空间位阻,导致于TS4与TS4'的稳定性存在差异(Fig. 5c)。
(图片来源:Nat. Commun.)
总结
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn