

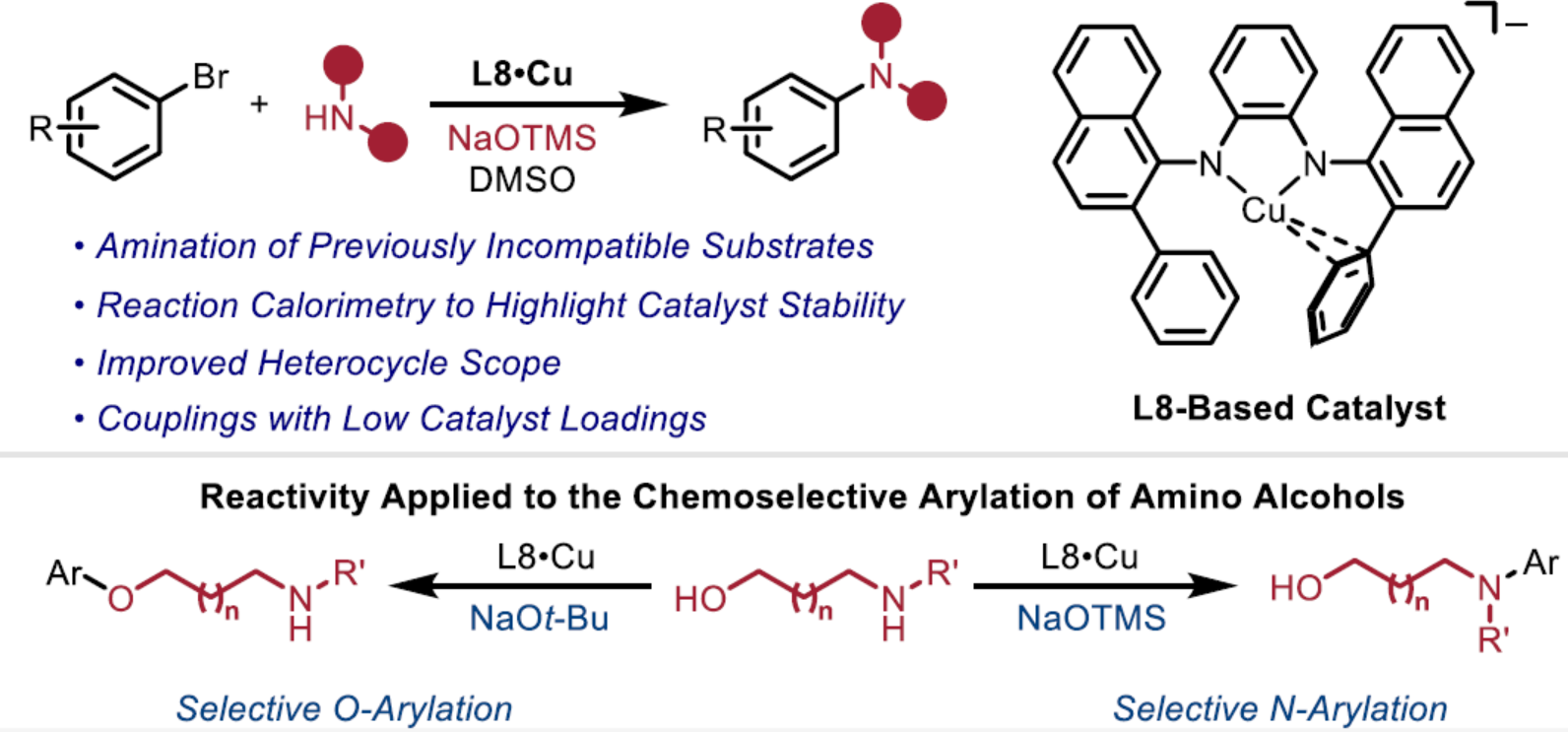
(图片来源:J. Am. Chem. Soc.)
正文
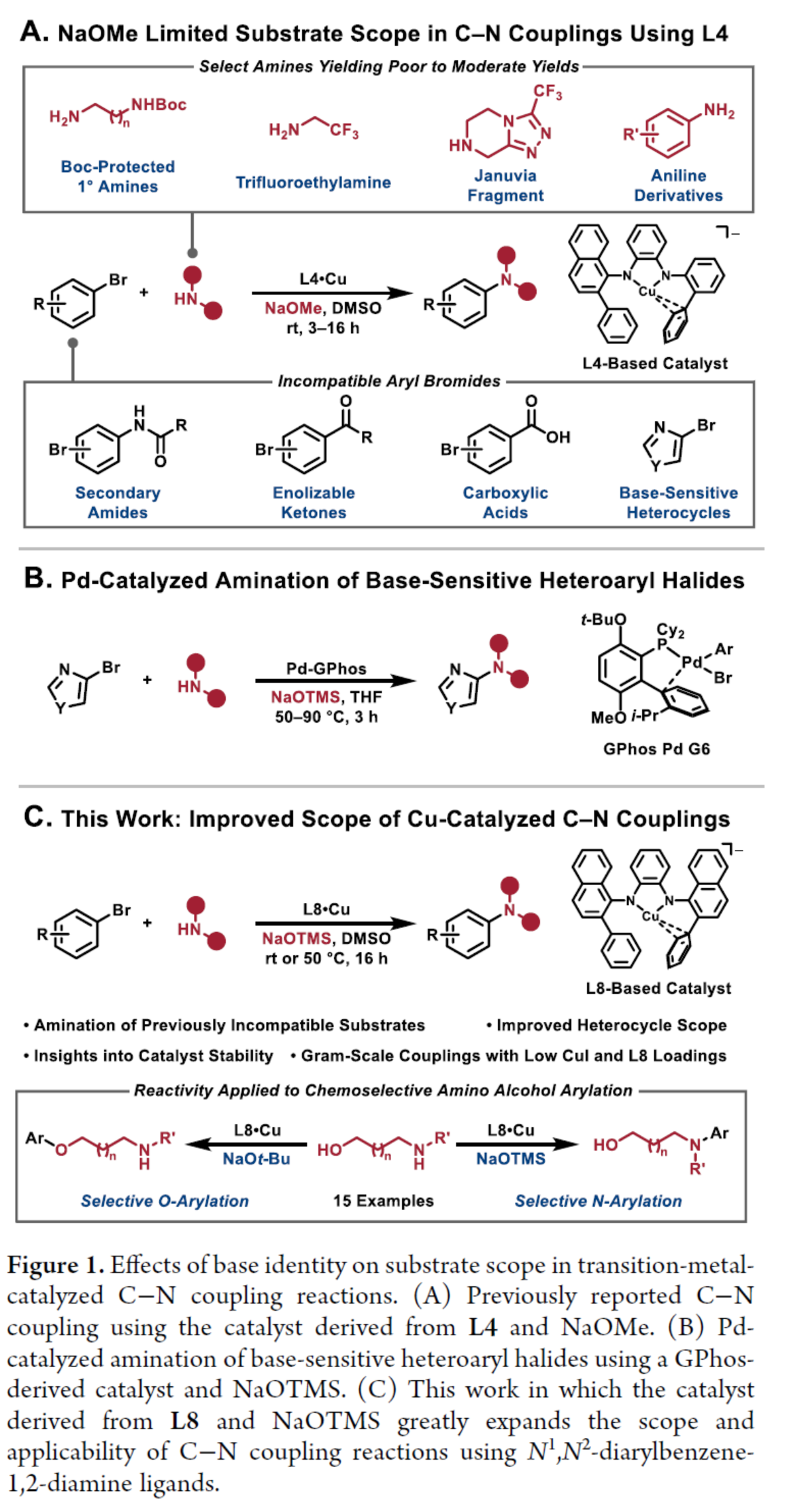
(图片来源:J. Am. Chem. Soc.)
首先,作者以4-溴苯甲醚1a与吗啉2a作为模型底物,进行了相关偶联反应条件的筛选(Figure 2A)。当以CuI(5 mol %)作为催化剂,L8(10 mol %)作为配体,NaOTMS(1.25 equiv)作为碱,在DMSO溶剂中24 oC反应16 h,可以99%的收率得到N-芳基胺产物3a。同时,在1a与2a的标准反应体系中加入不同的五元杂芳烃添加剂的实验结果表明,衍生自L8的催化剂阻止了由配位诱导配体置换引起的失活,并且五元杂芳基溴化物可能在50 oC进行反应(Figure 2B)。
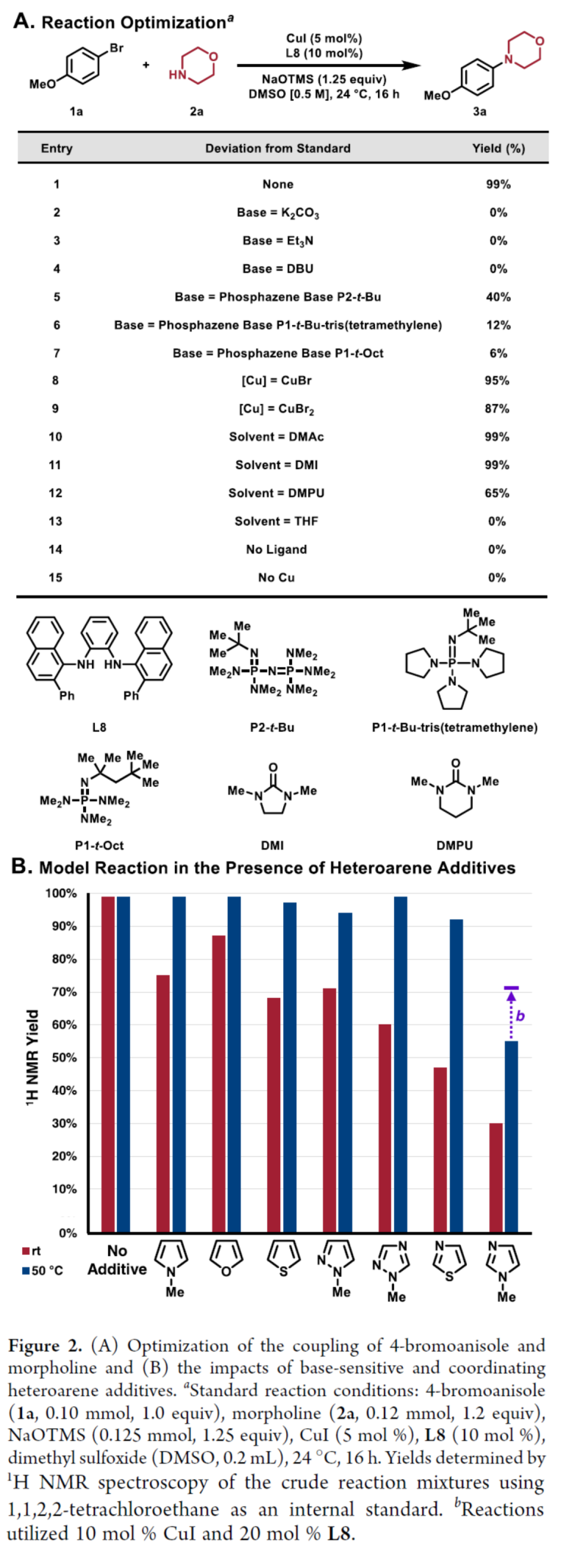
(图片来源:J. Am. Chem. Soc.)
在获得上述最佳反应条件后,作者对底物范围进行了扩展(Scheme 1)。首先,含有酰胺(1a和1e)、可烯醇化酮(1b和1d)、叔丁基酯(1g)和羧酸(1h)取代的芳烃,均可与一级或二级胺偶联,可以良好至优异的产率得到相应的产物。碱敏感胺,也以良好至优异的产率得到相应的N-芳基胺1c和1f。三种α-三级胺,也是合适的底物,可以中等至良好的产率得到相应的产物1i、1j和1t。其次,一系列五元杂芳基卤化物和苯稠合杂芳烃,均可顺利进行反应,可以良好至优异的产率得到相应的产物1k-1t。此外,该策略还可用于一些药物和天然产物的后期衍生化,可以良好至优异的产率得到相应的产物1u-1x。虽然R3Si-基保护基在反应条件下是不稳定的,但THP-保护的苯酚可以良好的产率进行胺化(1y)。除了N-杂环烷基化(1z)外,SEM基团的N-保护也具有良好的产率(1aa)。N-Boc和N-甲苯磺酰基在反应条件下是不稳定的,导致脱保护和催化剂抑制。由于分解,含醛的芳基溴化物与胺化方案不相容。然而,使用溴化二乙缩醛进行C−N偶联,然后用2M HCl原位脱保护,可以两步优异的产率得到含醛的N-芳基胺产物1ab。
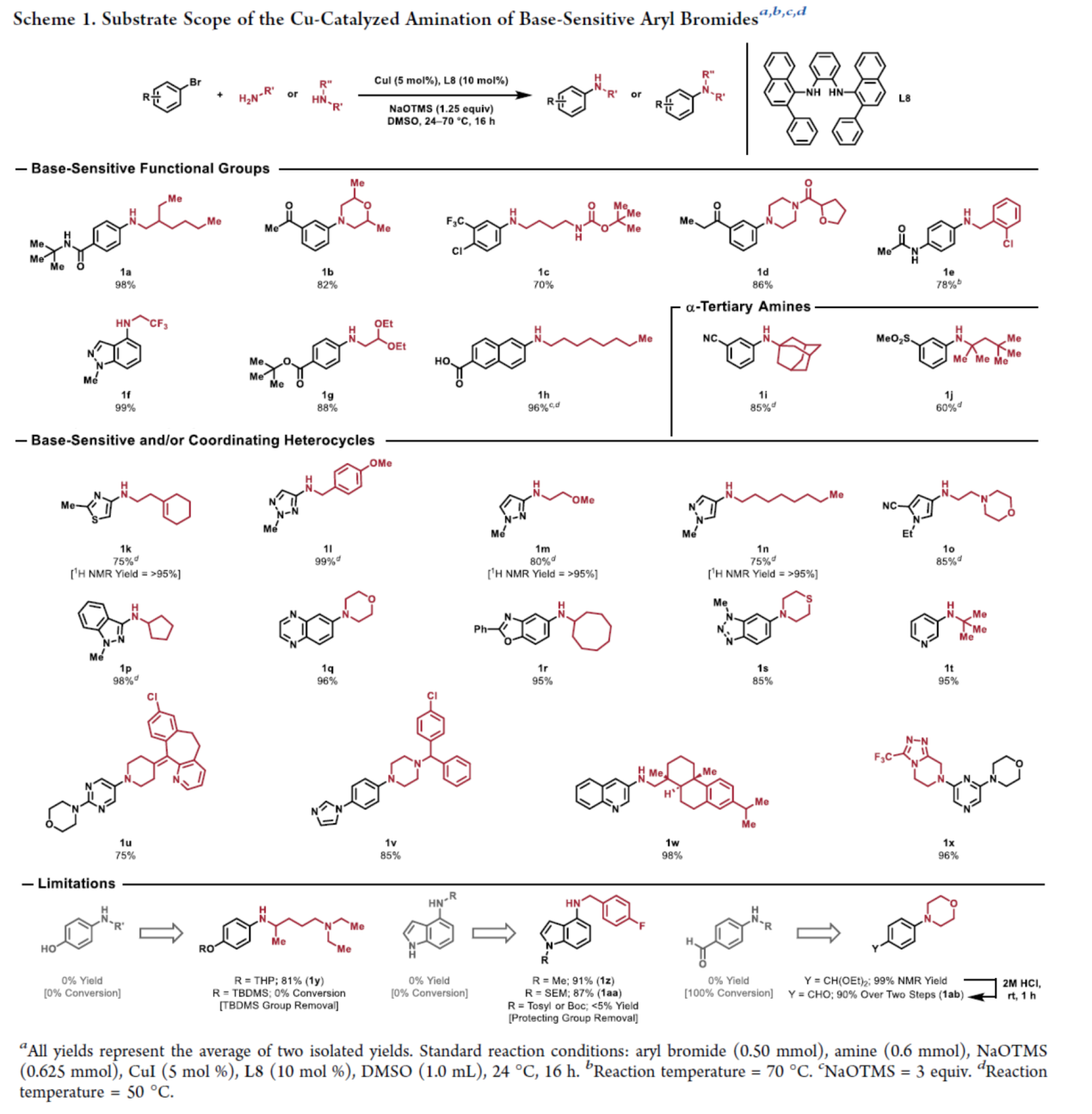
(图片来源:J. Am. Chem. Soc.)
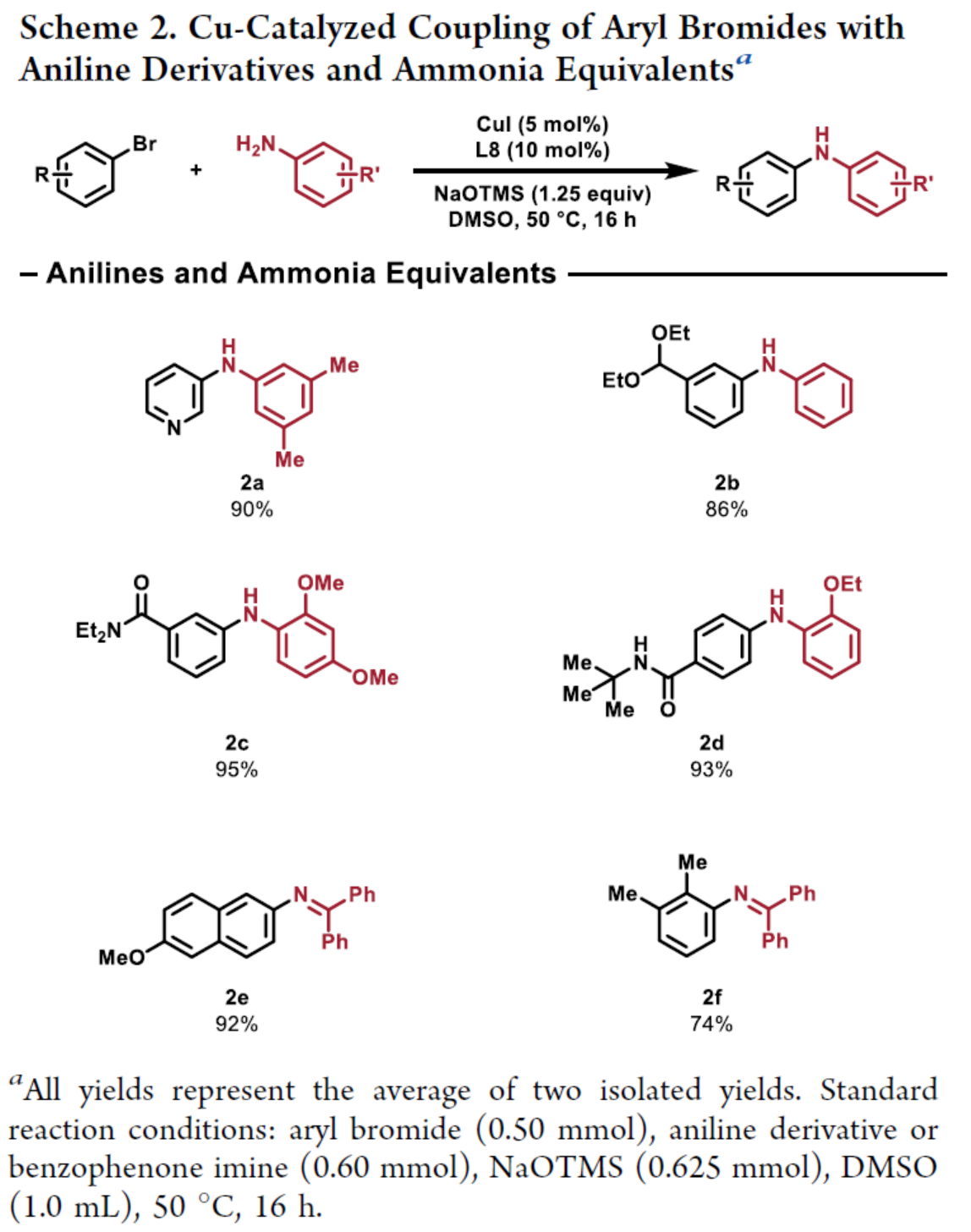
其次,作者进一步对亲核试剂的底物范围进行了扩展(Scheme 2)。研究结果表明,一系列苯胺衍生物与二苯甲酮亚胺,均可顺利进行反应,获得相应的产物2a-2f,收率为74-93%。
(图片来源:J. Am. Chem. Soc.)
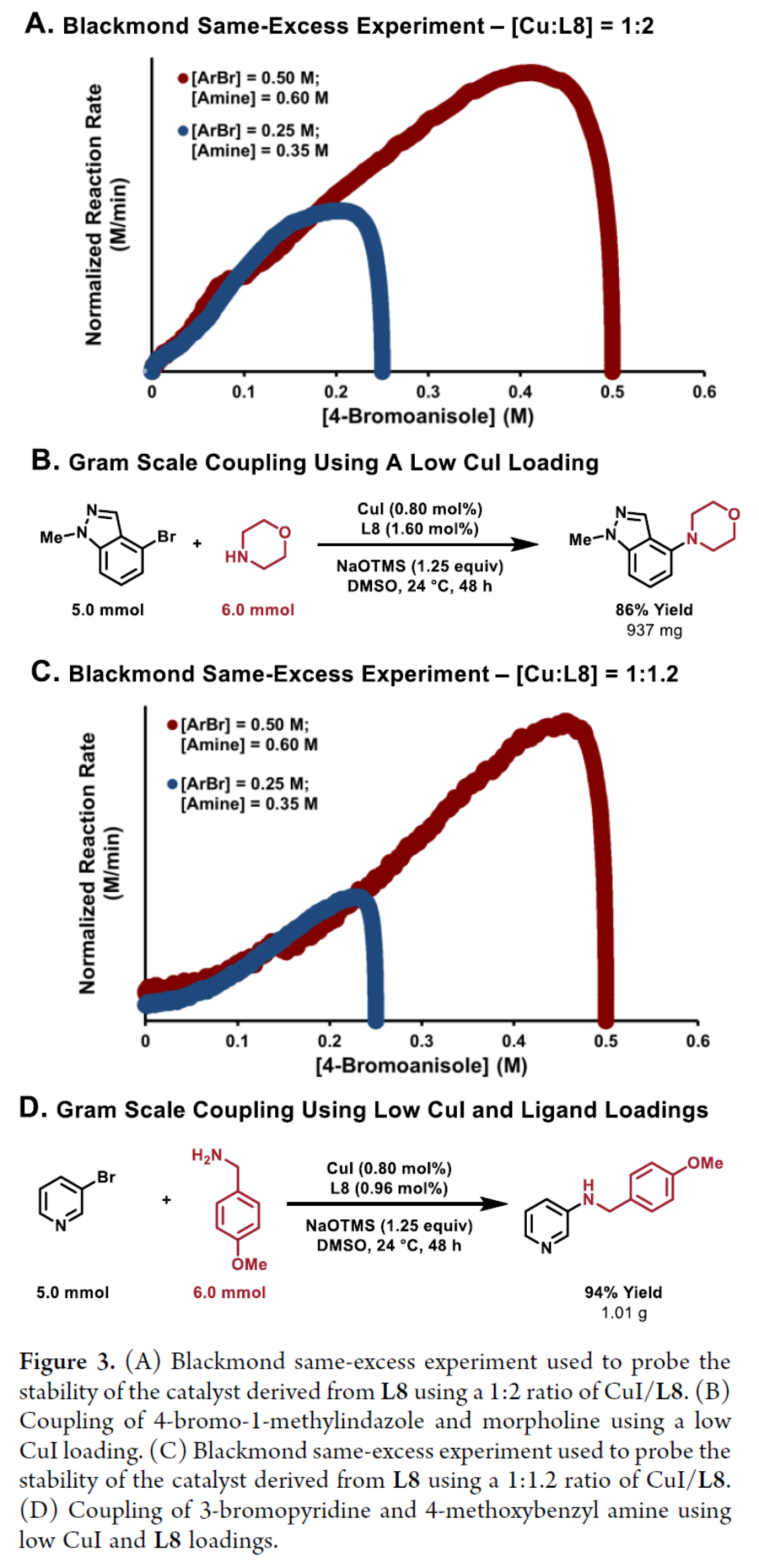
紧接着,作者对衍生自L8的催化剂的稳定性以及反应的实用性进行了研究(Figure 3)。研究结果表明,衍生自L8的铜催化剂在整个反应过程中是非常稳定的,并且可以使用较低的催化剂负载量。
(图片来源:J. Am. Chem. Soc.)
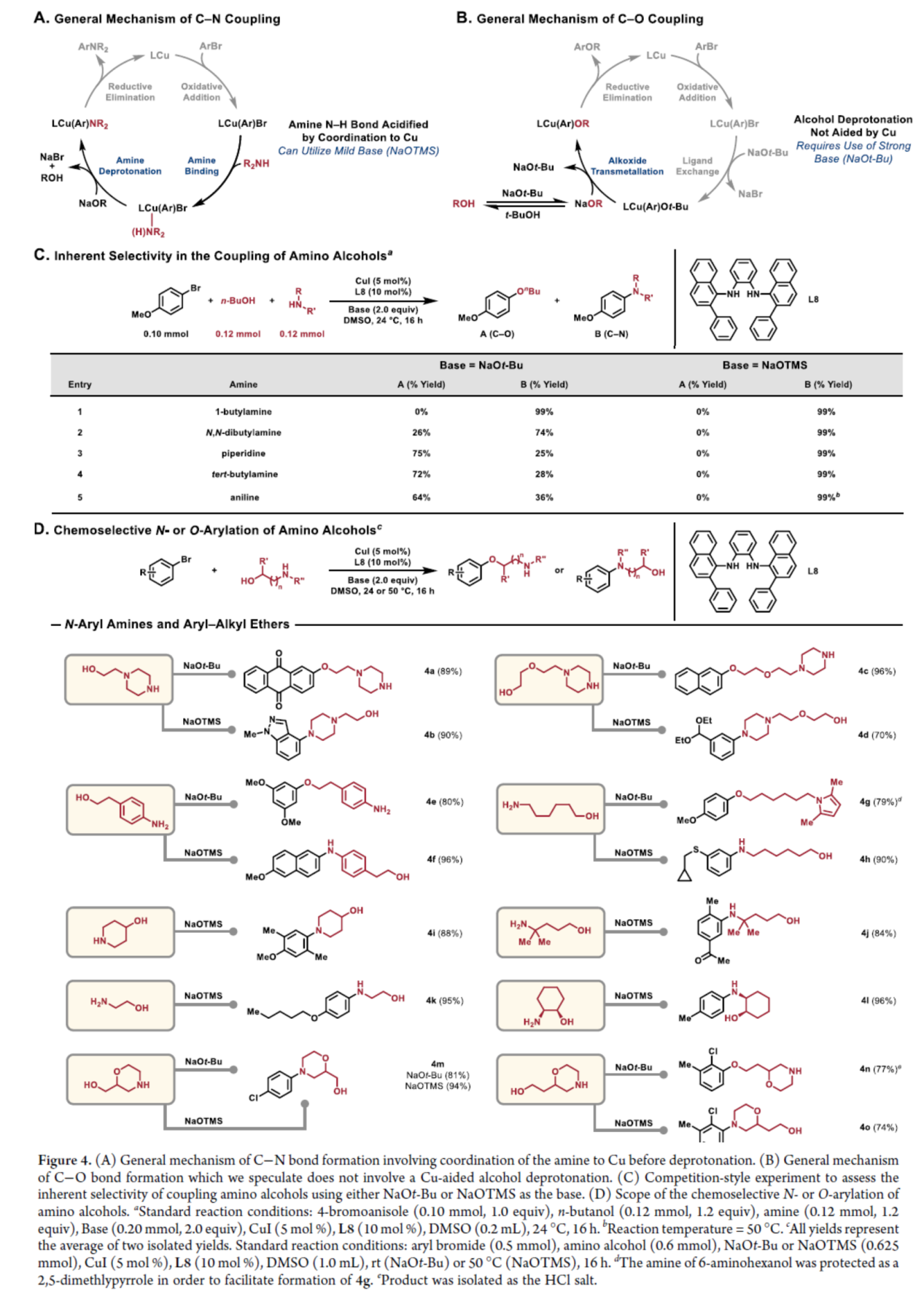
最后,作者提出了合理C-N和C-O偶联的催化循环过程(Figure 4A与Figure 4B)。其中,C−N键形成的一般机理涉及去质子化前胺和铜的配位(Figure 4A),而C−O键形成的一般机理不涉及铜辅助的醇去质子化(Figure 4B)。基于上述的机理,作者发现,当使用不同的碱时,可进行化学选择性N-和O-芳基化反应(Figure 4C)。研究结果表明,当氨基醇具有一级醇和位阻大的胺或苯胺基团时,使用NaOt-Bu作为碱时,仅进行C−O偶联反应,获得相应的产物4a、4c、4e、4g、4m和4n,收率为77-96%。当使用NaOTMS作为碱时,无论氨基醇的结构如何,仅能进行C−N偶联反应,获得相应的产物4b、4d、4f、4h-4m和4o,收率为70-96%。(Figure 4D)。
(图片来源:J. Am. Chem. Soc.)
总结
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn