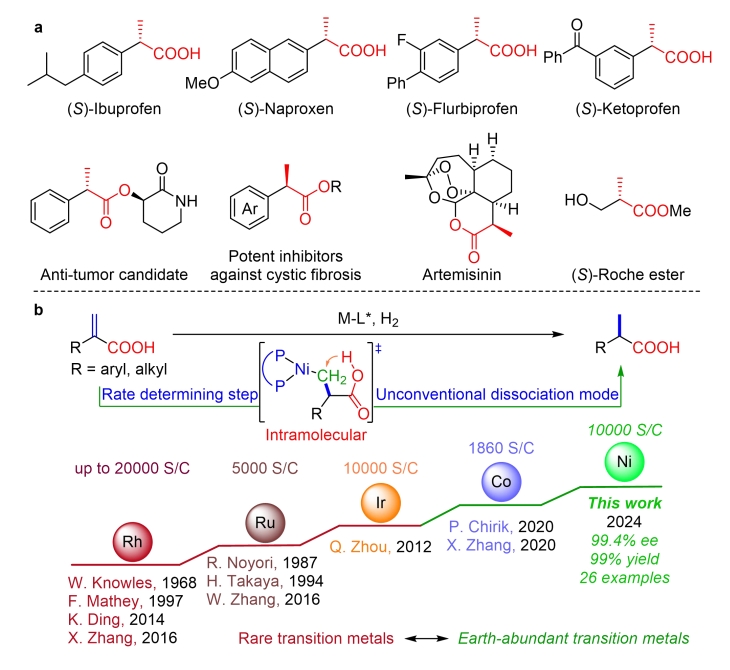
手性α-取代丙酸是一类非常重要的化合物,其结构广泛存在于生物活性化合物和有机中间体中(图1a)。手性α-芳基取代丙酸类衍生物,如(S)-布洛芬、(S)-萘普生、(S)-氟比洛芬和(S)-酮洛芬等,在人体内具有抑制前列腺素合成的作用,是一类非常重要的抗炎和镇痛药物。此外,世界著名的抗疟疾药物青蒿素和广泛使用的手性中间体(S)-罗氏酯则属于手性α-烷基取代丙酸衍生物。鉴于这些化合物的重要性,它们的不对称合成一直是化学家们研究的一个重要课题。相比于其他不对称合成方法,过渡金属催化的不对称氢化具有高效性且易于工业化生产的优点,被广泛应用于这类化合物的合成研究中。然而目前该领域主要集中于使用稀有金属催化剂,对于丰产金属催化剂涉及较少,效果有待提高。近年来,丰产金属催化剂(如锰、铁、钴、镍、铜)在不对称催化氢化研究中取得了重大的进展,他们具有价格低廉,毒性很低等优点,符合绿色化学的要求。然而,由于二取代烯烃的空间位阻较低,使得反应中立体选择性难以控制,目前大多数研究主要集中在三取代烯烃和四取代烯烃的不对称氢化上。
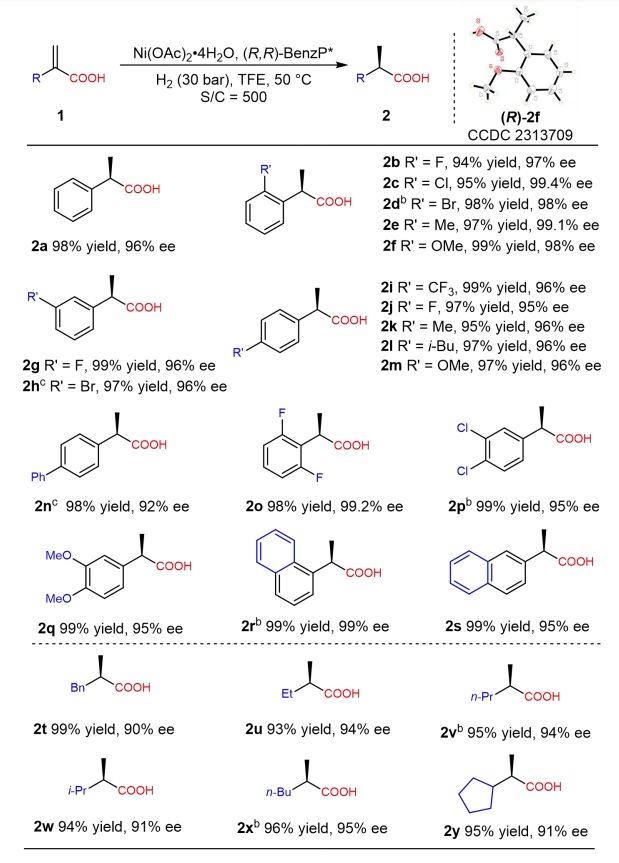
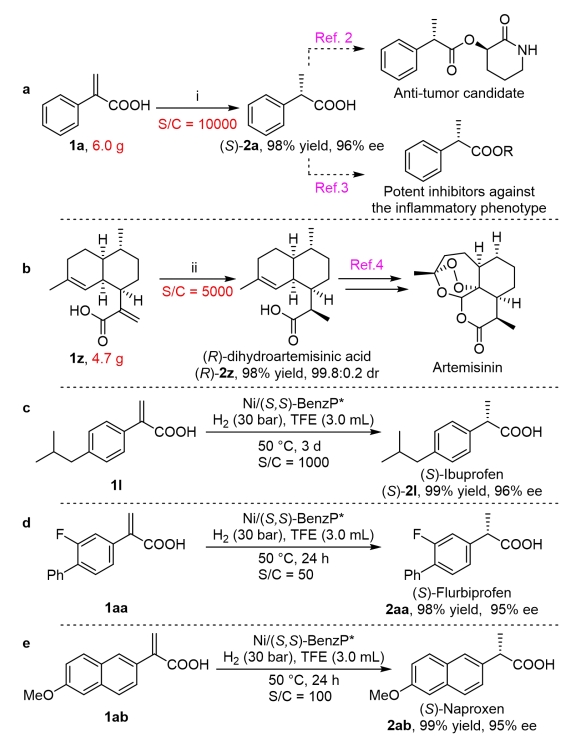
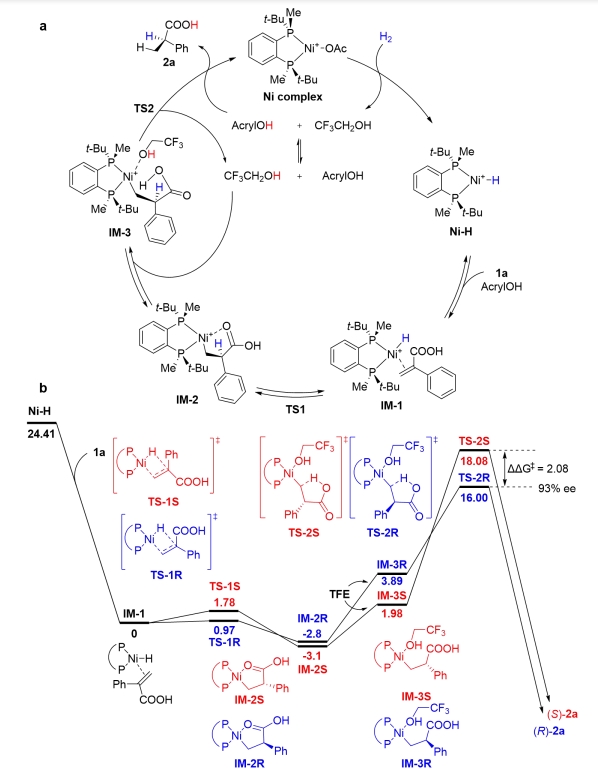
图1 重要手性α-取代丙酸衍生物以及其不对称氢化合成策略上海交通大学张万斌教授团队近年来一直致力于过渡金属催化的不对称氢化研究,并发现了一些反应中存在着催化剂与底物之间CH•••HC弱吸引相互作用,也称为多重色散相互作用(MADI),这种相互作用协同参与了反应过程,显著地提高了反应的活性和对映选择性(Pd: Angew. Chem. Int. Ed.2013, 52, 11632; Angew. Chem. Int. Ed.2016, 55, 8444; Nature Commun.2018, 9, 5000; iScience2020, 23, 100960; Rh: Angew. Chem. Int. Ed.2019, 58, 11505)。在此基础上,他们进一步开发了一系列丰产金属(镍、钴、铜)参与的不对称催化氢化反应(Angew. Chem. Int. Ed.2019, 58, 7329; Angew. Chem. Int. Ed.2019, 58, 15767; Angew. Chem. Int. Ed.2020, 59, 5371; Nat. Commun.2020, 11, 5935; Angew. Chem. Int. Ed.2021, 60, 16989; Nat. Chem.2022, 14, 920; Angew. Chem. Int. Ed.2023, 62, e202214990; Angew. Chem. Int. Ed.2023, 62, e202217871; Angew. Chem. Int. Ed.2023, 62, e202303488; 等)。近日,他们将其应用于二取代烯烃的不对称氢化研究中,报道了一种高效的镍催化α-取代丙烯酸的不对称氢化反应,以高达99.4%的对映选择性得到相应的手性α-取代丙酸衍生物,反应转化数可达10000(图1b)。 作者在获得最优反应条件后,对反应底物适用性进行了探索。大部分底物都能在转化数为500条件下以优秀的收率(93-99%)和对映选择性(90-99.4%)得到相应产物。该反应体系能很好的适用于邻位,间位,对位取代的单取代,多取代,以及联苯基,萘环,链烷基,环烷基类的底物(图2)。 进一步地,他们对反应进行克级规模放大,发现标准底物可以在转化数为10000的条件下获得目标产物(图3a)。同时,在青蒿素的重要前体(R)-双氢青蒿素的获取中,该反应也可以达到5000的转化数,以及99.8:0.2的非对映体过量(图3b)。另外,该方法也可以直接应用于一系列非甾体抗炎药如(S)-布洛芬,(S)-氟比洛芬,(S)-萘普生的绿色合成中。 为了阐明反应的发生过程,他们借助了DFT计算,结果表明,中间体3(IM-3)经由过渡态2(TS-2)的过程中,分子内羧基质子转移步骤是反应的动力学决速步骤和立体选择性决定步骤(图4)。另外,反应级数实验表明,该反应对于底物和镍盐的级数是一级,对于氢气的级数则是零级,经过动力学方程推导,与理论计算一致。此外,通过外加酸,碱,以及使用相应的羧酸酯底物的控制实验表明反应中的质子对于反应的活性起着至关重要的作用,这也与DFT计算的结果保持一致。 随后,他们借助IGMH分析可视化的TS-2R和TS-2S构象中底物和催化剂之间的弱相互作用,发现C-H···H-C和C-H···O相互作用在两种过渡态中都存在,但TS-2R中的相互作用明显强于TS-2S,这表示底物和催化剂的弱相互作用可能会有助于稳定反应的过渡态和提升反应的立体选择性。 张万斌教授课题组开发了一种高效的丰产金属镍催化不对称氢化α-烷基或芳基取代的丙烯酸的方法。以优异的结果得到了相应的手性α-取代丙酸 (产率高达99%,对映选择性高达99.4%,转化数高达10000 S/C)。特别是在青蒿素的关键中间体 (R)-二氢青蒿酸合成中,其转化数达到5000,且非对映体过量达到了99.8:0.2。机理研究表明,底物的羧酸基团的分子内质子转移促使C-Ni键的解离是速率决定步骤。
B. Li,+ Z. Wang,+ Y. Luo, H. Wei, J. Chen,* D. Liu, W. Zhang,* Nickel-catalyzed asymmetric hydrogenation for the preparation of α-substituted propionic acids. Nat. Commun.15, 5482 (2024). https://doi.org/10.1038/s41467-024-49801-0