

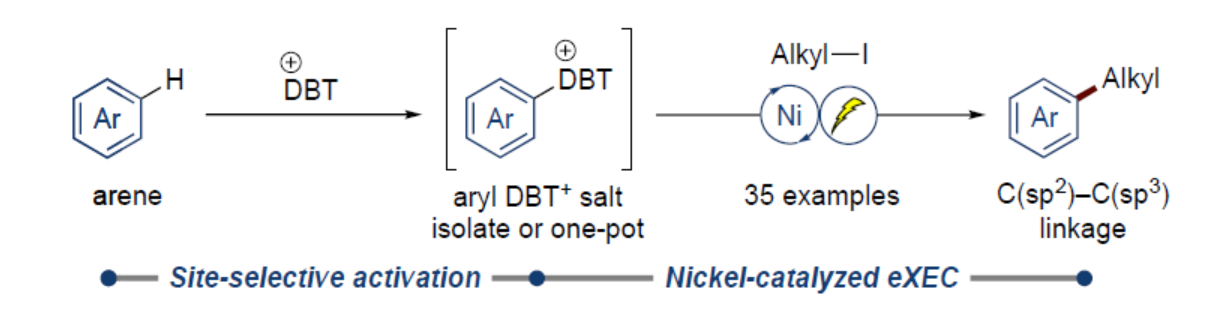
正文
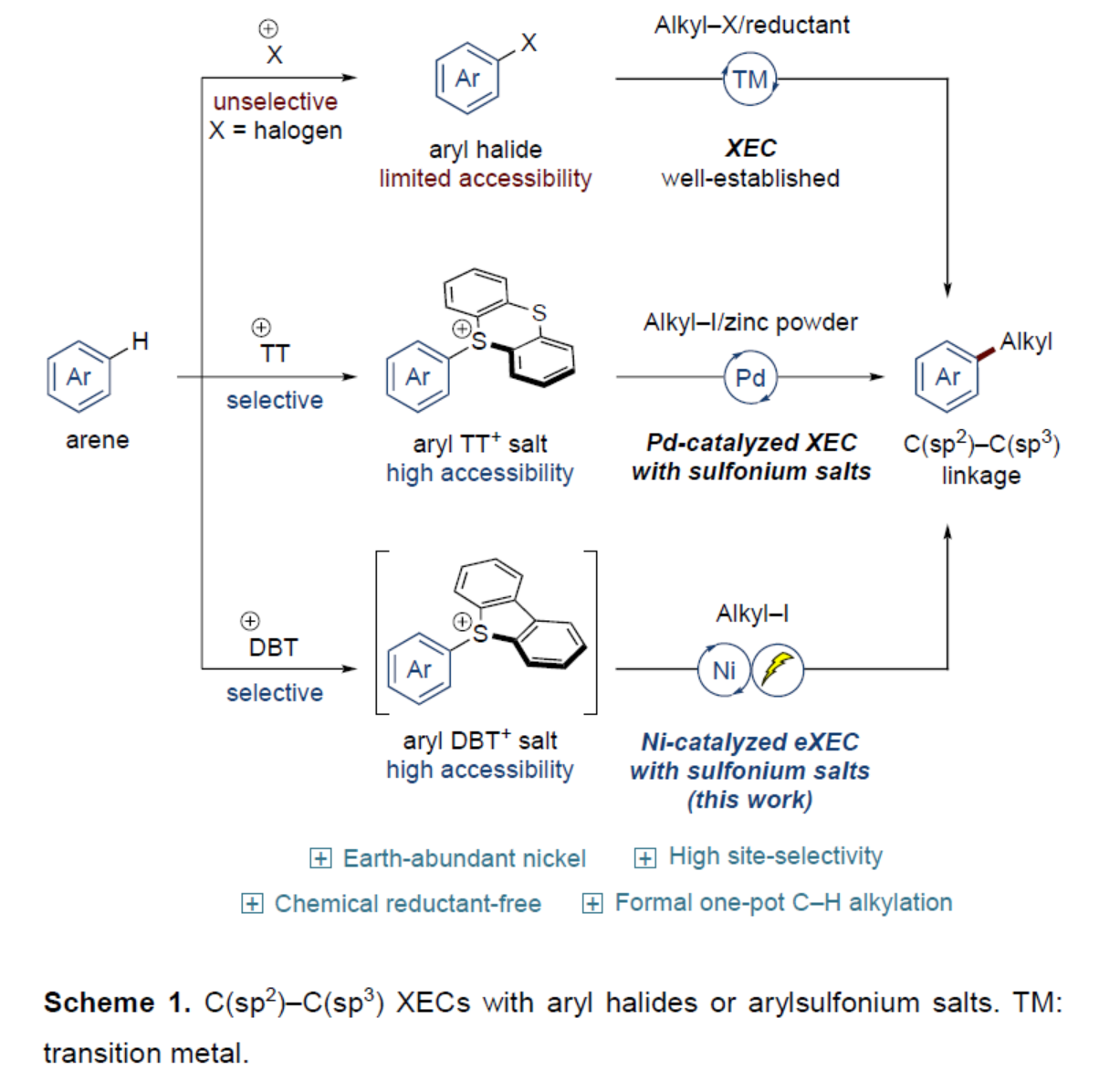
(图片来源:Angew. Chem. Int. Ed.)
首先,作者以芳基二苯并硫蒽鎓盐1与1-碘辛烷2作为模型底物,进行了相关反应条件的筛选(Table 1)。当以NiBr2(dtbbpy)(10 mol %)作为催化剂,Zn/Ni作为电极,nBu4NI作为电解质,3Å MS作为添加剂,电流为5 mA,在DMA溶剂中60 oC反应6 h,可以77%的分离收率得到产物3。
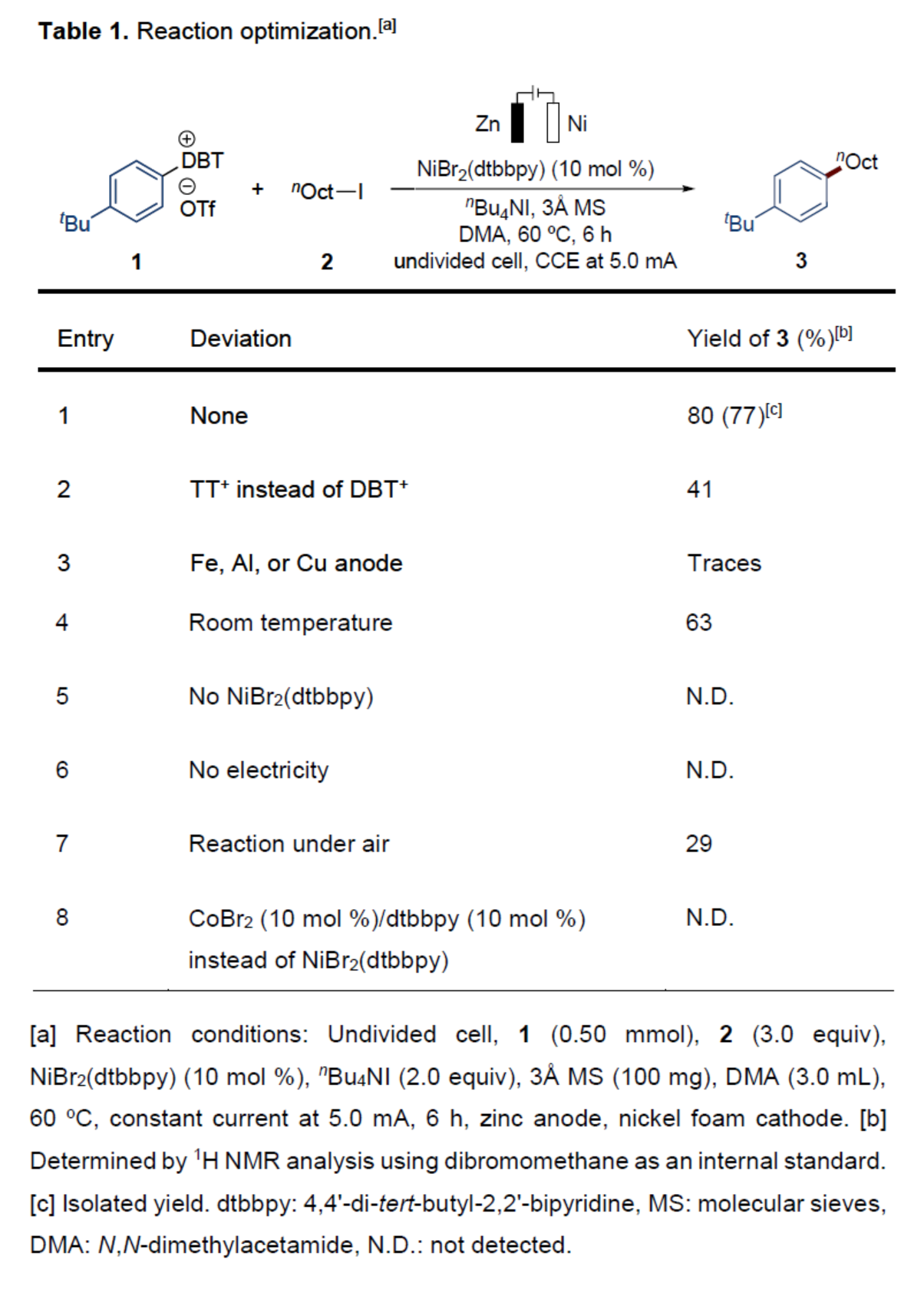
(图片来源:Angew. Chem. Int. Ed.)
在获得上述最佳反应条件后,作者分别对DBT+盐与烷基碘的底物范围进行了扩展(Figure 1)。首先,对位修饰的DBT+盐(3-8)、苯衍生的DBT+盐(9)、间-/对-位二取代DBT+盐(10-13)、邻-/间-位二取代DBT+盐(14和15)与间-/对-位三取代DBT+盐(16),均可顺利反应,获得相应的产物,收率为53-83%。同时,噻吩和喹啉衍生的DBT+盐,也是合适的底物,获得相应的产物17(收率为64%)和18(收率为43%)。有趣的是,当使用苯丙氨酸衍生物,仅在对位进行烷基化,可以40%的收率得到邻和对位异构体的混合产物19。值得注意的是,该策略还可用于一系列药物分子的后期衍生化,如氟比洛芬、美西律和布洛芬,获得相应的产物20-22,收率为45-68%。其次,具有一级脂肪链的简单碘化物,也与体系兼容,获得相应的产物23-27,收率为60-78%。类似地,含有氮或氧烷基碘化物,也是合适的底物,获得相应的产物28-30,收率为53-62%。此外,无环和环状二级烷基碘化物,也能够顺利进行反应,获得相应的产物31-37,收率为60-68%。
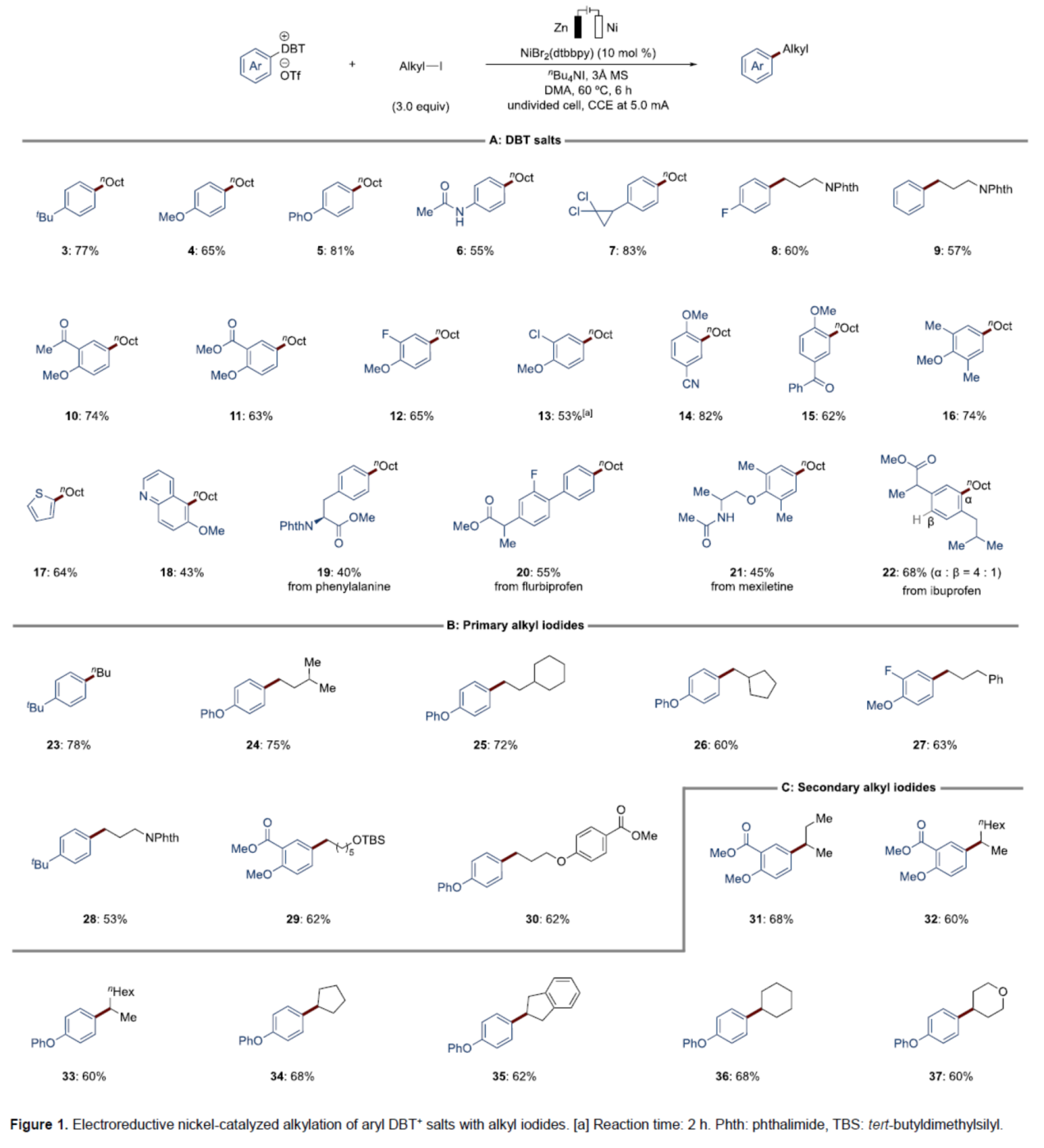
(图片来源:Angew. Chem. Int. Ed.)
紧接着,作者对反应的实用性进行了研究(Scheme 2)。首先,克级规模实验,同样能够以62%收率得到产物7(Scheme 2A)。其次,以非预官能团化的芳烃为底物,通过一锅烷基化反应,可获得相应的产物3、7、11、12和31,收率为40-56%(Scheme 2B)。值得注意的是,该策略作为首个利用非预官能团化的芳烃通过形成锍鎓盐进行一锅烷基化反应的例子。
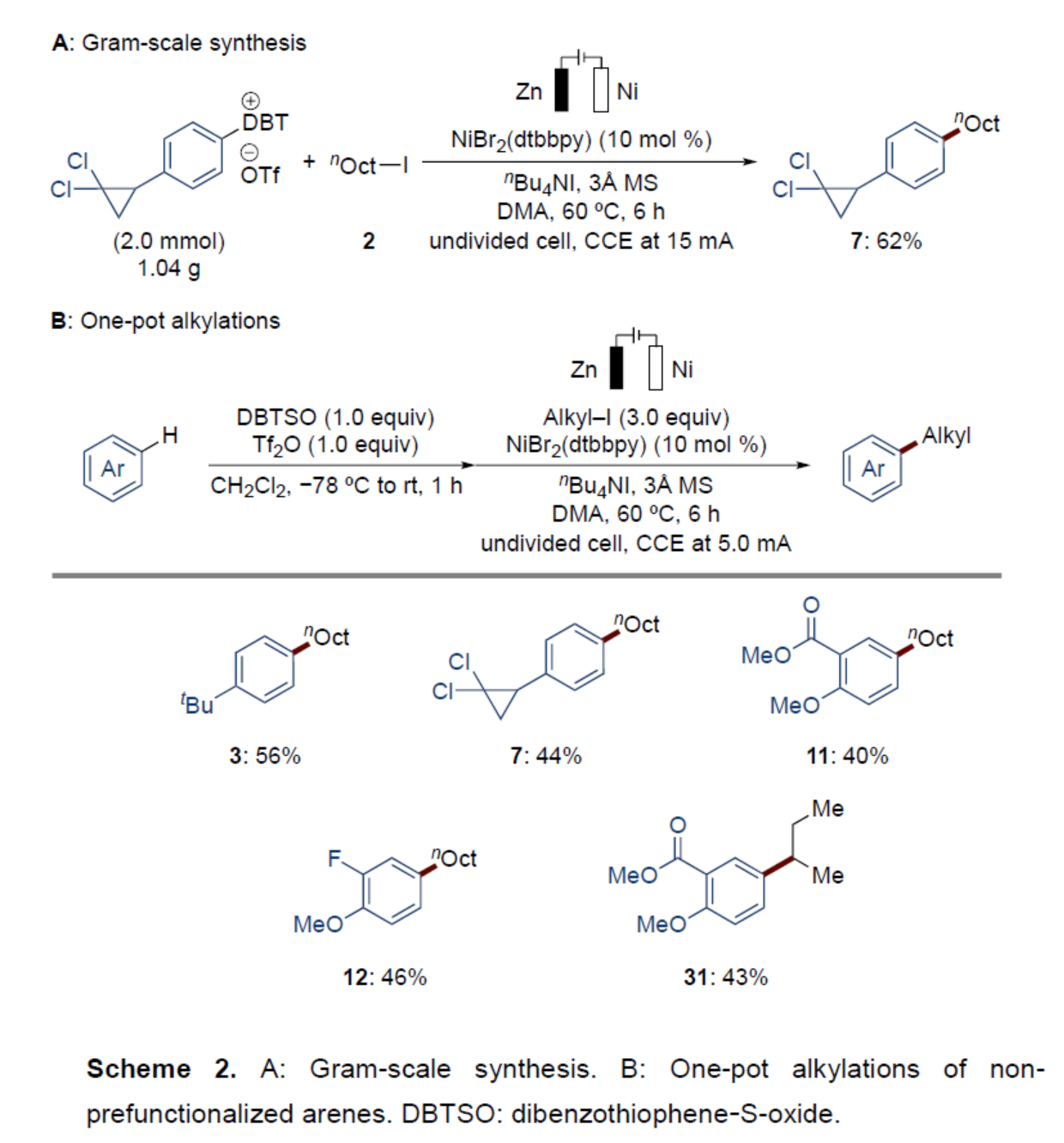
(图片来源:Angew. Chem. Int. Ed.)
此外,作者还对反应机理进行了进一步的研究(Figure 2)。首先,自由基钟实验与手性烷基碘的外消旋实验结果表明,反应涉及烷基自由基的生成(Figure 2A)。其次,利用D2O捕获芳基锌配合物的反应未生成任何氘化产物,排除了芳基锌的累积(Figure 2B)。CV实验结果表明,电子更容易向芳基DBT+盐转移(Figure 2C)。基于上述的研究以及相关文献的查阅,作者提出了一种合理的催化循环过程(Figure 2D)。首先,镍(I)配合物A与芳基DBT+盐经氧化加成生成镍(III)中间体B。其次,中间体B在阴极上还原,生成芳基-镍(I)配合物C。随后,配合物C与烷基碘经单电子转移(SET)与自由基重组,生成镍(III)配合物D。最后,配合物D经还原消除,可获得目标偶联产物,并再生镍催化剂A,以完成催化循环的过程。此外,目前不能排除芳基DBT+盐直接阴极还原的机理。
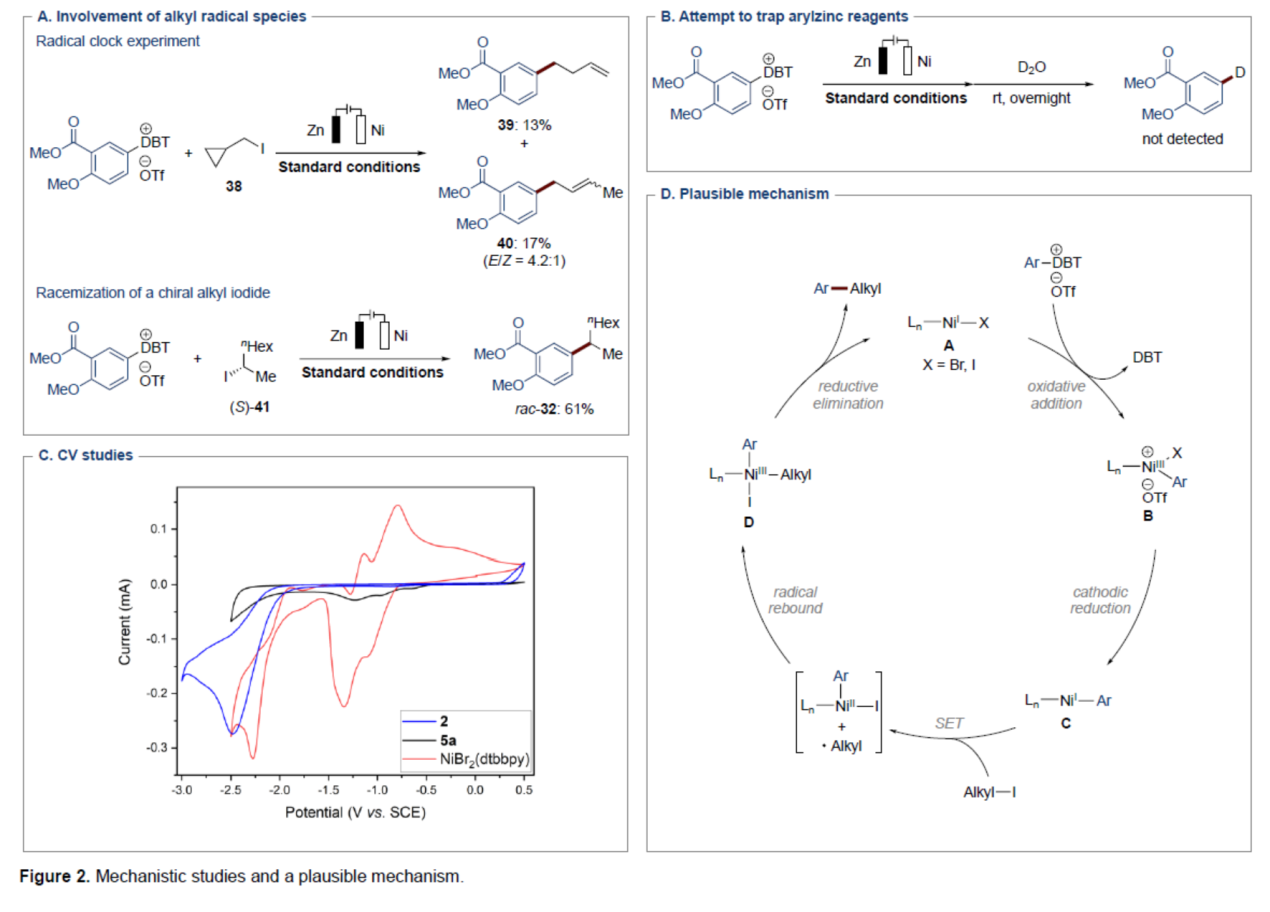
(图片来源:Angew. Chem. Int. Ed.)
为了进一步证明上述的反应机理,作者还进行了相关的DFT研究(Figure 3)。计算结果表明,该反应涉及ISET(inner sphere electron transfer)、自由基重组与还原消除的过程。
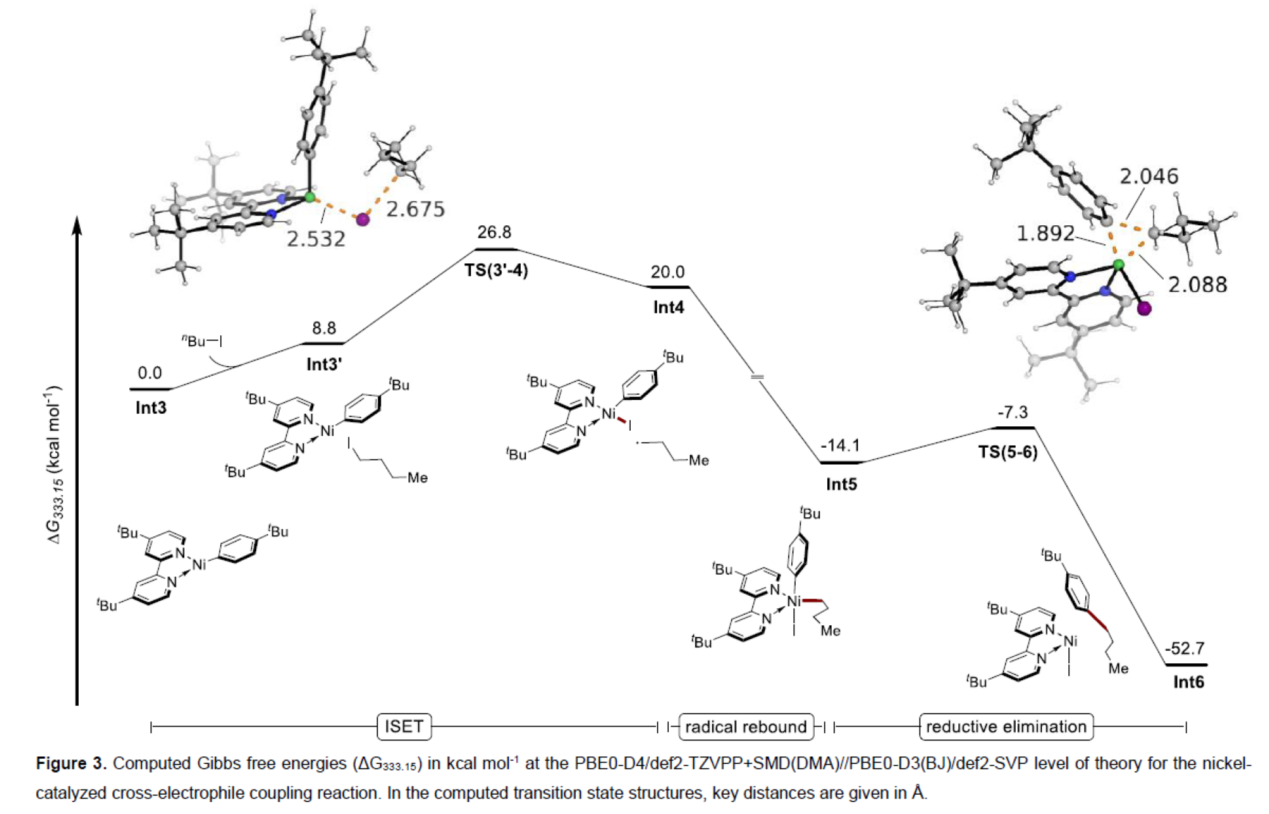
(图片来源:Angew. Chem. Int. Ed.)
总结
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn