

Alstrostine G (1)、alstratine A (2)、arbornamine (3)、peganumine A (4)、roemeridine (5)、peharmaline A (6)、tabertinggine (7)和voacafricine A (8)等吲哚生物碱具有特征性的含氮杂季碳β-咔啉骨架,且表现出良好的生物活性(图 1)。2017 年,Cai 和 Zhang 小组从Alstonia rostrata的树皮和树干中分离出 alstrostine G。具有复杂的 6/5/6/6/5/6 六环笼状骨架,5个手性中心,多环和刚性框架使其合成具有很大挑战性。化学加——科学家创业合伙人,欢迎下载化学加APP关注。
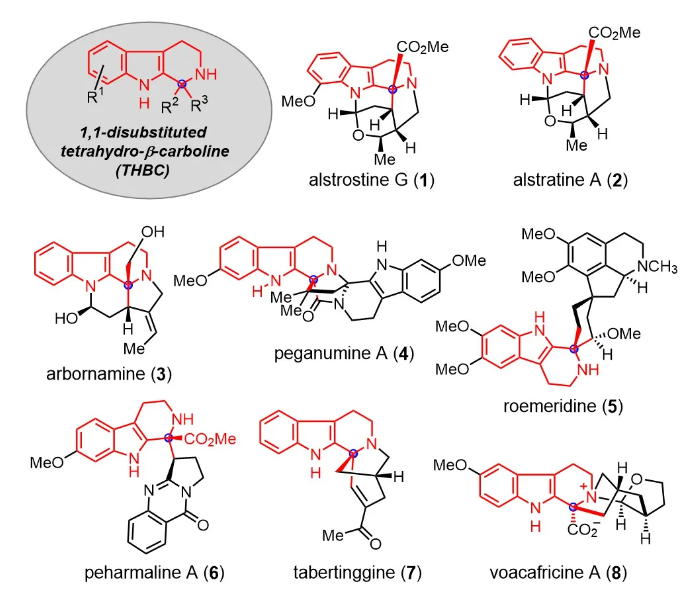
图1 具有THBC骨架的吲哚生物碱
作者设想天然产物(+)-alstrostine G的F环,可由中间体9通过双键的氧化/环化得到;9的D/E环系,由中间体10通过串联Heck/环化反应一步构建;10由中间体11通过N-烷基化、酯的还原得到;起初,作者认为含氮杂季碳三环化合物11由色胺衍生物12a和酯衍生物13,通过不对称Pictet-Spengler反应得到。
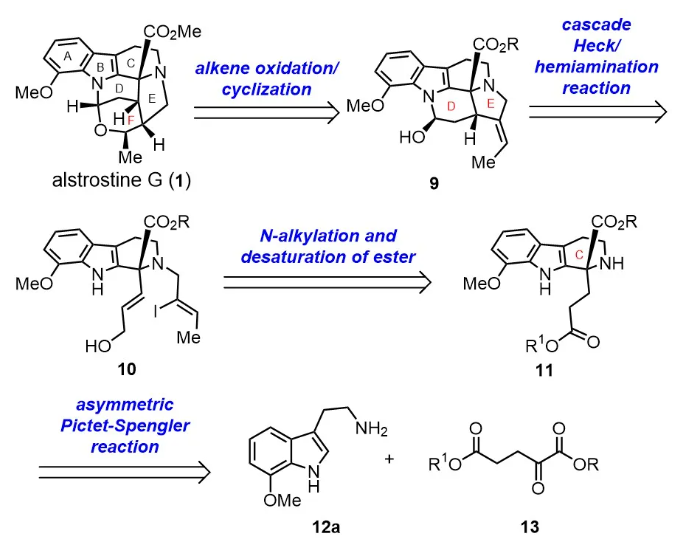
图2 逆合成思路
遗憾的是,作者尝试了手性催化剂Cat-1和Cat-1,都没有得到期望的不对称Pictet-Spengler产物18。仅获得少量的四环内酰胺产物18-1a,或者得到少量的不期望酰胺化产物19a和19b。作者推测吲哚环上7-位取代基的电性和空间位阻,影响了色胺的反应活性,以及对底物和手性催化剂之间络合也产生很大的影响。为了解决含氮杂季碳三环化合物的合成问题,作者设想通过环状1,3-二醇的去对称化反应,构建C16位的氮杂季碳中心。该方法的优势在于:反应位点与吲哚环相距三个共价键,很大程度上减弱了由取代基引起的不利空间位阻和电性的影响。
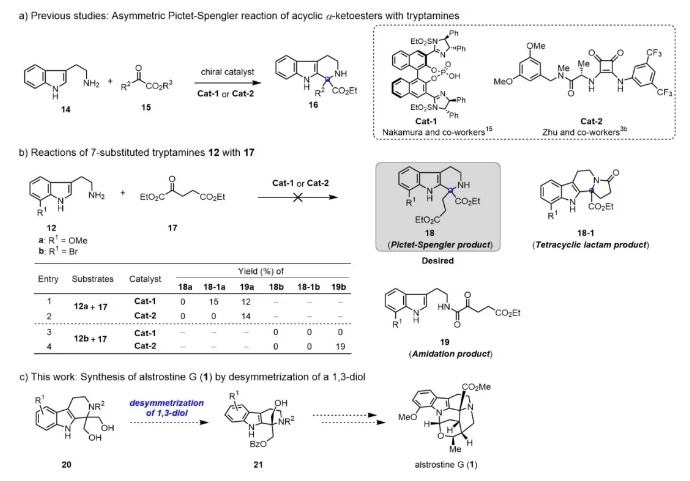
图3 Pictet-Spengler反应及1,3-二醇的去对称化思路
首先,作者使用1,3-二醇20a作为模型底物,探索了体系的最优反应条件。最终发现在CuC2, L8, NEt3, BzCl条件下,以84%收率,85% ee获得了化合物21a。值得注意的是,将反应放大至克级规模,以更加优异的收率和对映选择性获得21a。
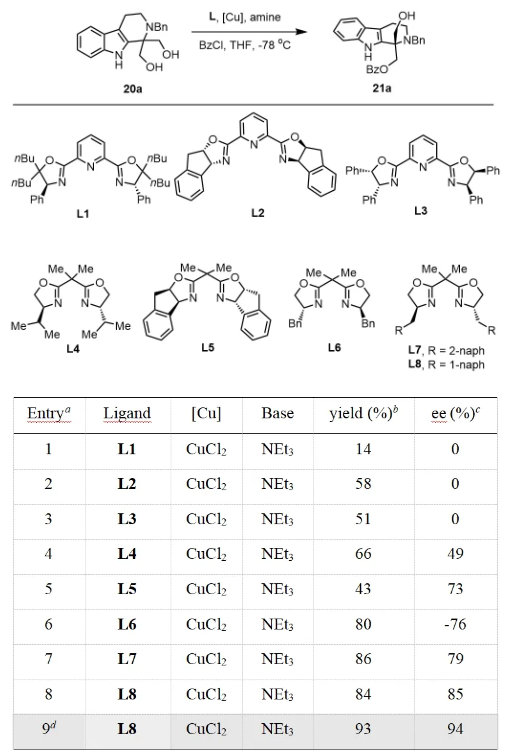
aStandard conditions except as otherwise indicated: a mixture of 20a (0.3 mmol), ligand (0.03 mmol, 10 mol%), [Cu] (0.03 mmol, 10 mol%), amine (0.33 mmol) and BzCl (0.45 mmol) in THF (0.05 M) was stirred at -78 oC for 18 h. bIsolated yield. cDetermined by HPLC analysis. d20a (3.0 mmol). Bn = benzyl.
图4最优反应条件的筛选
在得到最优的反应条件后,作者对底物的范围进行了探索。具有不同 N-保护基团的底物具有令人满意的收率和对映选择性(21b 和 21c)。吲哚环上不同位置(C7、C6、C5、C4位)的取代基,无论是给电子基团或者吸电子基团(CH3O、F、Br、CH3等取代基)耐受性良好,都能以中等到良好的收率和对映选择性获得相应的单苯甲酰化产物(21b-n)。结果表明,在相同取代位置上,含有溴取代基的底物比甲氧基取代的底物具有更高的对映选择性。另外,溴基团很方便通过过渡金属催化进行后续的官能团转化。21d、21g 和 21j 中吲哚部分的取代基团分别与alstrostine G (1), peganumine A (4)/peharmaline A (6)和voacafricine A (8)上的取代基团相匹配,表明该方法的潜在价值。
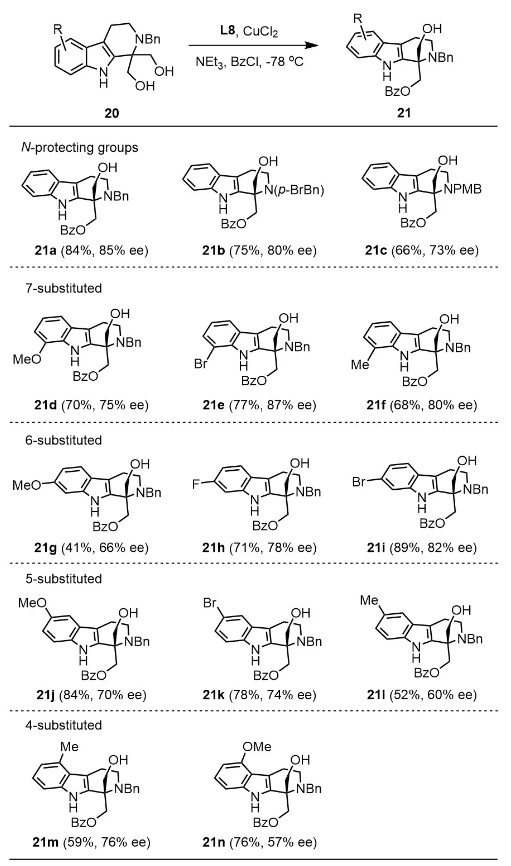
图5底物范围
作者通过化合物21d,进一步验证了该方法的实用价值,完成了(+)-alstrostine G的不对称全合成。从已知化合物22出发,与酮基丙二酸二乙酯23 发生Pictet-Spengler反应,然后还原二酯,获得二醇20d。在最优条件下,20d(463 mg规模)的对映选择性单苯甲酰化,以70%收率和76% ee值得到21d。令人高兴的是,在乙酸乙酯/己烷中经过一次重结晶后,ee值可提高至97%。接下来,依次通过TBS保护、脱苄基以及N-烷基化得到化合物26,通过单晶衍射确定结构和绝对构型。DIBAL-H脱除苯甲酰基,再经过氧化、Horner–Wadsworth–Emmons反应获得α,β-不饱和酯28。DIBAL-H条件下还原酯基,得到关键的Heck反应前提29。在Pd(OAc)2, PPh3, NEt3, CH3CN条件下,发生分子内Heck/半胺化串联反应,以71%的收率一步构建D/E环系,且获得单一构型的五环化合物30,表明新形成C15的手性完全由C16控制。值得注意的是,当使用E-碘乙烯时不能发生环化反应,导致与氮原子相连的烷基链脱除。接下来,作者计划将三取代烯烃30或其类似物转化为醇32。这种看似简单的官能团转化,实际上具有很大的挑战性。作者尝试了硼氢化/氧化、环氧化等一系列条件,都没有得到所需的产物。最终,通过多步反应解决该问题。依次进行TMS保护、双羟化、氧化得到α-羟基酮31。通过一锅法进行SmI2介导的脱氧和酮的还原,获得32以及非对映异构体的混合物。接着发生BF3·Et2O促进的立体选择性F环的形成、脱硅基保护获得了六环骨架 33,通过单晶衍射确定结构和绝对构型。最后通过两步转化,以最终18步完成 (+)-alstrostine G的不对称全合成。
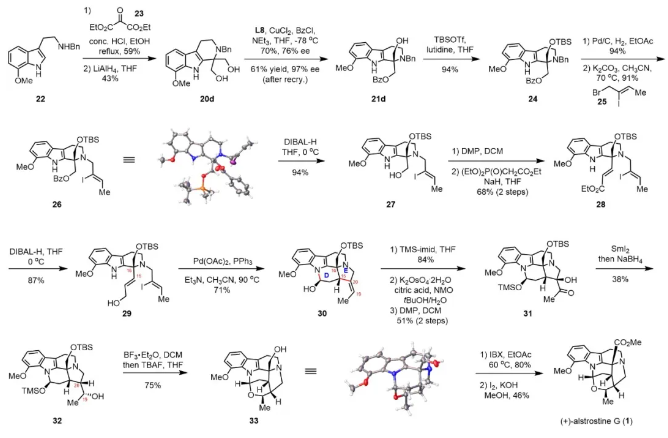
图6 (+)-alstrostine G的全合成
导师信息
马志强, 2001年在兰州大学化学化工学院获得学士学位,之后进入中国科学院上海有机化学研究所攻读有机化学博士学位(导师:翟宏斌教授)。2007年博士毕业后,进入美国德克萨斯大学西南医学研究中心生物化学系从事博士后研究(合作导师:Chuo Chen教授)。2016年加入华南理工大学化学与化工学院,教授,博士生导师。主要研究方向为天然产物合成、有机合成方法学、药物化学。共发表论文近30 篇,其中第一作者Science论文1篇、Angew. Chem. Int. Ed. 论文1篇、独立工作以来发表通讯作者Angew. Chem. Int. Ed. 论文5篇。授权专利4件。主持国家海外高层次人才计划青年项目、国家自然科学基金面上项目、广东省珠江人才计划青年拔尖人才项目等省部级项目。
课题组主页:https://www2.scut.edu.cn/chemistry_Malab/main.htm
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn