

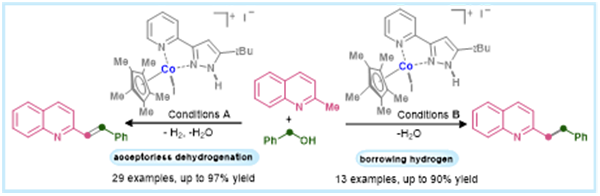
喹啉及其衍生物是医药、农业、材料和天然产物分子中最重要的结构之一,例如孟鲁司特、加利匹宁、库司帕林等(图1,A)。甲基氮杂芳烃C(sp3)–H键的官能化是构建高附加值杂芳香族化合物的一种简单方便的方法(图1,B)。尽管已有一些报道发展了贵金属、非贵金属催化的醇对甲基氮杂芳烃的烯基化或烷基化反应,但利用丰产金属催化同时构建C–C单键和双键产物,并通过反应条件控制化学选择性、实现偶联产物的选择性合成仍然有待发展。
唐从辉课题组致力于丰产金属催化的均相、多相(单原子、纳米)催化体系开发(近期代表性工作:J. Am. Chem. Soc. 2024, 146, 11801–11810; J. Am. Chem. Soc. 2024, 146, 2769–2778; J. Am. Chem. Soc. 2023, 145, 4142–4149; Angew. Chem. Int. Ed. 2024, 63, e202314708; Angew. Chem. Int. Ed. 2023, 62, e202314364; Angew. Chem. Int. Ed. 2023, 62, e202303433)。在此, 基于其最近开发的以钴为中心的N,N-双齿配体配合物,他们实现了甲基氮杂芳烃C(sp3)–H键与醇偶联,化学选择性地获得烯基化或烷基化产物的过程(图1,C)。
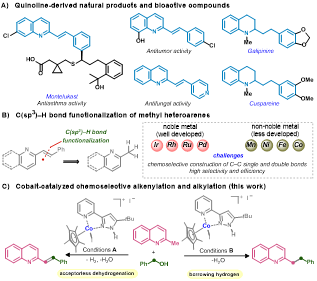
图1:通过C(sp3)–H键功能化化学选择性合成喹啉衍生物(来源:Journal of Catalysis)
作者首先选用2-甲基喹啉1a、苯甲醇2a作为起始原料,通过调整催化剂、碱、溶剂、浓度、温度等条件筛选确定了烯基化和烷基化的反应条件(表1)。作为对这一假设的初步尝试,作者研究了在钴催化剂([Cp*Co(tBuPPH)I]+I-)的作用下,在140 oC的甲苯中以2-甲基喹啉(1a)和苄醇(2a)为底物进行反应,只得到了烯化产物3a(表1,条目1)。通过对碱的筛选,发现氢氧化钠、氢氧化钾、叔丁醇钾都能促进3a的生成。其他溶剂,如二甲基亚砜和对二甲苯,对这一转化有不利影响(条目5-6)。此外,浓度、反应气氛和温度对性能也至关重要(条目8-10)。增加碱的用量可以催化3a和5a的形成,且转化效率相似(条目11)。进一步研究发现,5a/3a的比例可以通过改变苄醇和t-BuOK的用量来调节(条目12–13),获得5a的最佳条件是3.0当量的t-BuOK和5.0当量的2a,5a:3a 的比例为10:1(条目14)。
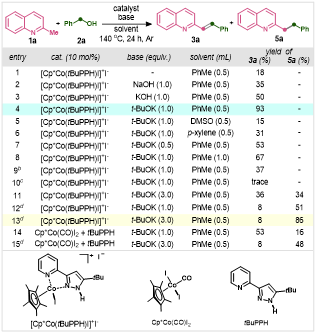
表1:反应条件筛选(来源:Journal of Catalysis)
在确定了最优反应条件后,在标准反应条件下,对该策略底物普适性进行探索(图2)。实验结果表明:该策略具有良好的底物适用范围,综合来看,无论是烯基化还是烷基化底物,吸电子基团和供电子基团均可很好地兼容,以良好至较高的产率得到目标化合物,产物均具有优异的化学选择性。另外,杂环类底物也可很好兼容,以中等至良好的产率、优异的化学选择性得到目标化合物。
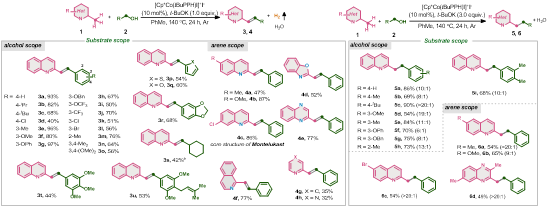
图2:底物范围(来源:Journal of Catalysis)
为了证明当前方法的合成实用性,我们尝试将获得的产物进一步衍生化,并展示这种方法在合成天然存在的生物碱方面的潜力(图 3)。令人满意的是,化合物3q在镍催化下发生了转移氢化反应,使N-杂环和C=C双键都发生了还原反应,从而得到了7a,收率为87%;随后用MeI顺利进行了N-甲基化反应,生成了加利平碱7b,收率为81%。同样,通过两个步骤还得到了另一种镇痛化合物Cuspareine 8b,这表明烯基化或烷基化产物均可用于进一步的应用合成。
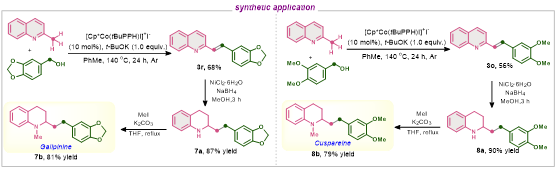
图3:合成应用(来源:Journal of Catalysis)
根据机理实验和相关文献,作者提出了可能的机理(图 4)。首先,催化剂[Cp*Co(tBuPPH)I]+I- 经过碱处理,得到失去HI的催化活性物种[Cp*Co(tBuPP)I]。随后,醇2a经历内球机制发生无受体脱氢反应生成醛2a',氢以[Co–H]的形式储存在金属配合物中。随后,在钴催化剂存在下,醛与1a发生缩合反应,生成偶联产物3a。如机理研究所示,钴催化剂在另一个醇分子的帮助下释放出分子氢,并再生出[Cp*Co(tBuPP)I],而[Co–H]物种则进一步通过借氢途径促进5a的形成。
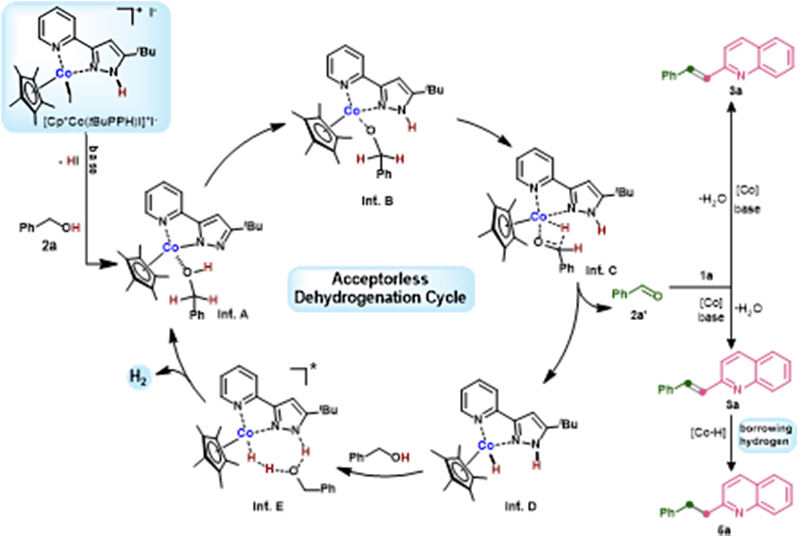
图4:可能的反应路径(来源:Journal of Catalysis)
小结
课题组简介

声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn