- 首页
- 资讯
JACS:手性明确的多取代双环[1.1.0]丁烷的合成
来源:化学加原创 2024-05-17
导读:近日,以色列理工学院Ilan Marek课题组报道了一种高度非对映选择性合成具有多达三个手性明确(stereodefined)的季碳中心和五个取代基的多取代双环丁烷(bicyclobutanes)的方法。其中,该策略涉及通过环丙烯衍生物的非对映选择性碳金属化以及环化构建双环丁烷骨架的过程。此外,这种简单的方法可引入各种取代基和官能团,且避免了对吸电子官能团的需求。文章链接DOI:10.1021/jacs.4c04438.
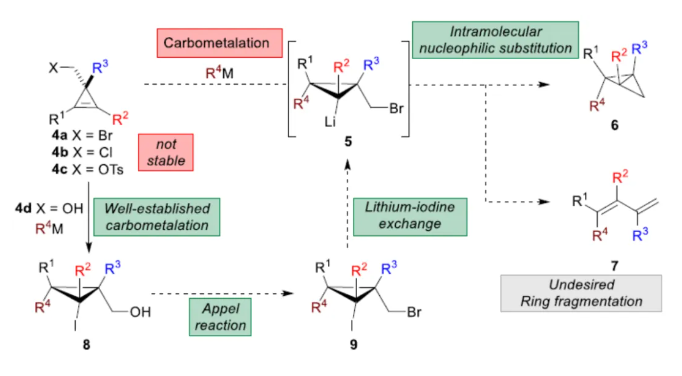
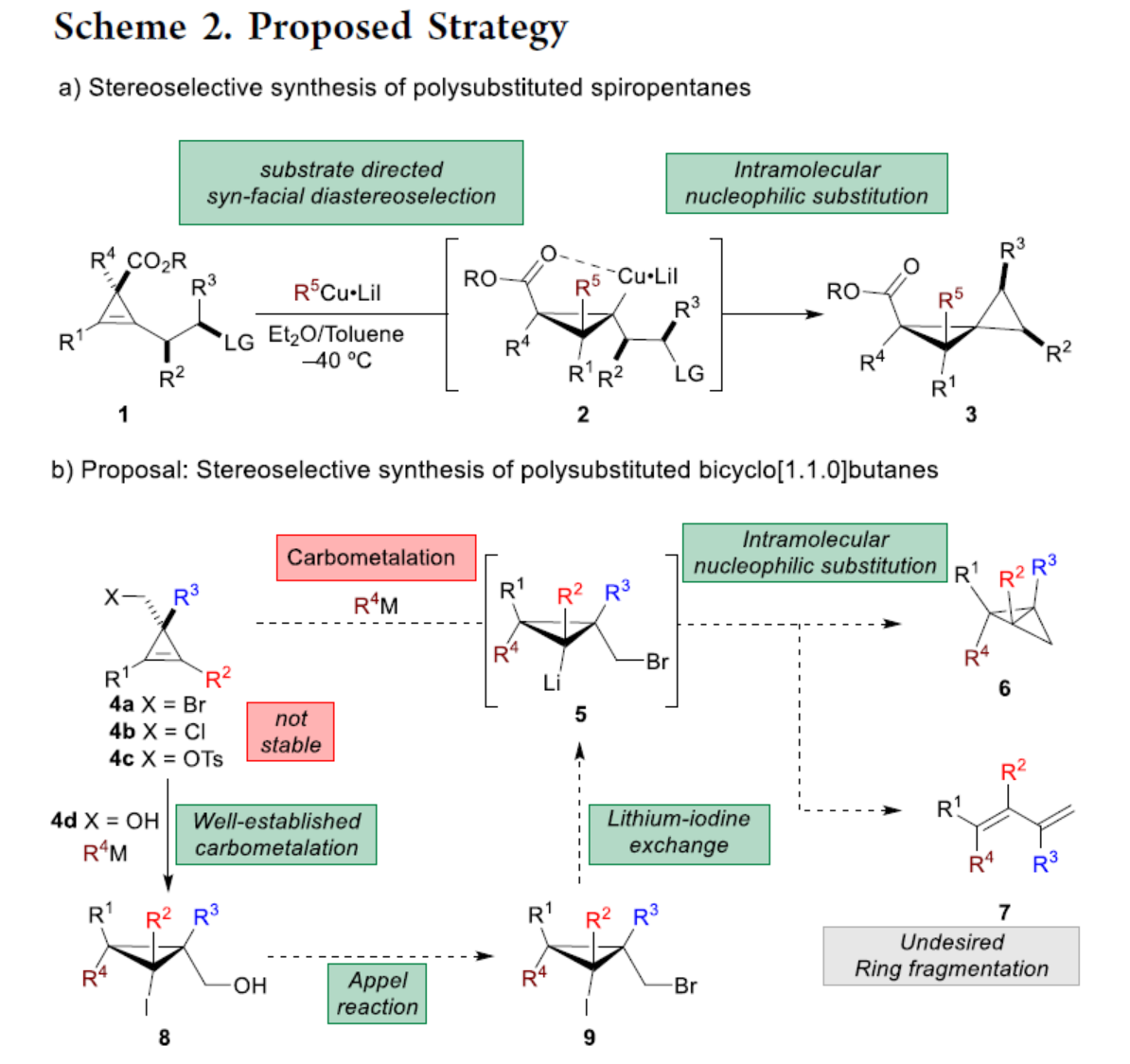
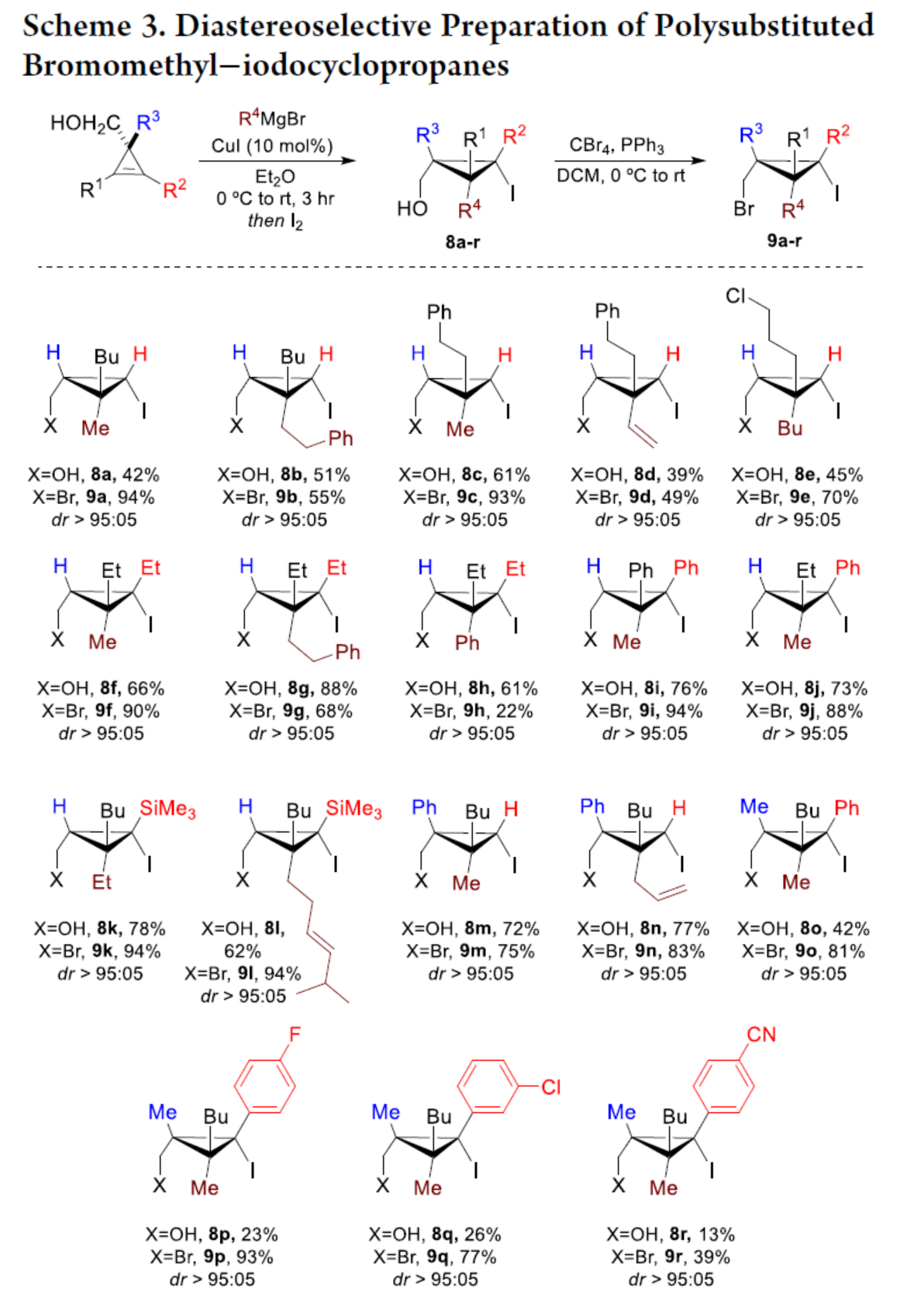
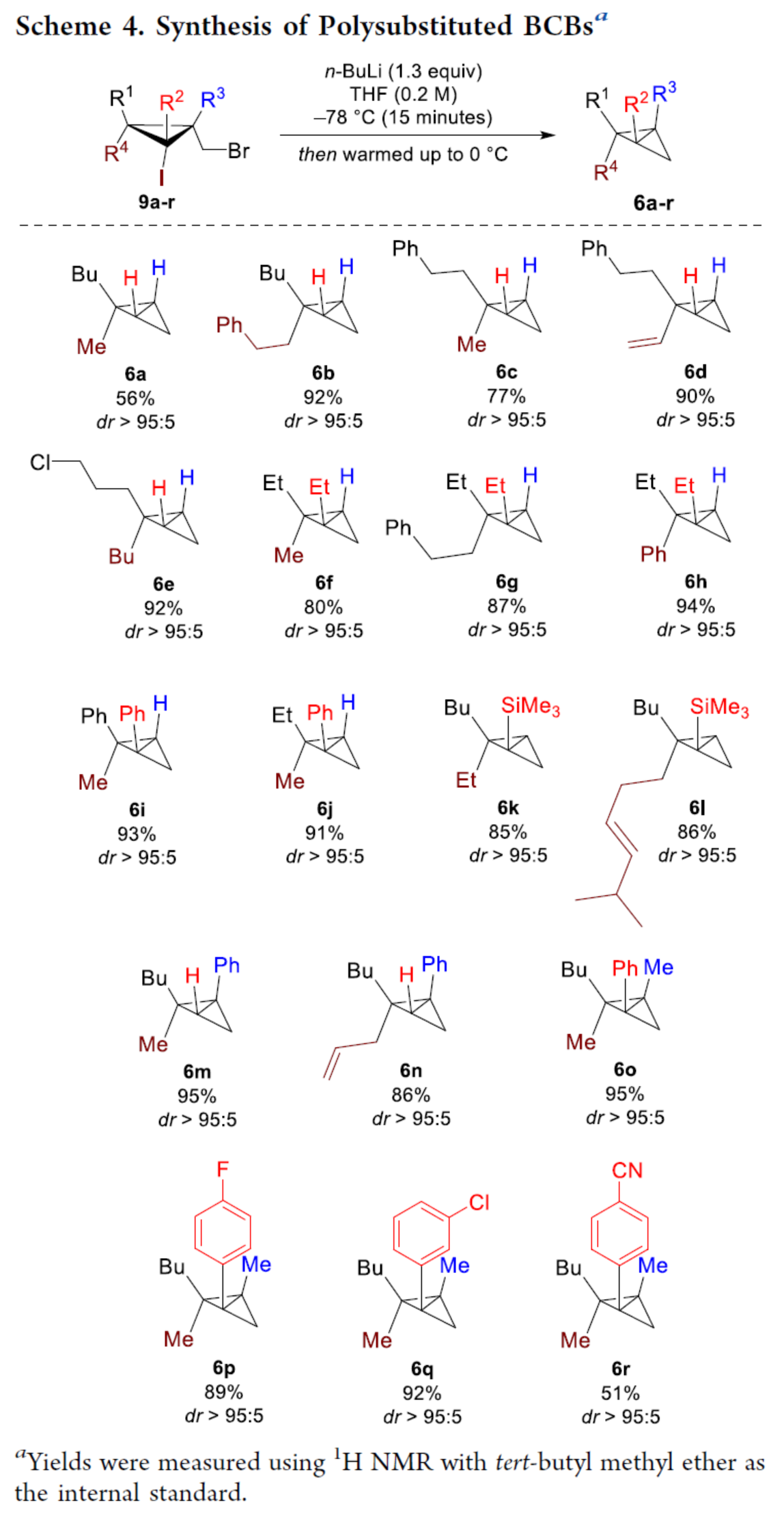
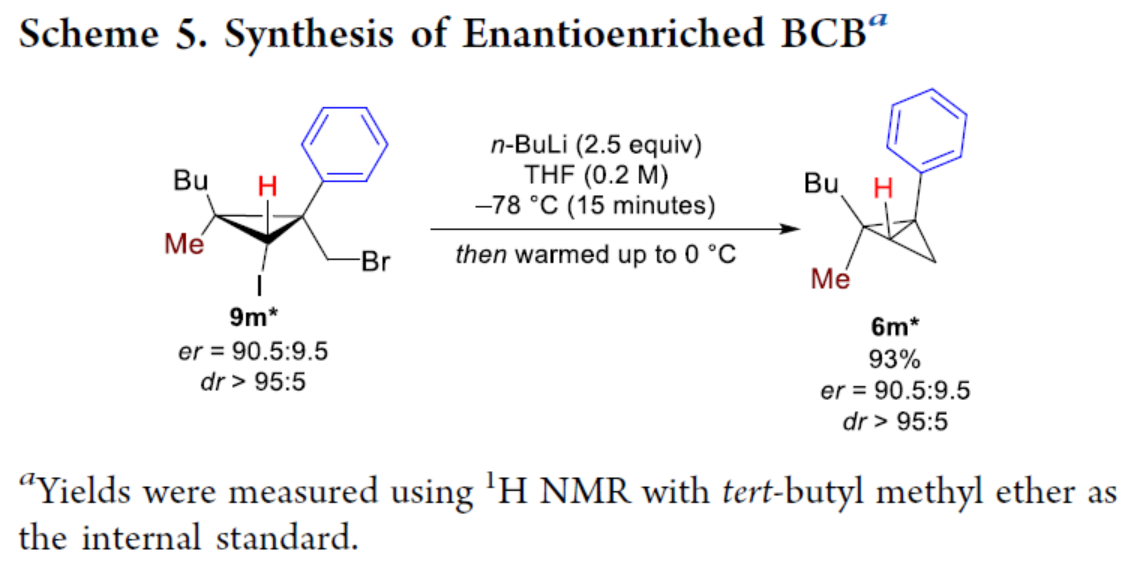
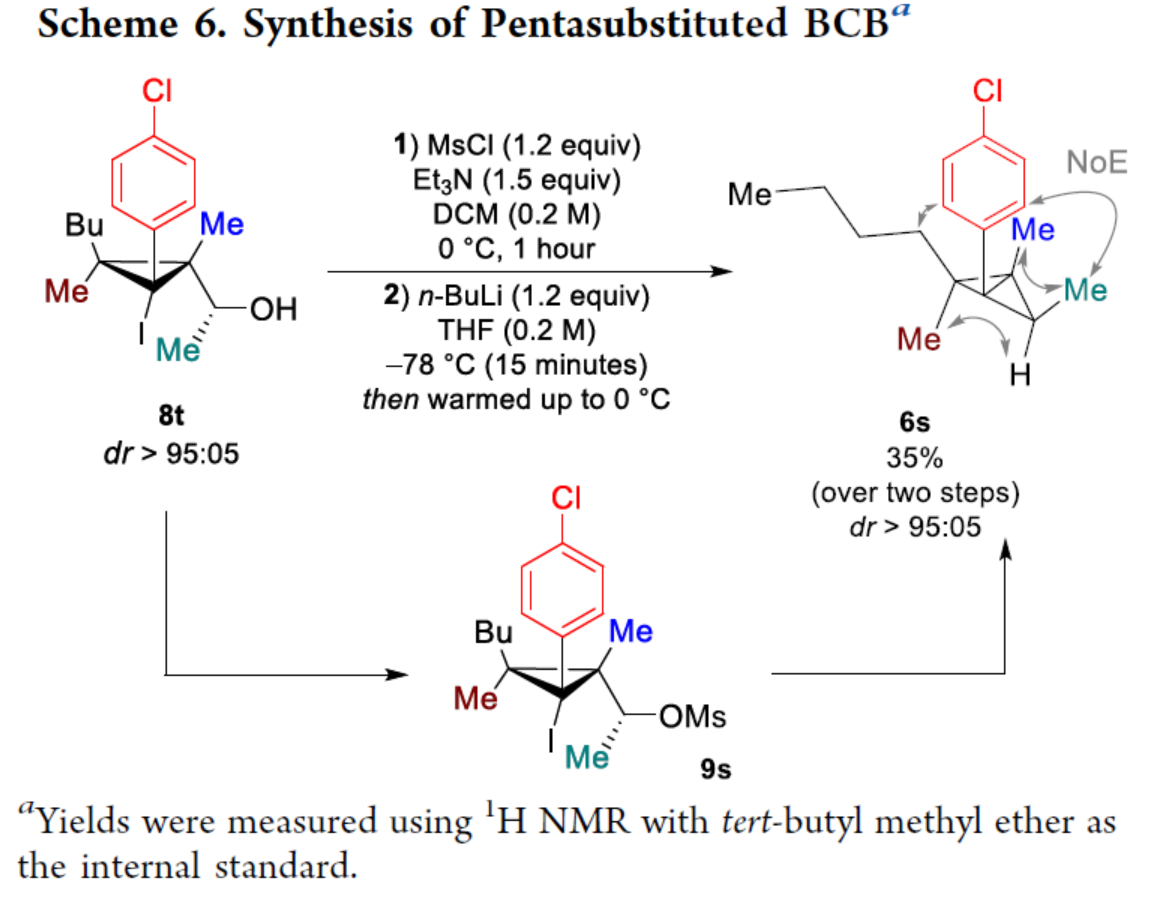
化学加——科学家创业合伙人,欢迎下载化学加APP关注。双环[1.1.0]丁烷(BCB)是最小的稠环碳环,具有最高的张力能,由Wiberg和Ciula等人于1959首次合成(J. Am. Chem. Soc. 1959, 81, 5261.)。从那时起,BCBs一直是一类重要的合成砌块,可分别进行亲核、亲电、自由基、卡宾和周环反应,从而实现各种不同分子骨架的构建。近年来,BCBs作为手性明确的环丁烷和富含C(sp3)的生物电子等排体。然而,对于手性明确的多取代BCBs的合成,目前却较少有相关的研究报道。在Moore和Skattebo̷l课题组关于桥取代BCBs合成的开创性报告之后,化学家们还开发了几种制备具有两个或多个取代基的BCBs的替代策略(Scheme 1a)。然而,随着取代基数量的增加,这些策略中的许多方法往往难以实现精确的立体化学控制,尤其是季碳中心的立体控制。同时,它们中的大多数都需要桥头碳中心上具有吸电子基团(EWG),从而极大限制了BCB的多样性。此外,通过将简单BCBs的桥头或桥位进行金属化,然后进行亲电捕获,是另一种引入取代基的方法。其中,EWG的存在促进了反应的有效进行。在这种情况下,Anderson课题组(J. Am. Chem. Soc. 2021, 143, 21246; Org. Lett. 2024, 26, 360.)报道了一个额外的官能团化步骤,包括使用锂碱对桥C−H键进行金属化,然后进行亲电捕获/交叉偶联,从而形成桥取代的BCBs(Scheme 1b)。然而,这些方法在手性明确的季碳中心的合成方面是有限的。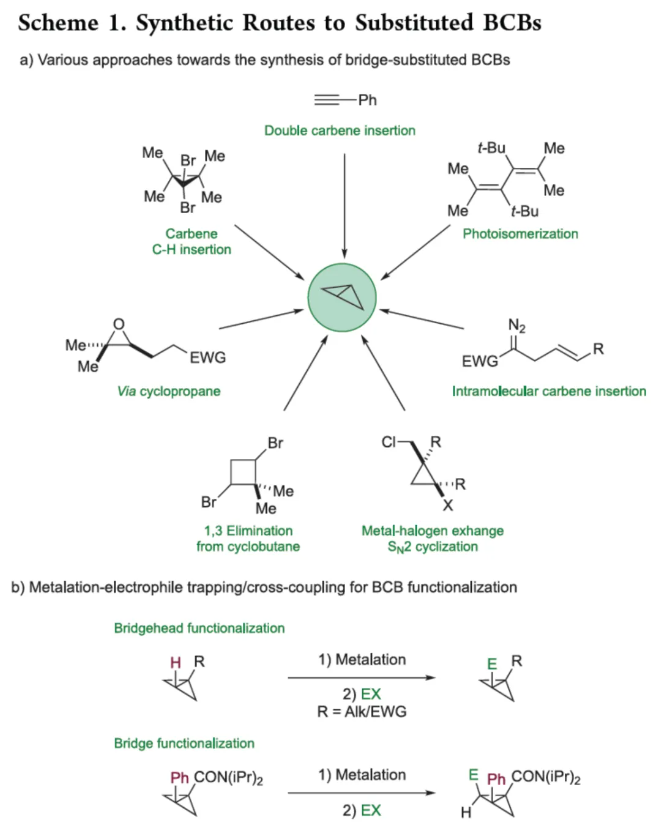 2022年,Marek课题组(J. Am. Chem. Soc. 2022, 144, 16732.)报道了一种高效而直接的合成手性明确的多取代螺戊烷3的方法。该方法涉及环丙烯衍生物1的非对映选择性碳铜化以生成环丙基铜配合物2,其随后环化以生成具有优异非对映选择性的螺戊烷3的过程(Scheme 2a)。受上述方法的启发,Marek课题组利用环丙基金属配合物的环化,用于BCBs的立体选择性合成(Scheme 2b)。最初,作者认为,在环丙烯基甲基位置(X = Br,Cl,OTs;分别为4a−4c)具有离去基团的环丙烯4,通过顺式非对映控制的碳金属化反应,生成环丙基金属5。环丙基金属5经分子内亲核取代后,可在一锅操作中从化合物4生成所需的BCBs 6。然而,该方法存在几个缺陷,如当X是一个好的离去基团时,起始原料的稳定性以及环丙基金属5到6的所需环化可能会被环断裂成二烯7所掩盖。为了避免上述问题的发生,Marek课题组采用了另一种策略,即利用金属-卤素交换以及环化的策略。稳定的环丙烯基甲醇4d进行非对映选择性铜催化的碳镁化反应,然后用I2进行亲电捕获,可以优异的收率和非对映选择性生成环丙基碘化物8。醇8在Appel反应条件下可转化为关键中间体溴化物9。中间体溴化物9经锂-碘交换与环化,从而生成多取代手性明确的BCB 6。然而,除了分子内亲核取代之外,还需要9的选择性锂-卤素交换,而不是不希望的裂解反应成为二烯副产物7。首先,作者对非立体选择性合成多取代溴甲基碘代环丙烷的底物范围进行了扩展(Scheme 3)。在铜催化碳镁化反应条件下,一系列不同取代的环丙烯衍生物,均可顺利进行反应,可以单个非对映体的形式获得相应的产物8a−8r。值得注意的是,对于R1、R2、R3 ≠ H的情况下,碘化反应以低收率进行,如8o−8r。因此,碳金属化-碘化串联过程是在环丙烯酯上进行的。然后,在Appel反应条件下,上述的产物8a−8r,也均可顺利进行反应,获得相应的产物9a-9r,收率为22-94%,dr > 95:5。其次,作者对合成多取代BCBs的底物范围进行了扩展(Scheme 4)。当底物9中的R4为甲基、苄基、烯基、丁基等时,均可顺利进行反应,获得相应的产物6a-6o,收率为56-95%,dr > 95:5。当底物9中的R2为不同的芳基取代时,反应也能够顺利进行,获得相应的产物6p-6r,收率为51-92%,dr > 95:5。值得注意的是,该反应具有良好的官能团兼容性。同时,以对映体富集的环丙烯为底物,在手性铑催化下,可获得对映体富集的溴甲基碘代环丙烷9m*,er为90.5:9.5,dr > 95:5。9m*在Appel反应条件下,可以93%的收率得到手性BCB产物6m*,er为90.5:9.5,dr > 95:5(Scheme 5)。值得注意的是,这是第一个在桥上具有季碳中心的对映体富集BCB的合成例子。此外,通过对反应条件的多次尝试后发现,通过甲酰化将醇化合物8t转化为离去基团,以避免制备不太稳定的卤化物与副反应。在标准反应条件下,甲磺酸盐9s产生了作为单一非对映体的所需的五取代BCB 6s,收率为35%,dr > 95:5(Scheme 6)。
2022年,Marek课题组(J. Am. Chem. Soc. 2022, 144, 16732.)报道了一种高效而直接的合成手性明确的多取代螺戊烷3的方法。该方法涉及环丙烯衍生物1的非对映选择性碳铜化以生成环丙基铜配合物2,其随后环化以生成具有优异非对映选择性的螺戊烷3的过程(Scheme 2a)。受上述方法的启发,Marek课题组利用环丙基金属配合物的环化,用于BCBs的立体选择性合成(Scheme 2b)。最初,作者认为,在环丙烯基甲基位置(X = Br,Cl,OTs;分别为4a−4c)具有离去基团的环丙烯4,通过顺式非对映控制的碳金属化反应,生成环丙基金属5。环丙基金属5经分子内亲核取代后,可在一锅操作中从化合物4生成所需的BCBs 6。然而,该方法存在几个缺陷,如当X是一个好的离去基团时,起始原料的稳定性以及环丙基金属5到6的所需环化可能会被环断裂成二烯7所掩盖。为了避免上述问题的发生,Marek课题组采用了另一种策略,即利用金属-卤素交换以及环化的策略。稳定的环丙烯基甲醇4d进行非对映选择性铜催化的碳镁化反应,然后用I2进行亲电捕获,可以优异的收率和非对映选择性生成环丙基碘化物8。醇8在Appel反应条件下可转化为关键中间体溴化物9。中间体溴化物9经锂-碘交换与环化,从而生成多取代手性明确的BCB 6。然而,除了分子内亲核取代之外,还需要9的选择性锂-卤素交换,而不是不希望的裂解反应成为二烯副产物7。首先,作者对非立体选择性合成多取代溴甲基碘代环丙烷的底物范围进行了扩展(Scheme 3)。在铜催化碳镁化反应条件下,一系列不同取代的环丙烯衍生物,均可顺利进行反应,可以单个非对映体的形式获得相应的产物8a−8r。值得注意的是,对于R1、R2、R3 ≠ H的情况下,碘化反应以低收率进行,如8o−8r。因此,碳金属化-碘化串联过程是在环丙烯酯上进行的。然后,在Appel反应条件下,上述的产物8a−8r,也均可顺利进行反应,获得相应的产物9a-9r,收率为22-94%,dr > 95:5。其次,作者对合成多取代BCBs的底物范围进行了扩展(Scheme 4)。当底物9中的R4为甲基、苄基、烯基、丁基等时,均可顺利进行反应,获得相应的产物6a-6o,收率为56-95%,dr > 95:5。当底物9中的R2为不同的芳基取代时,反应也能够顺利进行,获得相应的产物6p-6r,收率为51-92%,dr > 95:5。值得注意的是,该反应具有良好的官能团兼容性。同时,以对映体富集的环丙烯为底物,在手性铑催化下,可获得对映体富集的溴甲基碘代环丙烷9m*,er为90.5:9.5,dr > 95:5。9m*在Appel反应条件下,可以93%的收率得到手性BCB产物6m*,er为90.5:9.5,dr > 95:5(Scheme 5)。值得注意的是,这是第一个在桥上具有季碳中心的对映体富集BCB的合成例子。此外,通过对反应条件的多次尝试后发现,通过甲酰化将醇化合物8t转化为离去基团,以避免制备不太稳定的卤化物与副反应。在标准反应条件下,甲磺酸盐9s产生了作为单一非对映体的所需的五取代BCB 6s,收率为35%,dr > 95:5(Scheme 6)。色列理工学院Ilan Marek课题组开发了一种简单且直接的方法,可合成手性明确的多取代BCBs。这种方法能够在缺乏EWG的情况下,制备具有多达三个具有不同取代基和取代模式的季碳手性中心的BCBs。同时,该方法还可合成具有季碳中心的对映体富集的BCB。此外,作者还合成了第一个具有不同取代基的无差异五取代BCB。文献详情:
Synthesis of Stereodefined Polysubstituted Bicyclo[1.1.0]butanes. Rahul Suresh, Noam Orbach, Ilan Marek*. https://doi.org/10.1021/jacs.4c04438
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn