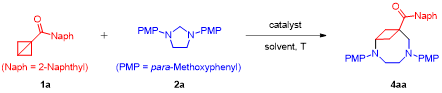桥环体系作为母核结构广泛存在于天然产物、药物分子以及一些生物活性分子中,因此,如何一步构建桥环骨架对于药物研发有着极为重要的意义。双环[1.1.0]丁烷(BCB)由于自身独特的化学性质,可以通过能量转移、单电子转移和双电子参与的各种策略实现(n+3)环加成反应(图1A)。
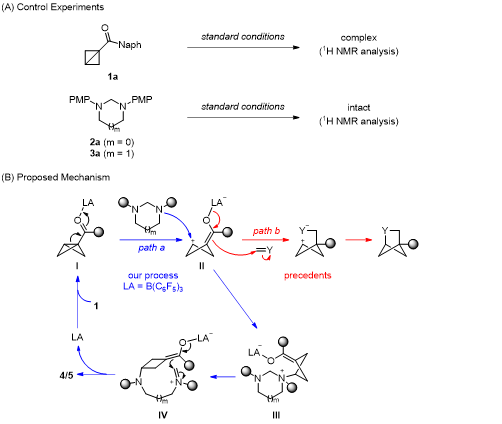
由于中环体系的碳(杂)环化合物具有较大的环张力,所以合成该类化合物也面临着巨大的挑战。根据彭士勇课题组之前的研究,已经实现了咪唑烷与供体-受体环丙烷(DAC)的(5+3)环加成反应,成功的构建了饱和1,4-二氮杂壬烷化合物,并且在基于路易斯酸催化下双环[1.1.0]丁烷与供体-受体环丙烷的反应活性的相似性,进一步提出咪唑烷能够与双环[1.1.0]丁烷发生偶极环化进而构建出中等桥环骨架体系的可能性。(图1B)。
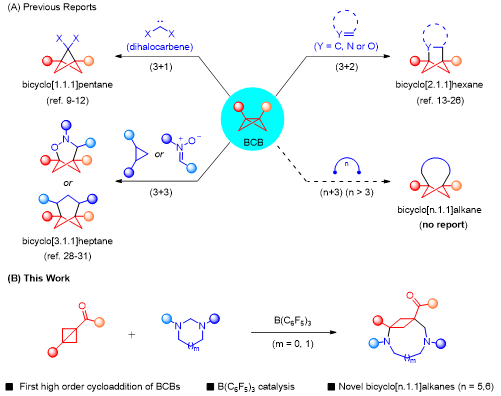
图1 研究背景(来源:Organic Letters)
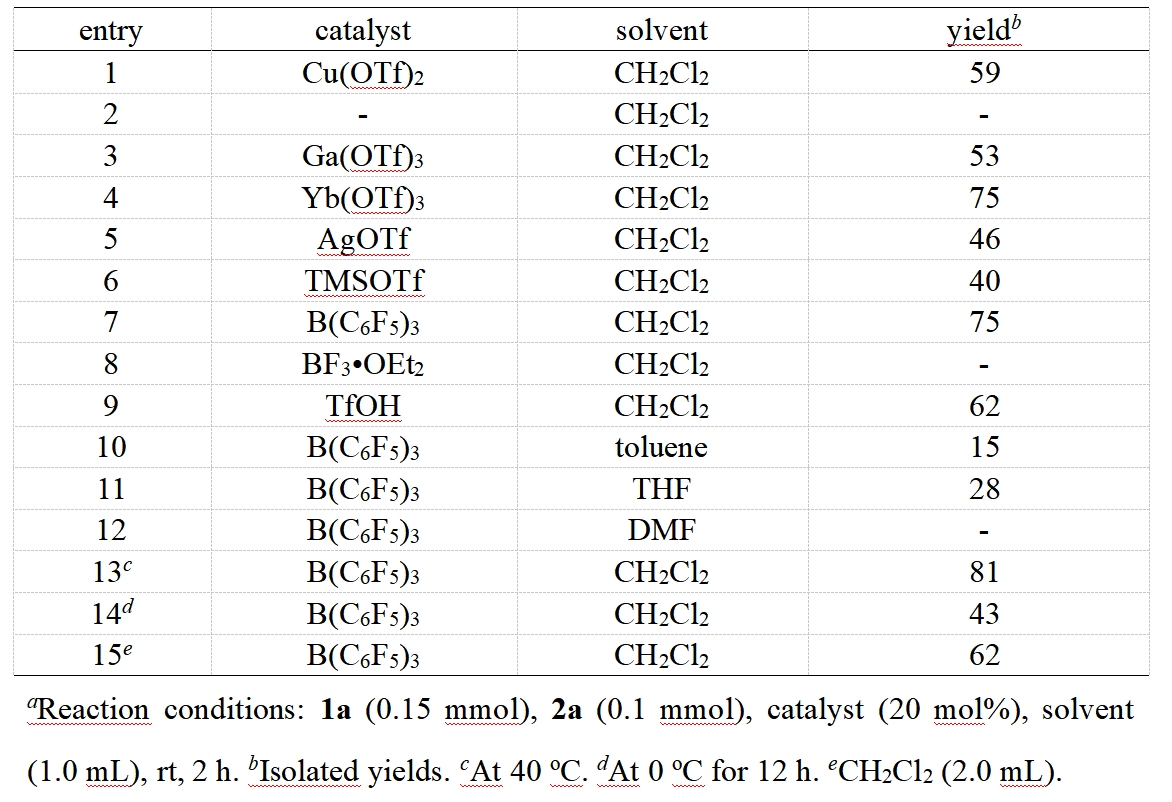
作者首先以双环[1.1.0]丁烷1a和咪唑烷2a作为模板底物对反应条件进行了优化,在最优的反应条件下,以81%的分离收率,生成产物4aa(表1)。
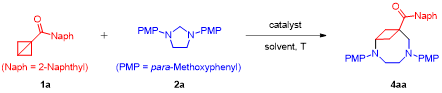
表1 条件筛选
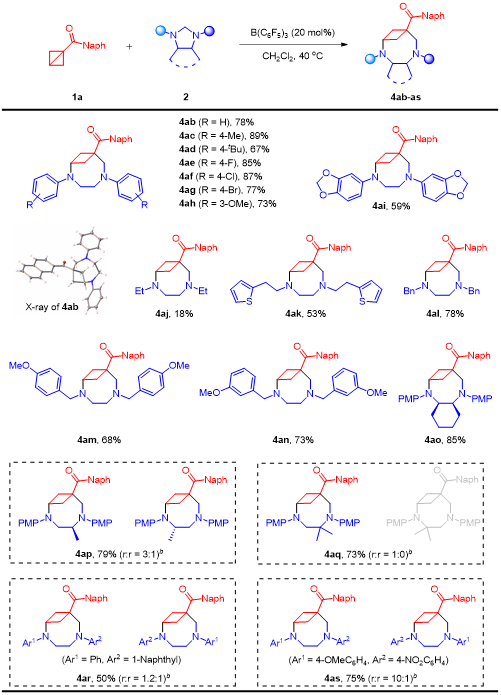
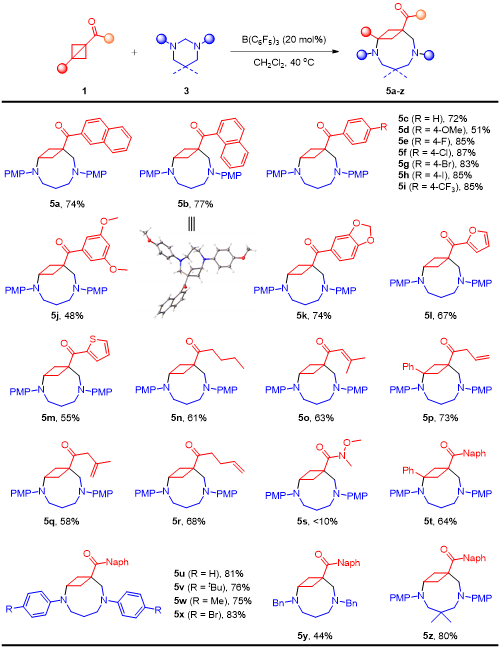
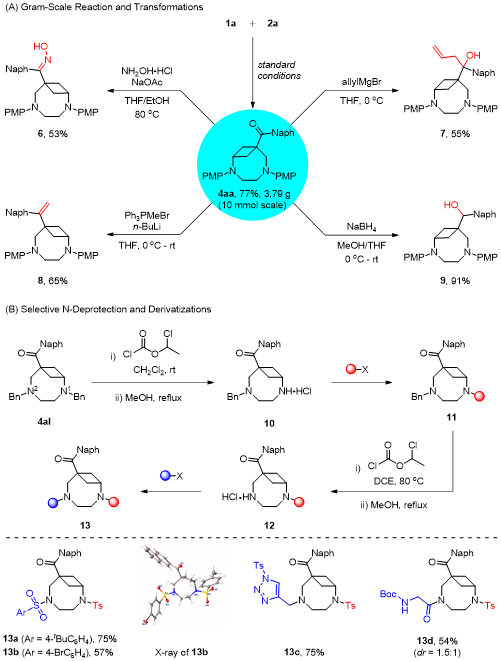
在上述的最佳反应条件下,作者对一系列BCB底物的应用范围进行了深入研究。当芳酮芳环上具有给电子或吸电子取代基、杂环取代基时,均能以中等至良好的收率得到目标产物。此外,脂肪酮包括链状脂肪烃、环烷烃、烯烃和炔烃都展现出良好的底物适用性,将BCB替换为1,3-二取代BCB时,依然能够以良好的收率获得目标产物(图2)。图2 (5+3)底物拓展(来源:Organic Letters)随后作者考察了咪唑烷氮原子上不同取代基对于该反应的影响,无论是烷基咪唑烷还是芳基咪唑烷,底物均能够顺利转化,得到相应的桥环化合物。紧接着作者也合成了一些非对称的咪唑烷进而考察了电子效应和位阻效应对区域选择性的影响(图3)。图3 (5+3)底物拓展(来源:Organic Letters)根据彭士勇课题组之前的研究结果,咪唑烷的同系物六氢嘧啶可以作为1,6-偶极前体。作者在标准条件下对反应进行了尝试,幸运的是,上述催化条件同样适用于该(6+3)环化过程(图4)。图4 (6+3)底物拓展(来源:Organic Letters)随后,作者进行了毫摩尔级放大反应以及产物的多样性转化,在10 mmol的反应规模下,标准条件下依然能以77%的收率获得目标产物,产物4aa的羰基可以高效的发生缩合反应、格氏反应、Wittig反应以及氢化反应,且桥环骨架并未受到影响。最后通过使用氯甲酸氯乙酯经过两步一锅法以定量的收率得到选择性苄基脱除的产物,进而能够选择性的在桥环氮原子上引入药效分子,展示了其在合成中的潜在应用性(图5)。图5转化应用(来源:Organic Letters)最后,作者通过设计对照试验,证明该反应是通过路易斯酸B(C6F5)3对BCB进行活化进而受到咪唑烷的亲核进攻而发生环化的反应路径获得目标分子,而非此前由Leitch、Studer以及Glorius所报道的BCB开环生成偶极子再去进攻另一底物的方式。根据实验结果,作者提出了可能的反应机制(图6)。图6 对照试验及可能的机制(来源:Organic Letters)彭士勇课题组报道了在温和的条件下以非金属路易斯酸B(C6F5)3为催化剂,实现了咪唑烷与双环[1.1.0]丁烷的(5+3)偶极环加成反应,反应具有优良的底物普适性。进一步地在该条件下实现了六氢嘧啶与双环[1.1.0]丁烷的(6+3)偶极环加成反应,得到了一系列2,6-二氮双环[6.1.1]癸烷化合物。据我们所知,这是双环[1.1.0]丁烷参与的首次高阶偶极环加反应,为以后基于双环[1.1.0]丁烷参与高阶偶极环加成反应打下了基础。Yang, L.;# Wang, H.;# Lang, M.; Wang, J.; Peng, S.* "B(C6F5)3-Catalyzed Formal (n + 3) (n = 5 and 6) Cycloaddition of Bicyclo[1.1.0]butanes to Medium Bicyclo[n.1.1]alkanes" Org. Lett. 2024, doi: 10.1021/acs.orglett.4c01219.五邑大学药学与食品工程学院彭士勇课题组成立于2017年,研究方向为金属有机化学,不对称合成。现已在ACS Catal., Org. Lett., J. Org. Chem.等期刊发表相关学术论文30余篇,主持国家自然科学基金,广东省自然科学基金、广东省教育厅、五邑大学高层次人才项目5项,详见课题组主页:https://www.x-mol.com/groups/peng_shiyong