


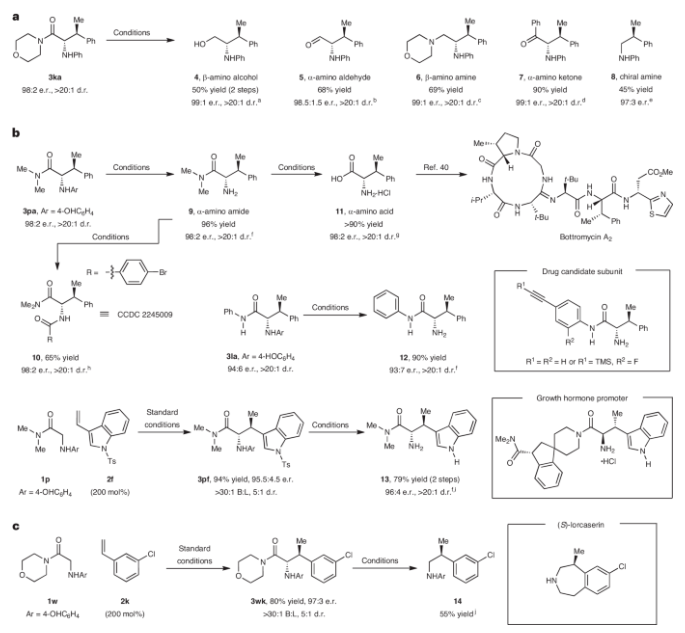
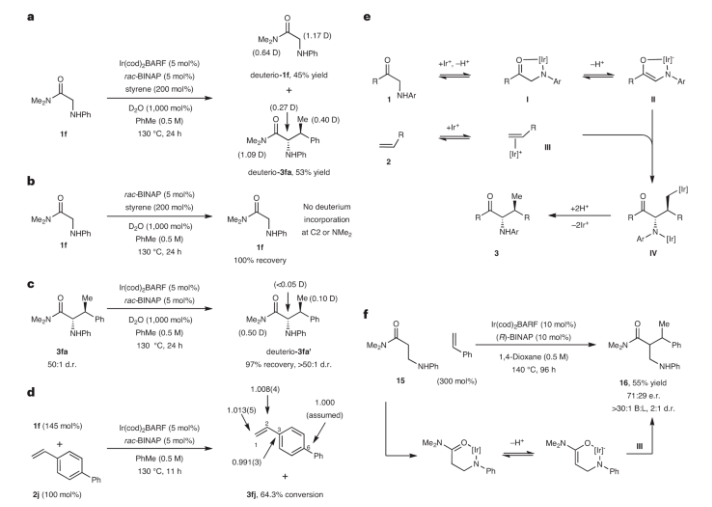
正文 图1展示了一种针对甘氨酸衍生物和烯烃的导向烯醇化策略,实现了对甘氨酸基前体进行直接的立体控制的C-H烷基化。图中a部分指出β-立体异构体α-氨基酸的合成难度,b部分描述了研究的目标方法,通过N-引导烯醇化实现对烯烃的立体选择性和支链选择性加成。c和d部分展示了传统的α-羰基化方法,需要预功能化反应物;e部分则描述了现有的催化α-烷基化方法,但仍需要预形成的烯醇酸根或条件较苛刻。本文的方法依赖于甘氨酸基N-H单元作为导向基(I),通过铱催化的烯醇化将其转化为几何确定的同手性烯醇酸II。这一方法解决了合成β-取代的α-氨基酸的直接问题,提供了一种基于引导基的直接立体选择性α-烷基化方法,同时为连续立体中心的合成提供了广泛的交叉偶联框架。下载化学加APP到你手机,收获更多商业合作机会。 作者为了寻找一种有效的反应条件,以将酰胺基系统与苯乙烯进行偶联,从而合成具有潜在生物活性的化合物。在图2中,研究者探索了不同反应条件下的反应优化和范围研究结果。首先,作者以1a-1f和苯乙烯2a作为起始原料对反应进行了探索和优化。得到的最佳条件为:1f (1.0 equiv), 2a (2.0 equiv), Ir(cod)2BARF (5 mol%), L5 (5 mol%), 在1,4-二氧六环(0.5 M)中130 oC反应72小时,可以以93%的核磁产率,97.5:2.5 er,10:1 dr得到相应的氢-烷基化产物3fa。此外,反应温度可以降至110 °C,仍然保持高效率。在反应范围方面,作者发现,三级酰胺、二级酰胺、一级酰胺、酮均可顺利实现此转化,以54-85%的分离产率得到相应的氢-烷基化产物3fa-3oa。此外,芳基上可以兼容包括羟基、甲氧基、甲基、卤素、三氟甲基等一系列官能团,以55-89%的产率得到相应的产物3pa-3wa。烯烃中的R2可以兼容不同取代的芳基、杂芳基以及二茂铁等骨架,以40-98%的产率得到产物3fb-3os。该转化还可以兼容药物分子吲哚美辛(indomethacin)所衍生的烯烃2t,以63%的产率得到产物3ft,证明了此转化的实用性。 图片来源:Nat. Chem. 作者在图3中进行了对照实验和机理研究,以解析酰胺基系统与苯乙烯之间的C-C键形成反应的机理。首先,作者通过对照实验确认了C-C键形成需要Ir配合物、羰基单元和NHAr单元的存在。进一步,在优化条件下,将1f和2a暴露于D2O存在的情况下,观察到产物deuterio-3fa和起始物deuterio-1f的C2位置发生氘的插入,表明了烯醇化的可能性。此外,实验结果显示,反应中N-甲基基团也可能参与可逆的酰胺导向的C-H活化。接下来,作者对没有Ir配合物存在的情况进行了控制实验,结果表明在此情况下C2处不发生氘的插入,强调了Ir的关键作用。最后,作者进行了机理研究,提出了可能的反应机制。首先,N-H金属化产生I,然后通过路易斯酸作用触发烯醇化生成II。在此阶段,Ir中心可能会发生去质子化,产生活性物种。碳金属化然后通过π-配位激活烯烃,形成III。最终,IV经过质子去金属化释放产物。总之,图3揭示了酰胺基系统与苯乙烯之间的C-C键形成反应的关键步骤和可能机理,为该反应的深入理解和优化提供了重要线索。 图片来源:Nat. Chem. 总结
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn