

(图片来源:J. Am. Chem. Soc.)
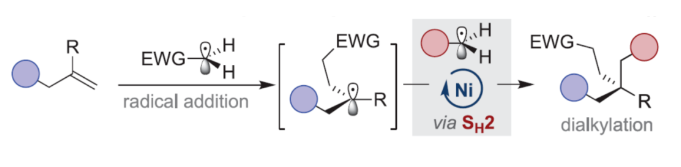
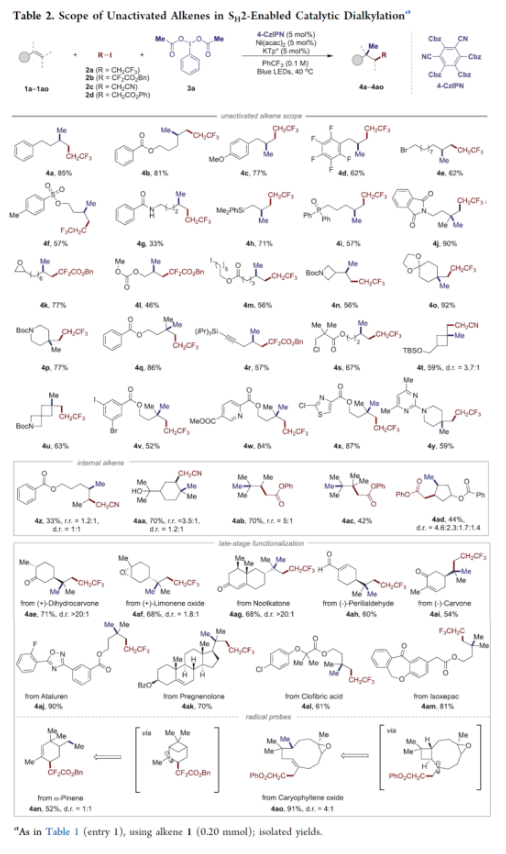
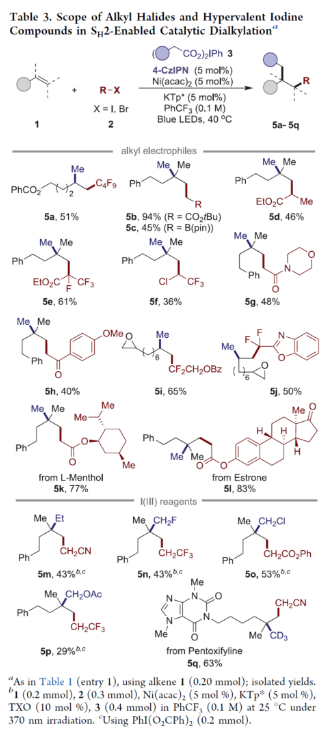
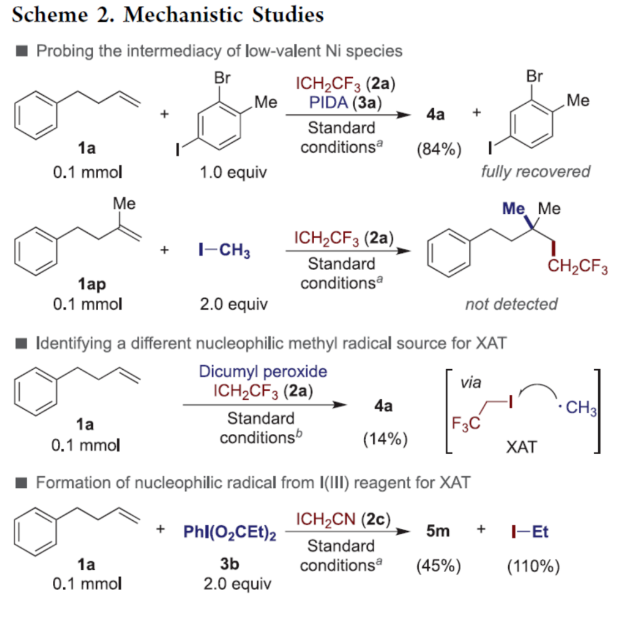
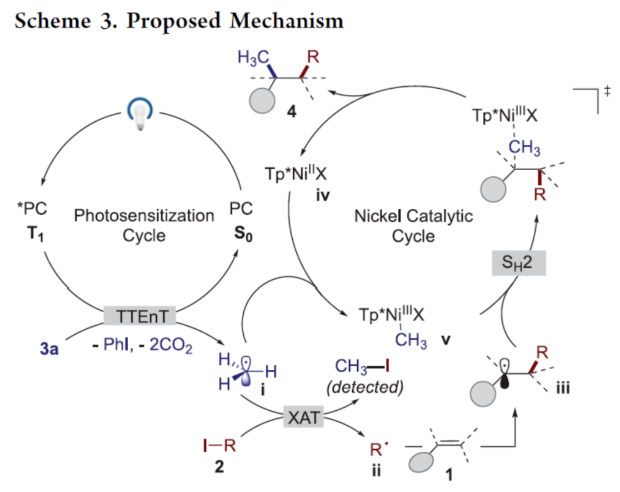
正文 近年来,过渡金属催化烯烃的1,2-双碳官能团化可通过位点选择性的方式实现双重C−C键的构建,引起了人们的极大关注。与活化的烯烃相比,非活化的烯烃参与的相关转化更具挑战性,如反应性低、区域选择性低以及存在不希望的β-H消除等副反应(Scheme 1)。目前,对于镍催化非活化烯烃的1,2-双碳官能团化反应主要涉及双电子途径(I或II通过迁移插入)或单电子途径(III或IV通过自由基捕获/接力串联过程)。另一方面,通过基于自由基的机理进行的转化通常依赖于活化的C(sp3)-亲电试剂(如叔烷基)来生成稳定的自由基中间体,然后将其区域选择性地加成至C=C键上,并与有机镍配合物进行重组。近日,新加坡国立大学许民瑜(Ming Joo Koh)课题组开发了一种光氧化还原/镍双重催化体系,该方法能够通过烯烃与烷基卤化物和高价碘基试剂的三分子交叉偶联反应,合成了一系列二烷基化产物。下载化学加APP到你手机,收获更多商业合作机会。 (图片来源:J. Am. Chem. Soc.) 首先,作者以非活化的烯烃1a、碘代烷烃2a(亲电自由基源)与(二乙酰氧基碘)苯3a(亲核自由基源)作为模型底物,进行了相关三组分偶联反应条件的筛选(Table 1)。当以Ni(acac)2(5 mol %)作为金属催化剂,4-CzIPN(5 mol %)作为光催化剂,KTp*(5 mol %)作为配体,456 nm蓝光LED作为光源,在PhCF3溶剂中40 oC反应,可以85%的分离收率得到二烷基化产物4a,r.r. > 20:1。 (图片来源:J. Am. Chem. Soc.) 在获得上述最佳反应条件后,作者对烯烃底物范围进行了扩展(Table 2)。首先,一系列不同取代的末端烯烃,均可与3a和亲电烷基碘化物2a−2d顺利反应,获得相应的产物4a-4y,收率为33-92%,r.r. > 20:1。值得注意的是,一系列活性的基团,如烷氧羰基、卤素、酰胺、硅基、环氧化物、炔基等,均与体系兼容。其次,一系列环状和非环状的1,2-二取代(4z,4ad)、三取代(4aa,4ab),甚至四取代(4ac)的内烯烃,也能够顺利进行二烷基化反应,尽管在某些情况下区域和非对映化学控制是困难的。此外,该策略还可用于一些生物活性分子的后期衍生化,获得相应的产物4ae-4am,收率为54-90%。其中,空间位阻较小的C=C键优先选择性地进行反应,如4ag-4ai和4ak。值得注意的是,当在具有相邻张力四元环(如天然产物α-蒎烯和石竹素)的烯烃上进行二烷基化时,可获得开环产物4an(收率为52%)和4ao(收率为91%)。 (图片来源:J. Am. Chem. Soc.) 紧接着,作者对烷基卤化物与高价碘化物的底物范围进行了考察(Table 3)。首先,一系列不同取代的烷基卤化物,均可顺利进行反应,获得相应的产物5a-5l,收率为40-94%。值得注意的是,一系列活性基团如烷氧羰基、卤素、酰胺、羰基、硼酸酯等,均与体系兼容。其次,一系列具有不同取代基的碘(III)化合物,如乙基、氟甲基、氯甲基、乙酰氧基甲基和三氘甲基,均能够顺利进行反应,获得相应的产物5m-5q,收率为29-63%。然而,含有长链1°烷基或2°烷基取代的碘(III)试剂,反应效率较低。 (图片来源:J. Am. Chem. Soc.) 此外,作者还对反应机理进行了进一步的研究(Scheme 2)。首先,当使用一当量的外源卤代芳烃下进行反应,反应效率不受影响,并且卤代芳烃可完全回收,从而表明反应不涉及低价有机镍(Ni(0)或Ni(I))配合物的参与,由于其倾向于促进氧化插入到C(sp2)−卤键中。类似的,使用甲基碘代替高价碘试剂3a,在标准条件下不能诱导任何二烷基化,进一步表明第二个C(sp3)-C(sp3)键不是由与甲基碘的反应产生的。其次,作者推测,亲核1°烷基自由基(衍生自3)负责通过化学选择性卤原子转移(XAT)过程引发卤代烷烃2形成亲电烷基自由基,该过程有利于匹配焓和极性效应。在这种情况下,将3转换到另一个亲核自由基源也会促进所需的烷基化。过氧化二异丙苯的反应支持了这一假设,已知过氧化二丙苯在光解后会产生甲基自由基。事实上,在标准条件下,以14%的收率检测到预期的产物4a。通过1a、2c和3b的偶联对照实验以45%的收率得到所需的产物5m以及乙基碘化物副产物,进一步证实了XAT的假设。 (图片来源:J. Am. Chem. Soc.) 基于上述的研究以及相关文献的查阅,作者提出了一种合理的催化循环过程(Scheme 3)。首先,蓝色LED照射光催化剂(4-CzIPN)形成高能三重态,通过三重态-三重态能量转移(TTenT)过程可将能量转移到碘(III)化合物(如3a)上,导致I−O键均裂,产生羧基自由基,其经快速的断裂后释放甲基自由基i、PhI和CO2。其次,甲基自由基i被原位生成的Ni(II)配合物iv选择性捕获,生成Ni(III)配合物v。同时,另一当量的甲基自由基与缺电子的烷基碘2进行化学选择性XAT,生成亲电烷基自由基ii和Me−I副产物。随后,自由基ii与1中非活化C=C键进行区域选择性加成,生成空间位阻更大的烷基自由基iii,这有利于SH2与v偶联以生成二烷基化产物4并完成催化循环。 (图片来源:J. Am. Chem. Soc.) 总结

声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn