- 首页
- 资讯
哈佛大学JACS:“钾”催化的不对称Wittig反应合成轴手性烯烃
来源:化学加原创 2024-03-11
导读:近日,美国哈佛大学(Harvard University)Eric N. Jacobsen课题组报道了钾-异硫脲-硼酸酯催化,4-取代环己酮与非稳态磷叶立德的不对称Wittig烯基化反应,合成了一系列高度对映体富集的轴手性烯烃。反应中使用的催化剂是一种罕见的大环酰胺-钾-硼酸酯螯合物。动力学实验和光谱分析均表明此催化烯基化反应经历Lewis酸机理,从而在低温条件下形成氧膦烷(oxaphosphetane)加合物。随后,氧膦烷通过热裂解生成烯烃产物。计算研究表明,环加成是通过一个逐步机理进行的,其中包括决定对映选择性的极性1,2-加成,从而获得中间体甜菜碱钾络合物。相关成果发表在J. Am. Chem. Soc.上,文章链接DOI:10.1021/jacs.4c00564。
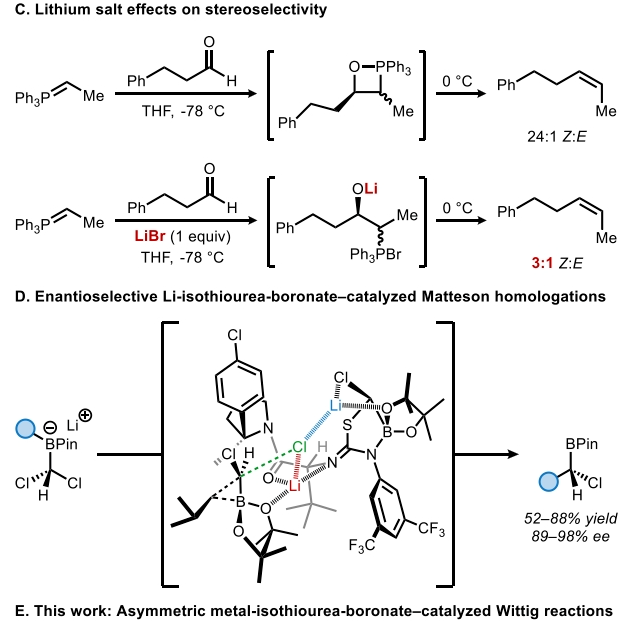
 自Wittig反应首次报道以来,其广泛应用于烯烃的立体选择性合成。利用取代的前手性酮的烯基化可以形成轴手性烯烃产物,一系列通过使用化学计量手性控制因素(共价手性助剂或手性配体)来实现不对称Wittig和Horner-Wadsworth-Emmons反应的方法得到了广泛发展。相反,通过不对称催化来实现Wittig型烯基化并得到轴手性产物的例子却非常罕见。到目前为止,仅有三例报道通过使用Brønsted酸、氢键供体或相转移催化剂以最高75%的ee得到产物。最近,美国哈佛大学Eric N. Jacobsen课题组报道了钾-异硫脲-硼酸酯催化4-取代环己酮与非稳定的磷叶立德的不对称Wittig烯基化反应,合成了一系列高度对映体富集的轴手性烯烃。这一策略的关键是非稳态叶立德所衍生的OPAs(oxaphosphetane)在低温下的稳定性,因为裂解成烯烃的Lewis碱性氧膦副产物很可能是一种强效的催化剂毒化试剂(Scheme 1)。下载化学加APP到你手机,收获更多商业合作机会。
自Wittig反应首次报道以来,其广泛应用于烯烃的立体选择性合成。利用取代的前手性酮的烯基化可以形成轴手性烯烃产物,一系列通过使用化学计量手性控制因素(共价手性助剂或手性配体)来实现不对称Wittig和Horner-Wadsworth-Emmons反应的方法得到了广泛发展。相反,通过不对称催化来实现Wittig型烯基化并得到轴手性产物的例子却非常罕见。到目前为止,仅有三例报道通过使用Brønsted酸、氢键供体或相转移催化剂以最高75%的ee得到产物。最近,美国哈佛大学Eric N. Jacobsen课题组报道了钾-异硫脲-硼酸酯催化4-取代环己酮与非稳定的磷叶立德的不对称Wittig烯基化反应,合成了一系列高度对映体富集的轴手性烯烃。这一策略的关键是非稳态叶立德所衍生的OPAs(oxaphosphetane)在低温下的稳定性,因为裂解成烯烃的Lewis碱性氧膦副产物很可能是一种强效的催化剂毒化试剂(Scheme 1)。下载化学加APP到你手机,收获更多商业合作机会。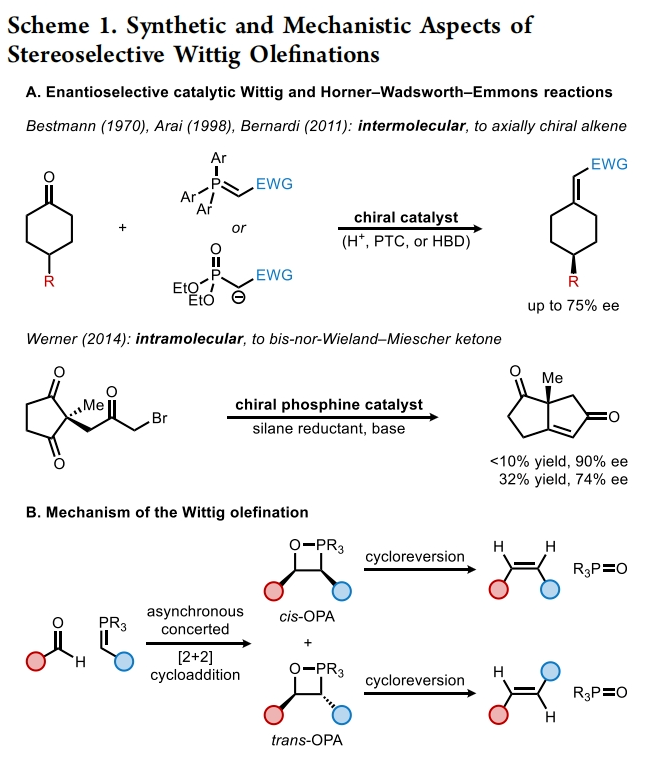
(图片来源:J. Am. Chem. Soc.)
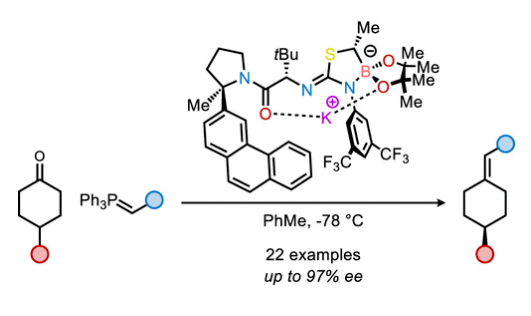
首先,作者使用4-苯基环己酮1a和磷叶立德2a作为模板底物对反应条件进行了优化(Table 1)。当使用1a (1.0 equiv), 2a (1.5 equiv), K-3f (10 mol%),在甲苯中-78 °C反应24 小时之后室温反应20分钟,可以以73%的产率,92% ee得到相应的烯烃产物5a。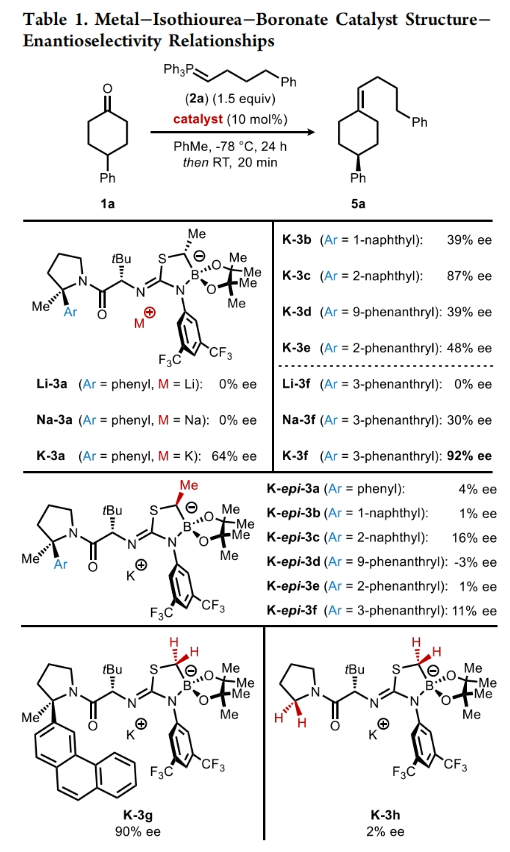
(图片来源:J. Am. Chem. Soc.)
随后,作者试图阐明配体效应和钾催化剂在此转化中的优越性能。K-3f·THF的X-射线晶体结构分析得出此络合物为一种不寻常的大环螯合物,其中钾离子在酰胺的氧和硼酸酯的氧之间配位(Figure 1A)。这种连接模式与之前在锂-异硫脲-硼酸酯衍生物的X-射线结构中所观察到的五元酰胺-锂-异硫脲螯合物有很大的不同。为了评估这些固态结构的差异以及与相应溶液态结构的相关性,作者测试了M-3f (M = Li, Na, K)的溶液红外光谱,并将其与DFT预测的两种螯合物的光谱进行了比较(Figure 1B)。未金属化的异硫脲-硼酸酯3f (M = H)显示出与酰胺C−O (1660 cm−1)和异硫脲N−C−N (1590 cm−1)相对应的吸光度,这些吸光度在计算光谱中得到了很好的再现。此外,K-3f和Na-3f的红外光谱在羰基区域显示出相似的模式,C−O拉伸的红移大约为40 cm−1,而N−C−N拉伸的红移相对于3f的光谱呈扁平状。这些光谱变化与预测的酰胺-金属-硼酸酯螯合物的红外光谱相一致。相比之下,Li-3f的红外光谱显示两个峰的红移大约为40 cm−1,与计算的酰胺-金属-异硫脲螯合物相一致。这些螯合模式的基本差异可以转化为相对Lewis酸性的差异,如Gutmann-Beckett分析所示(Figure 1C)。分解结果得出K-3f相对于KHMDS和Na-3f相对于NaHMDS的Lewis酸性略有不同,而Li-3f相对于LiHMDS的Lewis酸性显著增加。在由3f衍生的异硫脲-硼酸酯阴离子的静电电位图中(Figure 1D),硼酸酯的氧原子处出现了较高的电子密度,这与在提出的两种酰胺-金属-硼酸酯螯合物中所观察到的Lewis酸性的缓冲相一致。使用K-epi-3a−f催化剂的低对映选择性(Table 1)可归因于顺式 α-硼甲基的立体效应,这可能会干扰酰胺-K-硼酸酯螯合物的形成(Figure 1E)。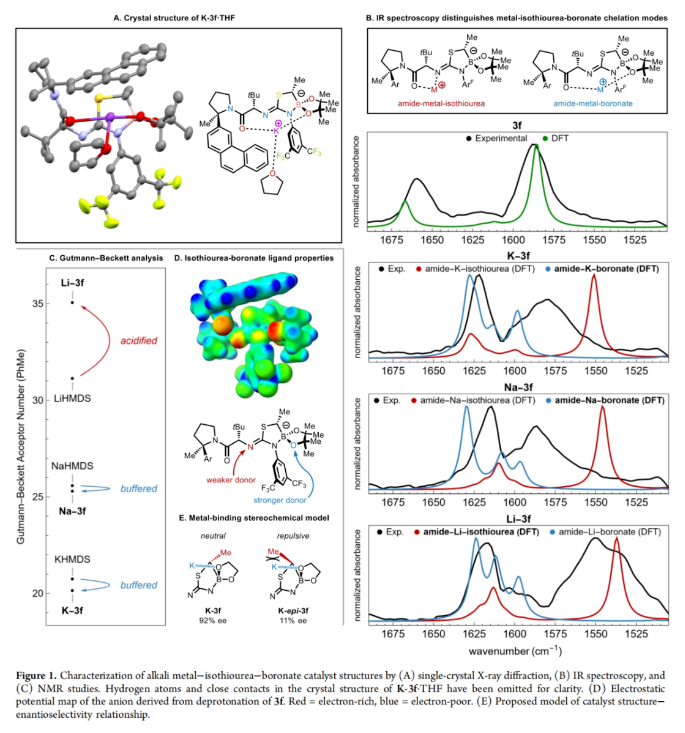
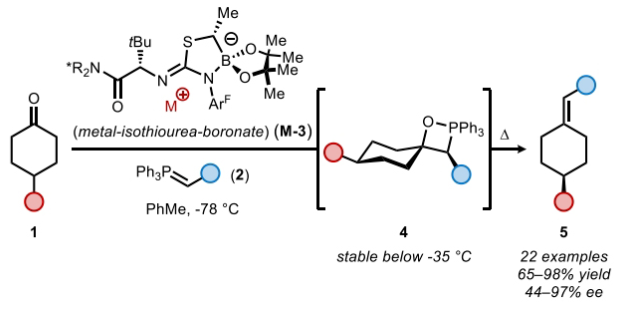
在得到了最优反应条件后,作者对此转化的底物范围进行了探索。实验结果表明一系列不同取代的环己酮1和磷叶立德2均具有良好的兼容性,以65-98%的产率,44-97% ee得到相应的烯烃产物5a-5o(Figure 2)。其中包括苯基、氰基、甲氧基、三氟甲基、氟原子、叔丁基、异丙基等一系列基团在反应中均具有良好的耐受性。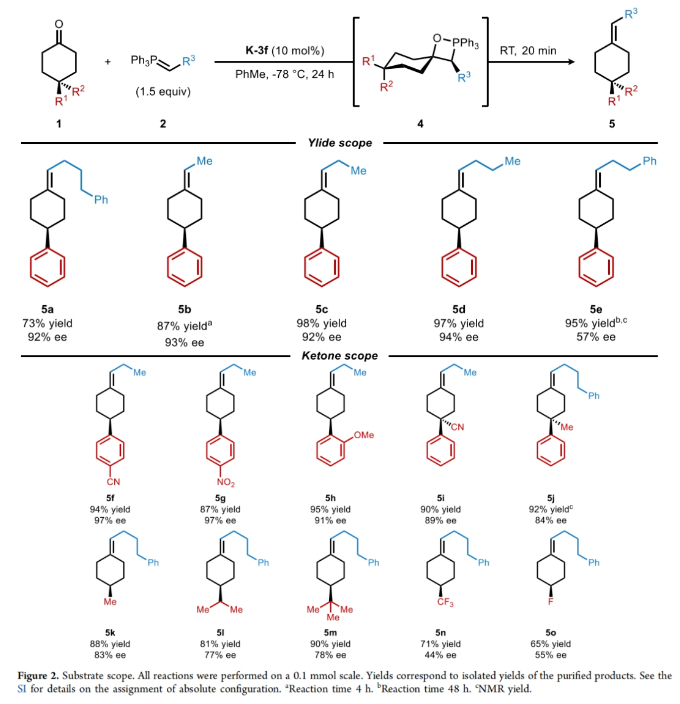
(图片来源:J. Am. Chem. Soc.)
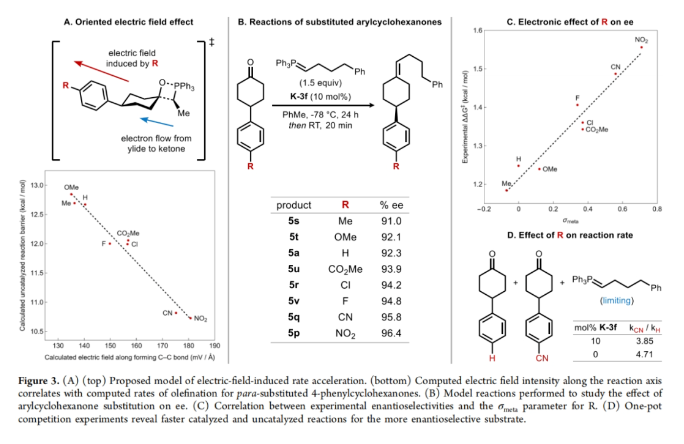
接下来,作者探索了电子效应对ee的影响(Figure 3)。一系列不同取代的4-芳基环己酮参与的非催化烯基化反应中活化自由能与形成C-C键的电场强度有很好的对应关系(Figure 3A)。此外,作者对一组不同取代的4-芳基环己酮的k-3f催化烯化反应进行研究,当底物含有缺电子芳环时,对映选择性更高(Figure 3B)。随后,作者将ΔΔG⧧与几个不同的标准参数进行了对比,发现与σmeta的相关性最好(Figure 3C)。此外,吸电子基对反应速率也有显著影响,在催化和非催化的烯基化反应中,对位的吸电子取代基都能加快反应速度(Figure 3D)。最后,作者利用紫外-可见光谱对酮1a的烯基化过程进行了完整的动力学分析,并监测到了在520 nm处橙红色的叶立德 2d的消失。此外,催化剂浓度的变化显示出一级动力学效应,结合其不存在非线性效应,这与整个催化循环中存在单体催化剂物种一致(Figure 4A-4D)。基于上述实验结果,作者提出了可能的反应机理(Figure 4E):催化剂K-3f可逆与酮1a结合形成络合物A,随后进行与叶立德2d的不可逆加成形成甜菜碱络合物B。该络合物可以可逆的解离OPA产物4d并得到游离的K-3f。此外,DFT计算得出过渡状态几何形状主要由两个因素决定(Figure 4G):1)环己酮加成的面选择性和;2)三苯基膦部分与催化剂骨架之间的空间相互作用最小化,这决定了叶立德取代基的方向。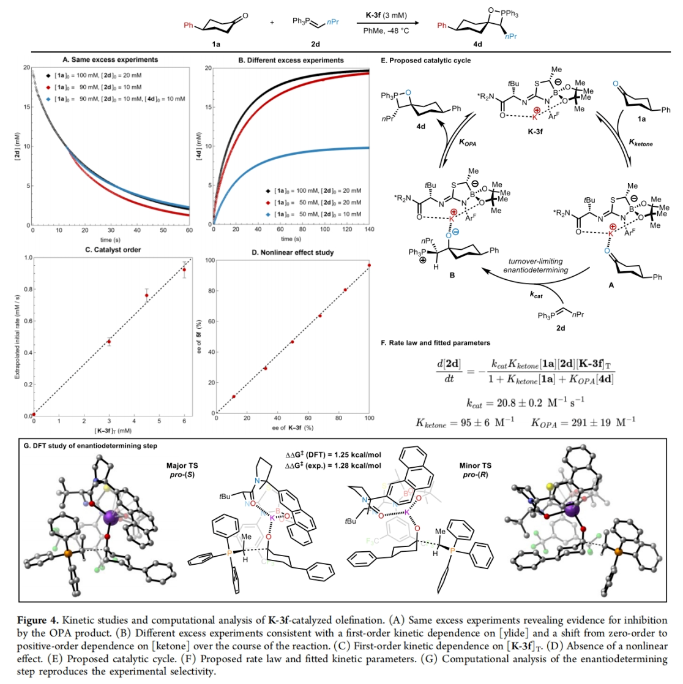
(图片来源:J. Am. Chem. Soc.)
Eric N. Jacobsen课题组利用具有新型大环螯合结构的手性Lewis酸钾-异硫脲-硼酸酯络合物催化,实现了4-取代环己酮的高对映选择性Wittig烯基化反应。决定对映选择性的环加成过程包含不可逆的极性1,2-加成形成甜菜碱钾络合物,随后进行可逆环化的分步过程。此反应的发展为催化不对称Wittig烯基化的发展提供了新的途径。文献详情:
Jake Z. Essman, Eric N. Jacobsen*. Enantioselective Potassium-Catalyzed Wittig Olefinations. J. Am. Chem. Soc., 2024, https://doi.org/10.1021/jacs.4c00564.
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn