

(图片来源:Science)
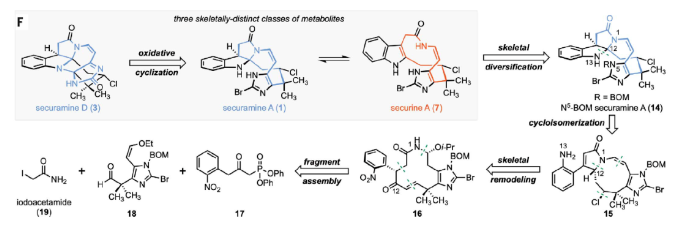
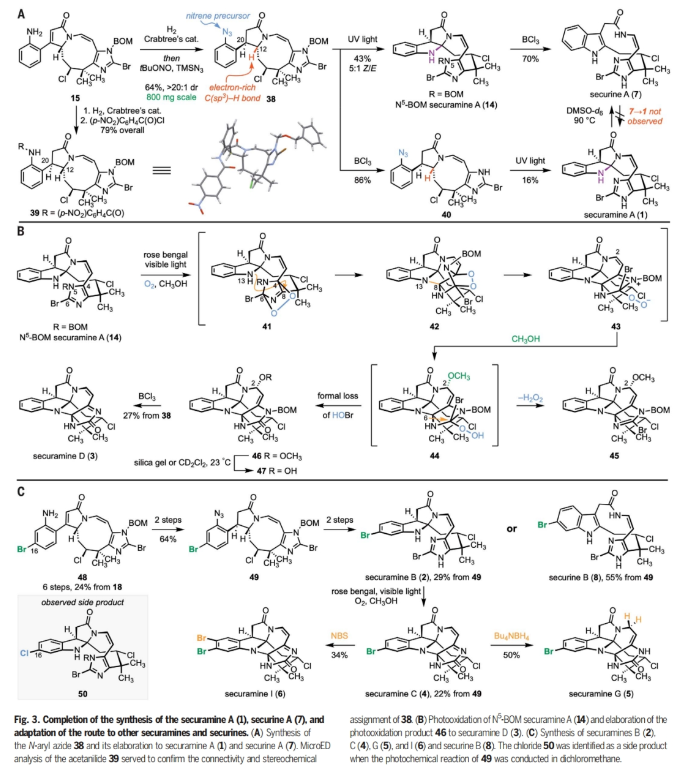
正文 Bryozoa是结构多样的卤化次生代谢物的丰富来源。1996年,Christophersen课题组报道了对bryozoan Securiflustra securifrons提取物中securamines A(1)和B(2)的结构表征(Fig. 1A)。随后,化学家们发现了具有细胞毒性的六环bis(aminal)分离物securamines D(3)和C(4),以及在C2-C3键上氧化态不同的相关分离物[如securamine G(5)]或吲哚啉上的卤化产物[如securamine I(6)]。尽管它们的结构相对较小,但这些生物碱的化学合成具有很大的挑战,包括不稳定的顺式烯酰胺、新戊基仲烷基氯、碱性卤代咪唑和卤代吲哚啉等。最近,美国耶鲁大学Seth B. Herzon课题组发展了一个灵活的反应途径反别实现了securines和securamines的三类骨架的八个分离物的合成(Fig. 1)。下载化学加APP到你手机,收获更多商业合作机会。 首先,作者利用Weinreb课题组合成chartelline C(9)时的方法来合成醛18 (Fig. 2A)。利用商业可得的4-乙腈基咪唑20与NaH和BOMCl (benzyl chloromethyl ether)反应可以以80%的产率得到N1-BOM异构体21(800 mg规模)。此外,当将此反应放大至10 g规模时仍可以以60%的产率得到21。随后,21在KOtBu和CH3I存在下发生甲基化,以94%的产率得到α-季碳腈22(6.5 g 规模)。22通过与BnN(CH3)3Br3的位点选择性溴化以69%的产率得到C5-溴咪唑23(2.0 g 规模)。23与烯基锡试剂24通过钯催化的Stille偶联以92%的产率,以单一的顺式非对映体得到烯醇醚产物25(3.9 g 规模)。25通过去质子化和CBr4溴化得到C2-溴咪唑,其可以通过Schwartz’s试剂对腈还原以87%的产率得到醛18。 利用2-碘苯腈,通过三步可以以51%产率实现β-酮磷酸酯17的合成。而17和18可以通过Masamune-Roush烯基化实现偶联,以91%的产率,单一的(E)-非对映异构体得到相应的α,β-不饱和酮26(3.0 g 规模)。α,β-不饱和酮26通过烯醇醚的水解以及与碘乙酰胺19加成可以以两步87%的产率得到消旋的大环前体27(3.1 g 规模)。27经历碱介导的环化得到大环内酰胺28(19:1 dr),并通过NOE效应分析结合分子动力学模拟,确定了C2和C20中心的相对构型。 在涉及重构12元大环内环酰胺28中几乎所有官能团的关键转化过程中,作者发现28在23 oC无水盐酸-二氧六环溶液(4.0 M)中溶解,以单一的非对映体得到氯化的1-氮杂双环[7.3.0]十二-2,10-二烯29。当该反应在0 oC的甲苯和二氧六环的混合溶液中反应时,反应速率降低,并且可以用LC-MS鉴定转化中涉及的中间体(Fig. 2B)。这些研究表明,异丙氧基的初始取代得到30。30通过烯酮的氢-氯化(30→31)以及随后的消除(31→32)得到烯胺,其可以经历缩环得到β,γ-不饱和-γ-内酰胺33。33经历互变异构得到羟基吡咯34,并通过C12质子化得到观察到的产物29。基于现有数据,也不能排除经历35的反应过程。 在其它可还原官能团存在的情况下,硝基芳烃29通过与四羟基二硼和4,4'-联吡啶的选择性还原得到复杂的内酰胺产物15。由于很难获得分析纯的中间体28和29,作者在规模化制备实验中并没有对其进行提纯。经1H NMR分析,从27经历三步可以以49%的产率得到内酰胺15(> 20:1 dr,2.6 g规模)。其中包括1)碱介导的环化;2)氢氯化、烯胺形成、扩环、互变异构/芳构化、质子化(Fig. 2B);3)硝基的选择性还原。接下来,芳胺15与TBSOTf和2,6-lutidine反应得到硅醚吡咯36,其与四氯化锡在-78 oC反应得到β,γ-不饱和-γ-内酰胺37, 15和12-epi-15(3:2:1)。遗憾的是,作者尝试使用Lewis酸或Brønsted酸来诱导37的环化时均仅得到15,表明15是热力学稳定的立体异构体(Fig. 2C)。 接下来,由N-芳基叠氮化物的最新光化学进展和N-芳基乃春插入脂肪族C-H键中获得启发,作者设想通过C-H胺化来构建N13-C12键,从而获得顺式吡咯吲哚啉骨架(Fig. 3A)。当15在Crabtree催化剂催化下进行氢化反应,并通过与4-硝基苯甲酰氯的酰基化可以以79%的产率得到39。尽管核磁分析结果可以证明反应经历了想要的立体选择性,但作者还是尝试利用X-射线单晶衍射进行验证。然而,由于该化合物为薄的微晶片状,因此不适合常规晶体学研究。于是作者通过微晶电子衍射(MicroED)证实了BOM醚在固态中填充了四个构象,这也解释了作者无法生长出单晶的原因。 15通过连续氢化以及与tBuONO和TMSN3反应可以以64%的产率得到叠氮化物38。其在紫外光照射下可以以43%的产率的得到N5-BOM securamine A (14)(5:1 Z/E)。随后在BCl3存在下脱除BOM并将吡咯吲哚啉开环为吲哚,可以以70%的产率得到securine A(17步,12次纯化,3%总产率),且天然的和合成的securine A在DMSO-d6中的核磁共振波谱数据一致。此外,当将叠氮化物38首先与BCl3反应可以以86%的产率得到NH咪唑40,其在紫外等照射下可以以16%的产率得到securamine A(17步,12次纯化,1.4%总产率)。将N5-BOM securamine A (14)在可见光引发下可以得到溴化物45和咪唑啉酮46。46可以经历水的取代以及随后的BCl3脱保护可以以27%的产率得到securamine D (3)(18步,12次纯化,2.7%总产率)(Fig. 3B)。 通过对β-酮膦酸酯17中的芳烃进行修饰,预计可获得更多的securamines(Fig. 3C)。作者首先利用醛18通过六步以24%的产率得到C16溴代苯胺48。其通过还原和叠氮转移可以以64%的产率得到叠氮产物49。49在利用BCl3脱苄氧基甲基醚后实现C-H胺化可以以29%的产率得到Securamine B (2)(17步,12次纯化,1.8%总产率)。此外,当先经历C-H胺化再经历脱保护可以以55%的产率得到securine B (8)(17步,12次纯化,3.5%总产率)。对Securamine B (2)进行直接的光氧化可以以22%的产率得到securamine C (4) (18步,12次纯化,1.4%总产率)。在securamine C (4)中加入Bu4NBH4可以以50%的产率得到securamine G (5)(19步,13次纯化,0.7%总产率)。此外,对securamine C (4)进行溴化可以以34%的产率得到securamine I (6)(19步,13次纯化,0.5%总产率)。 总结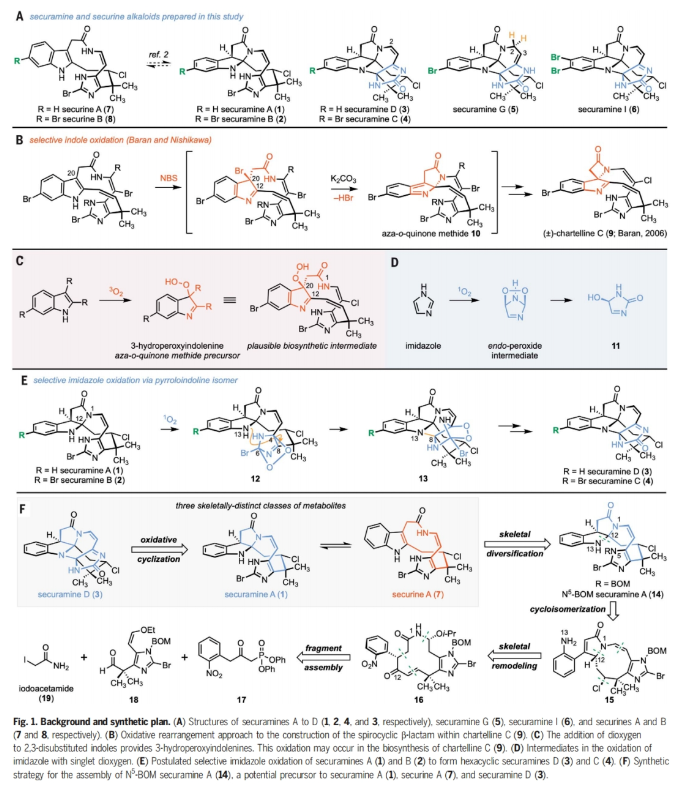

声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn