

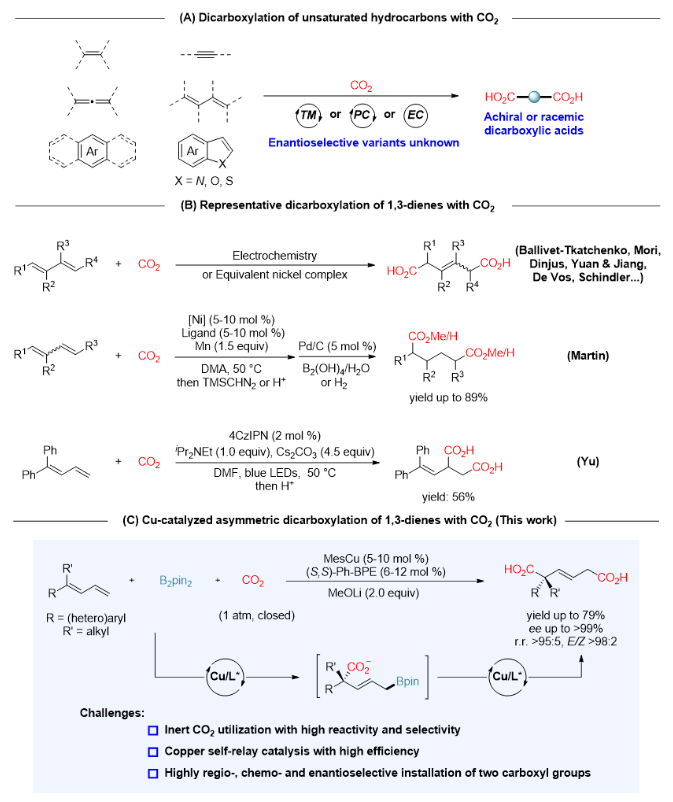
四川大学余达刚教授课题组长期致力于CO2的高效活化和选择性转化(综述:化学学报, 2019, 77, 783; Sci. China Chem. 2020, 63, 1336; Acc. Chem. Res. 2021, 54, 2518; Natl. Sci. Open 2023, 2, 20220024; Sci. Bull. 2023, 68, 3124. 代表性论文:Nat. Catal. 2021, 4, 304; Nat. Catal. 2022, 5, 832; Nature 2023, 615, 67; Nat. Catal. 2023, 6, 959; Nat. Synth. 2024, DOI: 10.1038/s44160-023-00465-6.),一直关注并努力解决CO2参与的不对称催化碳-碳成键这一重要难题。前期该课题组已经实现了铜催化CO2参与的芳基烯烃和1,3-丁二烯的不对称还原羟甲基化反应(J. Am. Chem. Soc. 2017, 139, 17011; J. Am. Chem. Soc. 2019, 141, 18825)以及烯烃的不对称芳基羧基化反应(Angew. Chem. Int. Ed. 2021, 60, 14068),取得了优异的化学、区域、E/Z和对映选择性,高效构建了具有手性(季碳)中心的高苄醇和高烯丙醇以及手性羧酸。在上述工作基础上,余达刚教授与四川师范大学贵永远博士考虑到手性己二酸的重要性和1,3-丁二烯的易得性,通过铜催化CO2参与的1,3-丁二烯硼羧基化反应产生羧基化烯丙基硼酸酯中间体,进而发生铜催化CO2参与的烯丙基C−B键羧化反应产生二羧酸盐,首次实现了铜催化CO2参与的1,3-丁二烯不对称双羧化反应,为手性己二酸的制备提供了一条简洁高效的路径(图1C)。
作者以1,3-丁二烯1a作为模板底物,以MesCu为催化剂,(S,S)-Ph-BPE作为配体,甲醇锂为碱,苯甲醚为溶剂,联硼酸频哪醇酯作为添加剂,一个大气压CO2氛围下,80 oC下反应36小时即能以72%收率及96% ee得到产物2a。在最优的反应条件下,作者对1,3-丁二烯的底物适用范围进行了考察。如图2所示,该反应具有广泛的底物适用范围,在苯环上有拉电子取代基(如三氟甲基(2d,2i)和三氟甲氧基(2e))或给电子取代基(如甲氧基(2j),甲基(2f)和甲基硫醚(2g))的1,3-丁二烯可以顺利反应,以中等到良好的产率(从52%到74%)和优异的对映选择性(高达98% ee)得到目标产物。由于反应条件温和,多种官能团都可以兼容,包括碳-卤(F,Cl,Br)键(2h,2k-2l),醚(2c,2e,2j),硅醚(2m),酯(2n)和羟基(2o)。此外,药物化学中常见的各种杂环芳烃,如呋喃(2w),咔唑(2x),吲哚(2y),吡咯(2z),噻吩嗪(2aa),苯并噻吩(2ab)和噻吩(2ac),并不影响反应。将甲基基团换成空间位阻更大的乙基(2ad)也以优异的对映选择性提供了相应的产物(93% ee)。具有刚性环状骨架的二烯(2ae-2ak)也产生了类似的结果(产率最高为79%,对映选择性为99% ee)。含有复杂或生物活性烷基片段(如薄荷醇(2al),D-葡萄糖呋喃醇(2am)和丙磺舒(2an))的1,3-丁二烯也可以中等至较好的产率和高对映选择性得到具有潜在价值的产物。值得注意的是,几乎所有反应都具有>95:5的区域选择性和>98:2的E/Z选择性。
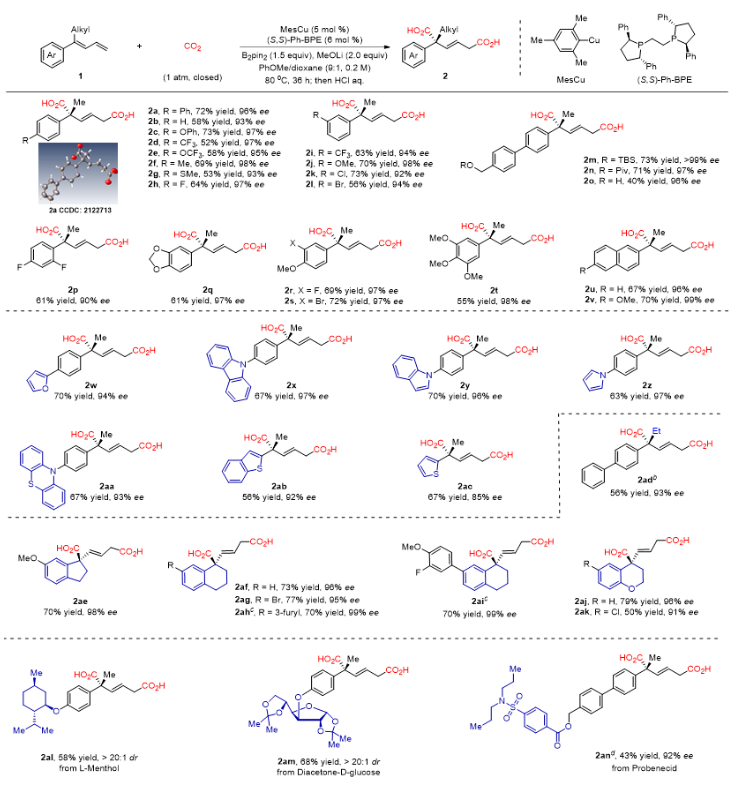
图2. 1,3-丁二烯类底物的拓展。
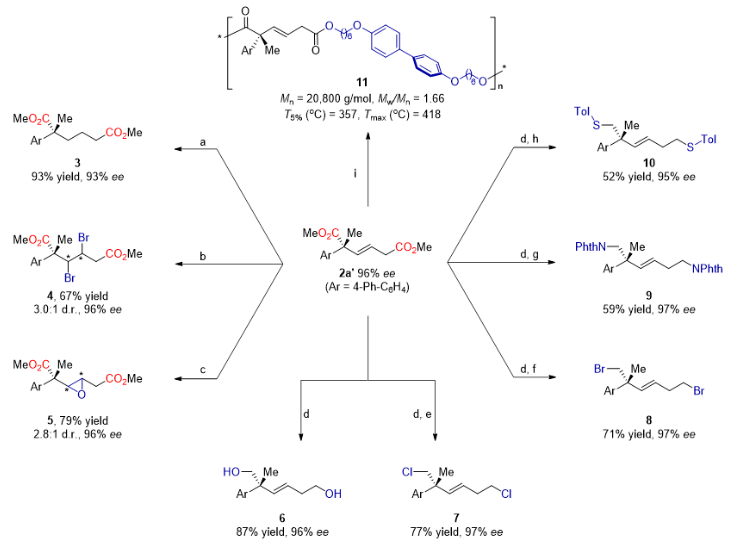
图3. 产物的衍生化。
为了进一步探索该反应的实用性,作者对手性二酸的酯化产物2a’进一步衍生化(图3)。例如,对双键进行氢化反应可得手性己二酸酯3;双键二溴化反应或环氧化反应可得具有连续手性中心的产物4或5;对2a'进行还原反应可得高度取代的不饱和手性1,6-己二醇6,该中间体可通过亲核取代反应进行后续双重C−Cl(7)、C−Br(8)、C−N(9)和C−S(10)成键反应。此外,通过2a'与4,4'-双(6-羟基己氧基)联苯聚合反应合成聚合物11,该聚合物具有潜在的热致液晶聚酯性能,其分解温度高达357°C。
图片来源:J. Am. Chem. Soc.
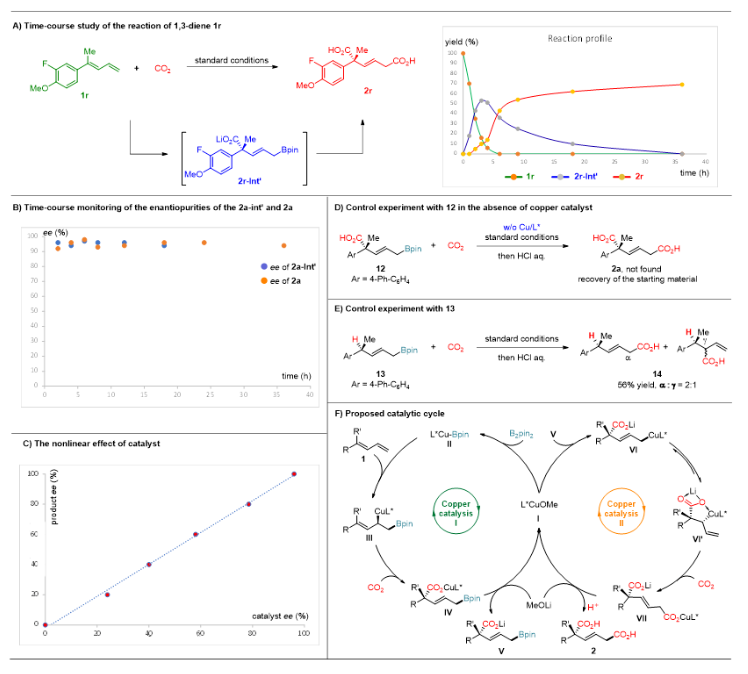
为了更深入地了解反应,作者在标准条件下对底物1r的反应进行了监测(图4A)。在最初的3小时内观察到1r(绿线)迅速转化为硼羧化中间体2r-Int’(蓝线);随后,2r-Int’的浓度逐渐随时间减少,随着双羧化反应的进行,逐渐生成二酸产物2r(红线),从而证明硼羧化产物是反应的中间体。此外,中间体2a-Int’和产物2a在不同时间间隔内观察到的ee值保持几乎恒定(图4B),而且产物的ee值与相应配体之间呈线性关系,表明在对映决定性过渡态中涉及到单一手性配体的参与(图4C)。对照实验表明,烯丙基硼酸酯12在不加铜催化剂时完全没有转化,表明铜催化剂在CO2参与烯丙基硼酸酯的羧化反应中起到重要作用(图4D)。当利用没有羧酸官能团的烯丙基硼酸酯13在标准条件下参与反应时,只能得到较差的区域选择性,表明羧酸基团在导向第二步羧化反应中起了重要作用(图4E)。综合上述控制实验结果和文献报道,作者提出了可能的机理假设(图4F)。首先,活性Cu催化剂(I)和B2pin2反应生成铜-硼物种II。随后,1,3-丁二烯1中的末端双键与铜-硼物种II发生高区域选择性和立体选择性的1,2-加成,生成硼取代的烯丙基铜中间体III。由于烯丙基铜中间体III的高亲核性,与CO2反应生成硼羧化中间体IV。随后,IV与碱发生配体交换反应,再生Cu催化剂I,并生成羧酸化的烯丙基硼酸酯V。然后,V与Cu催化剂I发生转金属化,生成烯丙基铜中间体VI或VI'。由于羧酸根可能与铜配位,形成更稳定的五元金属环中间体VI',因此在末端位置与CO2反应,高选择地生成1,4-取代的二羧酸盐VII。最后,用酸淬灭反应就可以得到目标二酸化合物2。
综上所述,作者报道了首例铜催化CO2参与的1,3-丁二烯不对称双羧化反应,以优异的化学、区域、E/Z和对映选择性获得了含有全碳季碳立体中心的手性二酸。该方法具有反应条件温和、底物范围广、官能团兼容性好以及产物易衍生等特点。该双羧化反应成功的关键在于手性铜催化剂的接力催化,也就是铜催化的1,3-丁二烯的硼羧化以及随后的铜催化C−B键羧基化。机理研究还表明,首次引入的羧酸基团可能作为导向基团来控制第二次羧化的区域选择性。
相关工作近期发表于J. Am. Chem. Soc. (https://pubs.acs.org/doi/epdf/10.1021/jacs.3c14146)。上述研究工作得到了国家自然科学基金委、四川师范大学、四川大学和南开大学元素有机国家重点实验室的大力支持。本工作的通讯作者是贵永远博士和余达刚教授,四川师范大学贵永远博士和四川大学2023届博士陈小旺为共同第一作者。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn