

(图片来源:J. Am. Chem. Soc.)
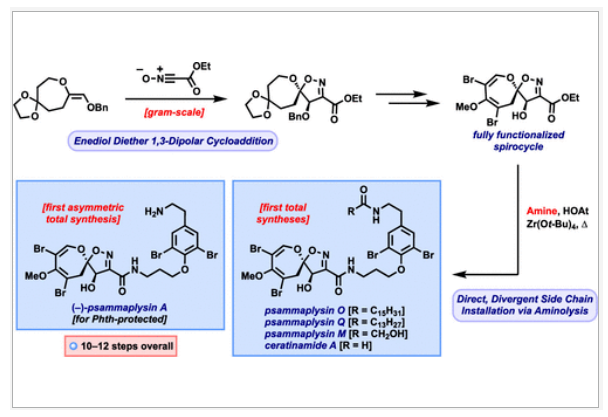
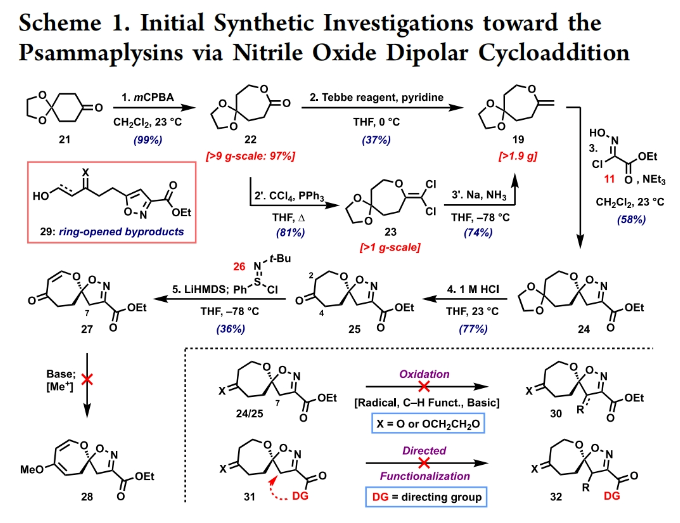
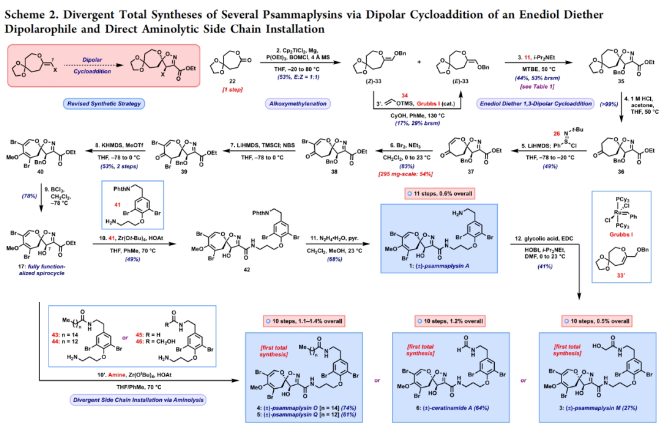
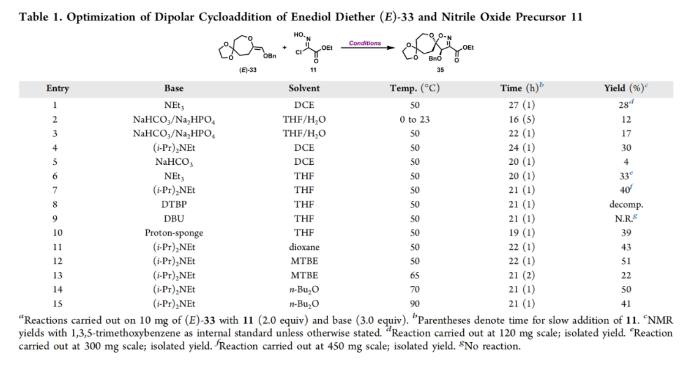
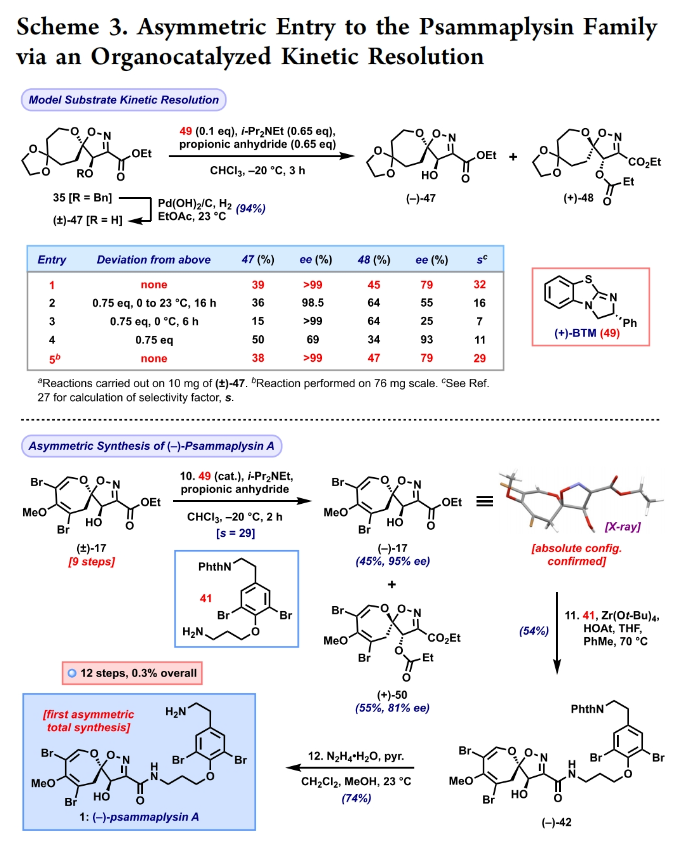
正文 溴酪氨酸衍生的螺异噁唑啉生物碱是一类独特的海洋天然产物。在这类海洋天然产物的大约300个成员中,psammaplysins构成了一个重要的亚家族,目前已从各种海洋海绵中分离出超过35种化合物。在结构上,它们的特点是螺异噁唑啉-呃二嗪单元通过一个酰胺键连接到一个可变的溴嘧胺片段上,从而产生许多同源物(1-6, Figure 1A)。这些化合物显示出潜在的抗病毒、抗癌、抗菌和抗疟疾等活性。尽管psammaplysin已被发现了40多年,但直到2022年才实现了一些psammaplysin分子的全合成。在此工作的研究过程中,Magauer小组首次通过13步合成了外消旋的psammaplysin A (1)(Figure 1B)。最近,美国德克萨斯大学西南医学中心Myles W. Smith课题组实现了psammaplysins的代表性家族成员psammaplysins A的合成及psammaplysins M, O, Q和ceratinamide A的首次全合成(Figure 1C)。下载化学加APP到你手机,更加方便,更多收获。 首先,作者利用商业可得的酮21通过Baeyer-Villiger氧化以99%的产率,实现已知内酯22的多克规模合成(Scheme 1)。使用Tebbe试剂可以以37%的产率将22转化为exo环烯醇醚19。考虑到Tebbe试剂的成本以及与原位生成方案不兼容等问题,作者发展了一个两步合成策略,可以实现19的大规模制备。这包括使用PPh3/CCl4将初始的内酯进行偕二氯甲烯基化得到23,随后23在Birch条件下脱氯(2步产率超过60%)。接下来,19通过与腈氧化物(利用氯肟11生成)的[3 + 2]环加成以58%的产率得到关键的螺环24。 接下来,作者希望通过区域选择性去饱和来实现七元环的官能团化。在标准酸性条件下脱缩酮保护得到了酮25。将25与LiHMDS进行区域选择性烯醇化反应形成烯醇酯,该烯醇酯可与Mukaiyama试剂26反应,以36%的产率得到27。然而,在这些条件下作者并未观察到区域异构体烯酮。作者认为立体差异可能是由于C-2位选择性α-去质子化的原因。意外的是,作者尝试将烯酮27进行O-甲基化反应时发生异噁唑啉环在α-氨基C-7位置优先去质子化而开环。为了利用这一观察结果,作者瞄准了优先对C-7进行氧化。不幸的是,在24或25中氧化螺异噁唑啉骨架是具有一定挑战性的。此外,作者尝试去质子化形成氮杂烯醇酯以及与一系列氧化剂/亲电试剂捕获并不能得到C-7官能团化产物。包括自由基或过渡金属介导的官能团化,以及基于导向基团的策略(31→32)均不成功。即使在低温条件下(-78 oC及以下),作者也仅得到开环产物(例如29),这代表了oxepane环固有的张力和芳构化成异噁唑的驱动力。 (图片来源:J. Am. Chem. Soc.) 因此,作者调整了方法,通过与在C-7位含有烷氧取代基的偶极试剂进行[3 + 2]环加成,随后该基团可以转化为所需的羟基(Scheme 2)。首先,作者利用22,通过Takeda课题组所发展的Ti催化策略,以53%的产率得到苄氧基取代的烯醇醚33(1:1 E/Z)。该反应可规模化合成,并且几何异构体(E)-33和(Z)-33可以通过仔细的柱层析分离。通过对和氯肟11的反应条件进行筛选后,作者在优化的条件下[i-Pr2NEt,甲基叔丁基醚(MTBE), 50 oC],以44%的产率,单一的异构体得到关键的苄氧基取代螺异噁唑啉35(Table 1)。考虑到此环加成过程的立体特异性,(Z)-33不能用于合成psammaplysins。最终,作者利用Grubbs I催化剂(5 mol%)、(乙烯氧基)三甲基硅烷(34)和环己醇所形成的Ru-H络合物介导,在温和条件下实现了(Z)-33的部分异构化。此条件提供了(E)-33/(Z)-33的1:2.5混合物,以及大量的endo环烯醇醚33’(40%),其中(E)-33可以以17%的收率(基于回收起始原料的产率为29%)分离出来,从而提供了从不需要的(Z)-33中获得额外(E)-33的方法。在合成过程中,作者在酸性条件下对螺环35进行脱缩酮保护,以接近定量的产率得到酮36,其可以像以前一样通过烯醇化和氧化剂26处理(49%,2步)选择性地去饱和得到内酯37。37通过Br2/NEt3处理,以83%的产率得到烯基溴38,其经历随后的一锅烯醇硅醚形成和溴化得到二溴化产物39。由于39对色谱纯化不稳定,因此使用Magauer条件(KHMDS/MeOTf)实现O-甲基化后,可以以两步53%的产率得到40。将40在BCl3作用下,-78 oC反应可以化学选择性的移除苄基以78%的产率得到醇17。 在得到了螺环17后,作者探索了其与一系列伯胺的偶联,以完成几种psammaplysins的合成。首先,作者根据已知文献制备了胺41,其在Zr(t-OBu)4/HOAt介导的条件下与17发生胺解,以49%的产率得到Phth保护的psammaplysin A 42,其可以通过水合肼脱保护以68%的产率得到psammaplysin A。至此,作者利用商业可得的11,通过11步实现了1的合成。而psammaplysin A可以通过与乙醇酸缩合(EDC, HOBt),以41%的产率得到psammaplysin M 3。此外,酯17还可以通过与胺46发生胺解,以27%的总产率得到psammaplysin M。类似的,psammaplysins O(4)和Q(5)以及ceratinamide A(6)也可以通过与胺43-45的氨解产生(61-74%)。 (图片来源:J. Am. Chem. Soc.) 最后,为了实现psammaplysin A的对映选择性合成,作者探索了腈氧化物的不对称环加成反应(Scheme 3)。通过对二级醇17进行动力学拆分,作者可以以得到(−)-17。其可以通过相同的氨解(54%)和脱保护(74%)过程得到相应的(−)-psammaplysin (1)([α]26D = −35; lit.: [α]22D = −58)。 总结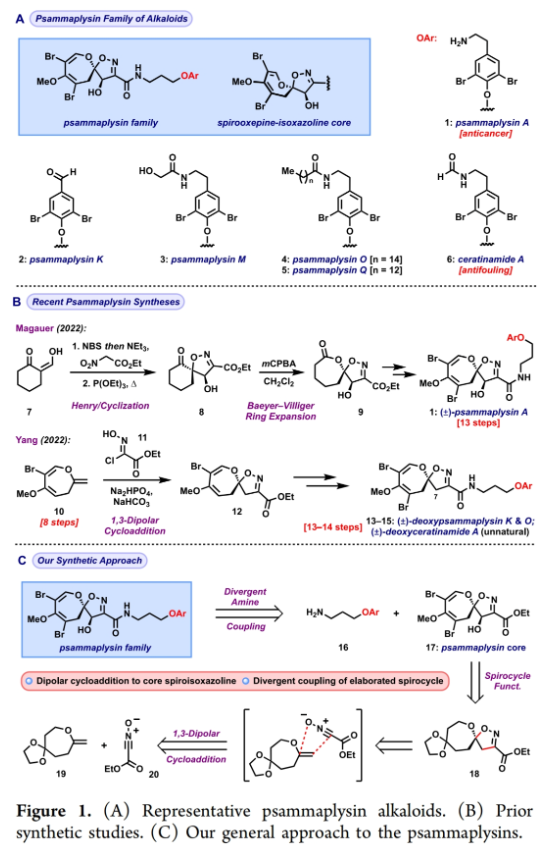
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn