

(图片来源:J. Am. Chem. Soc.)
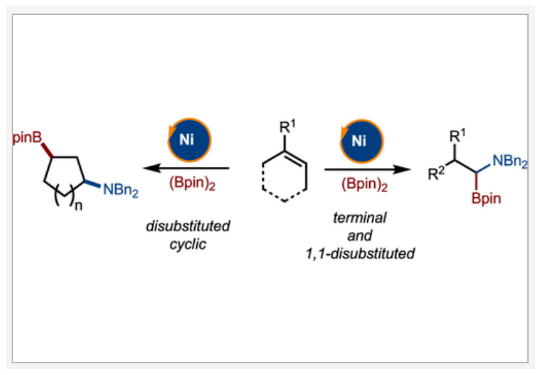
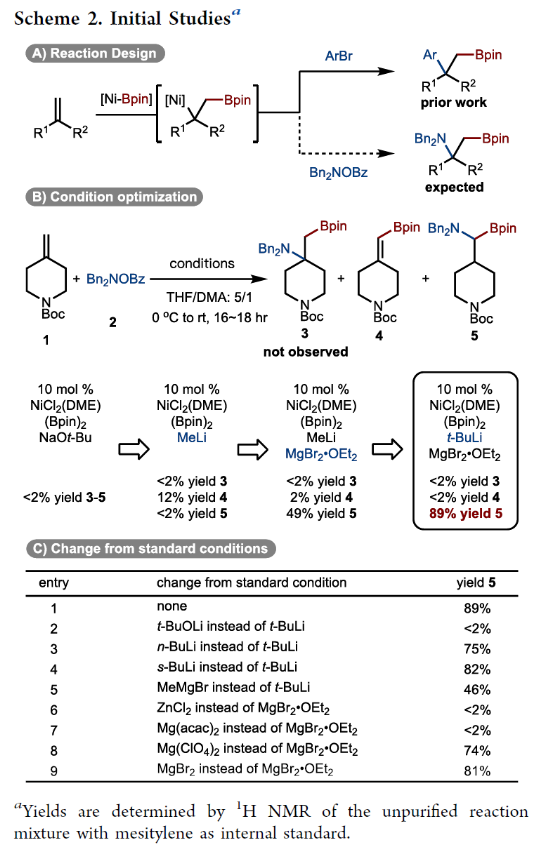
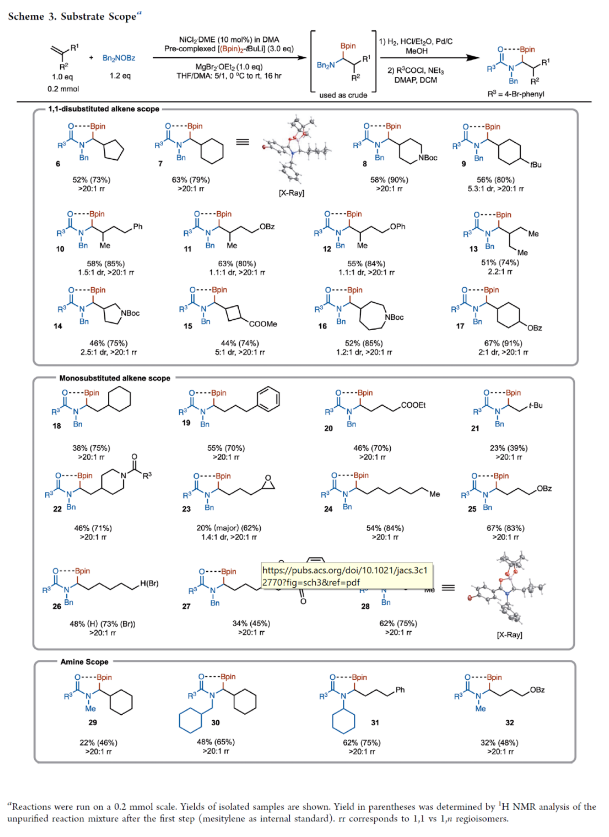
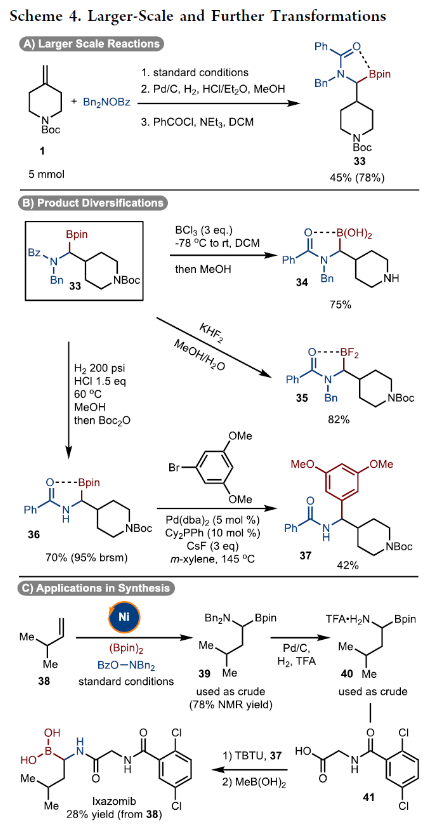
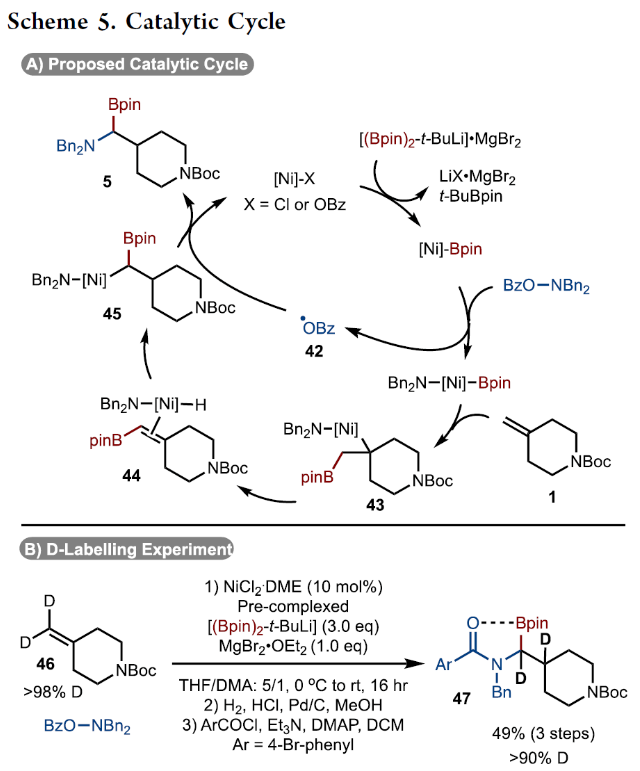
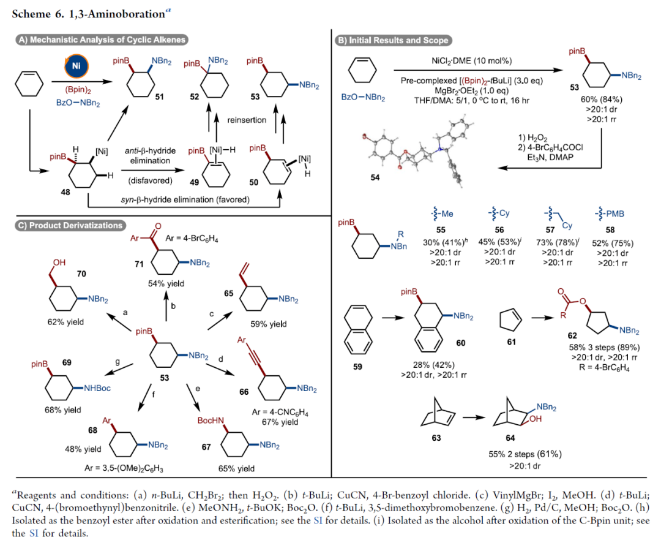
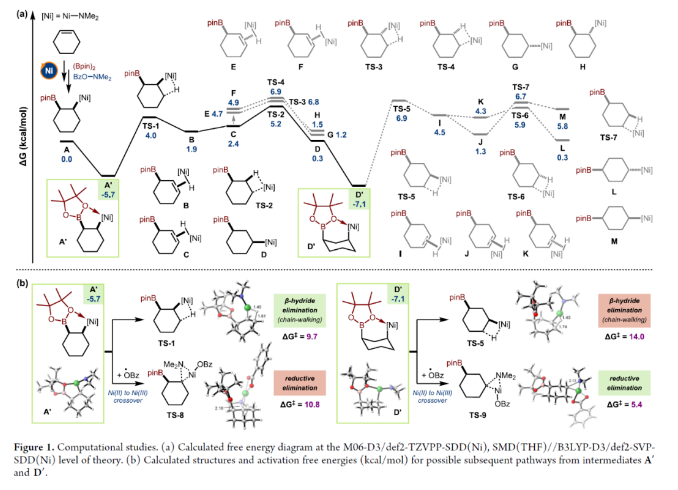
正文 烯烃的官能团化反应是一类重要的化学合成方法,因为其可以使用简单易得的起始原料来快速构建分子的复杂性。近年来,烯烃的氨基-硼化反应取得了重要突破。这些反应意义重大,因为它们可以一步同时构建C-N键和C-B键,且C-B键还可以进行进一步的合成转化。2013年,Miura课题组报道了铜催化芳基烯烃与(Bpin)2和亲电胺试剂的1,2-氨基-硼化反应(Scheme 1A)。通常来讲,铜催化的硼官能团化反应仅限于活化的烯烃,而Miura课题组证明了非活化烯烃同样可以参与此转化。此外,其通过配体和硼试剂的调控,还可以实现此转化的区域发散过程(Scheme 1B)。最近,美国印第安纳大学M. Kevin Brown课题组和美国欧柏林学院Shuming Chen课题组联合发展了镍催化,非活化烯烃的1,1-氨基-硼化反应(Scheme 1C)。值得注意的是,该方法可以兼容1,1-二取代烯烃,并且生成了很难利用相关的氢-胺化或氢/质子硼化方法得到的1,1-氨基-硼化产物。此外,此方法还可以实现环烯烃的1,3-氨基-硼化反应。下载化学加APP到你手机,更加方便,更多收获。 (图片来源:J. Am. Chem. Soc.) 首先,作者以烯烃1和Bn2NOBz 2作为模板底物对反应进行探索(Scheme 2)。通过一系列条件筛选,作者发现当使用1 (1.0 equiv), 2 (1.2 equiv), NiCl2-DME (10 mol%), [(Bpin)2-tBuLi] (3.0 equiv), MgBr2-OEt2 (1.0 equiv), 在THF/DMA(5/1)中0 oC-室温反应16小时,可以以89%的核磁产率得到1,1-氨基-硼化产物5。实现此转化的关键是与镁盐结合的烷基锂活化试剂的使用。 (图片来源:J. Am. Chem. Soc.) 在得到了最优反应条件后,作者对此转化的底物范围进行了考察(Scheme 3)。实验结果表明包括1,1-二取代烯烃和单取代烯烃在内的一系列烯烃均具有良好的兼容性,以23-67%的分离产率,良好的区域选择性(> 20:1 rr)得到相应的1,1-氨基-硼化产物6-28。其中包括酯基、环氧、烷基、(杂)芳基、酰胺、卤素等一系列官能团均可兼容。此外,不同的胺亲电试剂也同样具有良好的兼容性,以22-62%的分离产率得到产物29-32。值得注意的是大位阻的胺(例如Bn(Cy)N)产率较高,而小位阻的胺(例如Bn(Me)N)产率相对较低。可能是由于在反应条件下,小位阻的胺更容易降解。 为了证明此转化的实用性,作者首先进行了大规模实验(Scheme 4A)。作者以1为底物在5.0 mmol规模下反应,仍可以以78%的产率得到产物33。随后,作者通过将产物33中的Bpin进行转化,分别以75%和82%的产率得到相应的硼酸34和二氟化硼产物35。此外,33还可以通过脱苄基以及原位Boc保护以70%的产率得到36,其可以通过钯催化的偶联反应以42%的产率得到37(Scheme 4B)。接下来,作者以38为起始原料,在标准条件下可以以78%的核磁产率得到39,并经历随后的氢化、偶联以及水解以28%的产率实现Ixazomib的合成(Scheme 4C)。 (图片来源:J. Am. Chem. Soc.) 在对底物范围和合成应用进行探索后,作者对反应机理进行了考察。DFT计算表明,由于Bn2NOBz的N-O键相对较弱,因此其会很容易与镍发生氧化加成。基于上述实验结果,作者认为此反应起始于[Ni]-X络合物,其通过转金属化形成[Ni]-Bpin,并通过与Bn2NOBz反应得到Bn2N-[Ni]-Bpin中间体和OBz自由基42。随后,Bn2N-[Ni]-Bpin经历迁移插入形成43。接下来,43经历β-H消除以及1,2-再插入形成α-硼基[Ni]络合物45,并经历还原消除得到产物5(Scheme 5A)。为了证实作者所提出的机理,作者进行了氘标记实验(Scheme 5B)。当作者使用氘代底物46在标准条件下参与反应时,可以以三步49%的产率得到47。且氘原子完全从端位迁移到了内部,由此支持了β-H消除和1,2-再插入过程的存在。 (图片来源:J. Am. Chem. Soc.) 基于上述催化循环,作者设想当使用环烯烃时会是怎么样的结果(Scheme 6A)?在此过程中,迁移插入后会形成48,且其经历反式的β-H消除得到49是不容易的。如果顺式的β-H消除很慢,那么将形成1,2-双官能团化产物51。然而,如果顺式的β-H消除很快的话,会发生1,2-插入和还原消除形成1,3-双官能团化产物53。而额外的顺式β-H消除/再插入过程或发生从而形成1,4-双官能团化产物。当作者使用环己烯底物在标准条件下反应时,可以以良好的区域选择性(> 20:1 rr)和对映选择性(> 20:1 dr)形成单一的异构体53(60%)(Scheme 6B)。且产物结构通过其衍生物54的单晶结构得到了确证。顺式选择性表明金属迁移只发生在底物的一侧。此外,此转化对其它亲电胺试剂(55-58)同样适用。且当使用最小的底物BzON(Me)Bn(55)时产率中等。除环己烯外,1,4-二氢萘59和环戊烯61均可顺利反应生成60和62。此外,降冰片烯63也可参与反应,得到1,2-双官能化产物64。为了进一步证明此转化的实用性,作者对氨基-硼化产物53进行了一系列转化(Scheme 6C)。通过Matteson同系化反应、无过渡金属参与的偶联反应、Zweifel烯烃化反应、铜催化的偶联反应等转化以48-68%的产率得到相应的衍生物65-71。 (图片来源:J. Am. Chem. Soc.) 最后,为了进一步阐明环己烯的氨基-硼化反应的区域选择性和立体选择性,作者进行了DFT计算,并得出如下结论(Figure 1):1)A能够以较低的能垒(10-14 kcal/mol)进行顺式β-H消除和再插入(链行走),且链行走过程在室温下可能是快速的。2)Ni-烷基中间体的1,2-syn (A)和1,3-syn (D)异构体均采用A'和D'的配位模式,即Bpin中的氧与Ni配位,且此配位模式的能量最低(A':-5.7 kcal/mol;D':-7.1 kcal/mol)。3)对于A',β-H消除(9.7 kcal/mol)与还原消除(18 kcal/mol)相比具有较低的能垒;对于D',还原消除(5.4 kcal/mol)比β-H消除(14.0 kcal/mol)具有更低的能垒。此结果表明A'倾向于经历β-H消除转化为D',而D'倾向于经历还原消除生成1,3-syn氨基-硼化产物。 (图片来源:J. Am. Chem. Soc.) 总结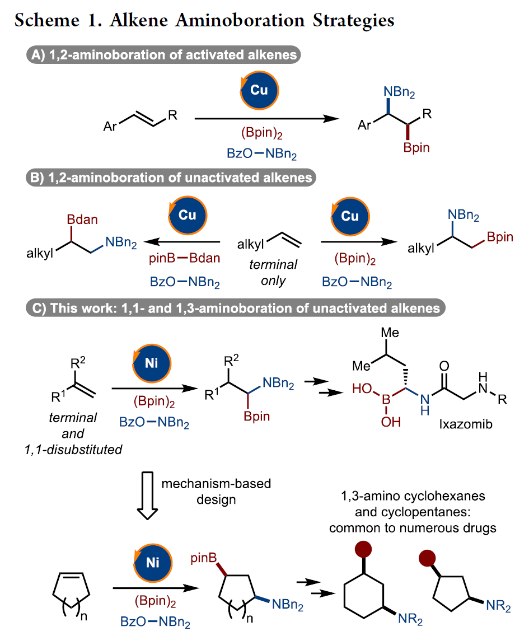
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn