

(图片来源:J. Am. Chem. Soc.)
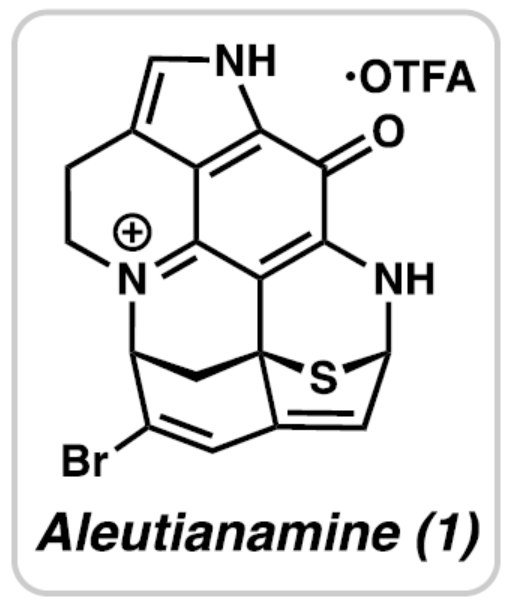
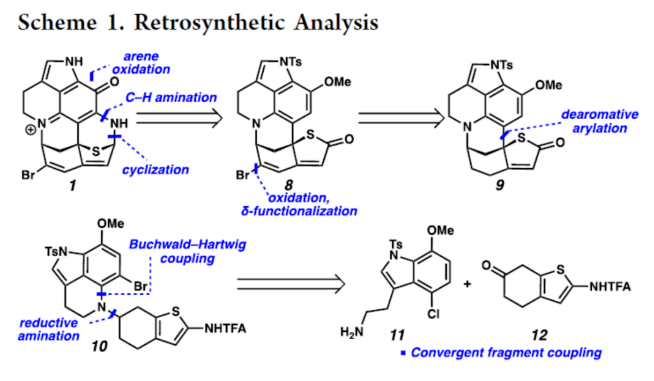
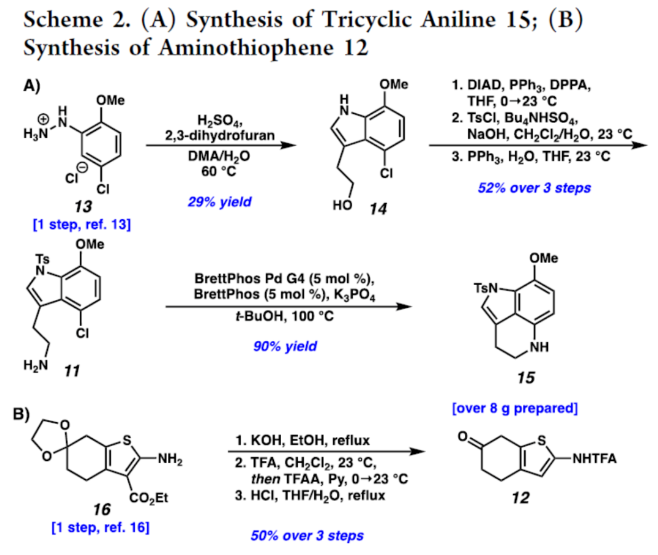
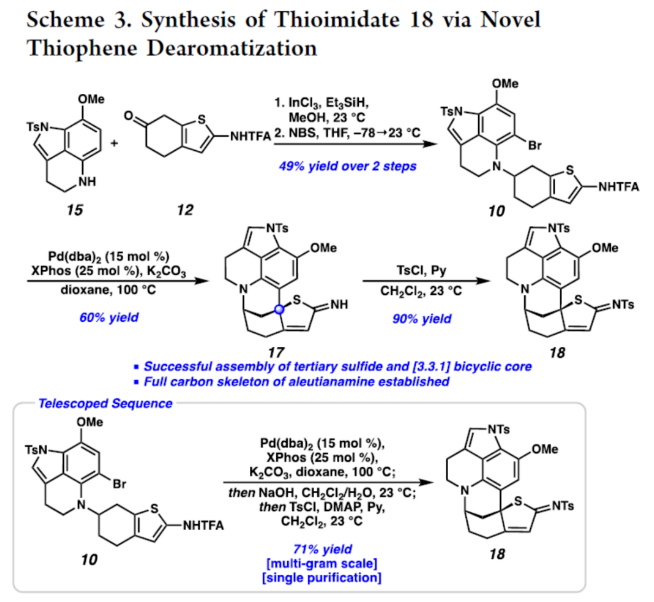
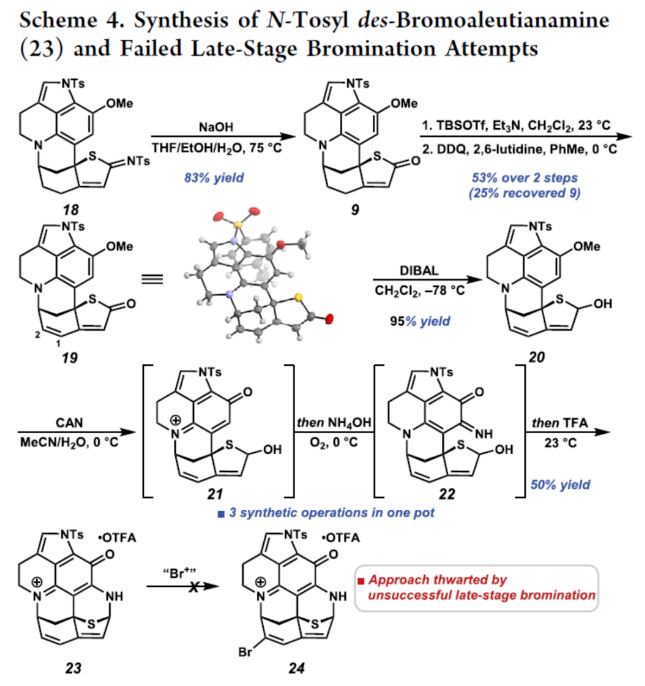
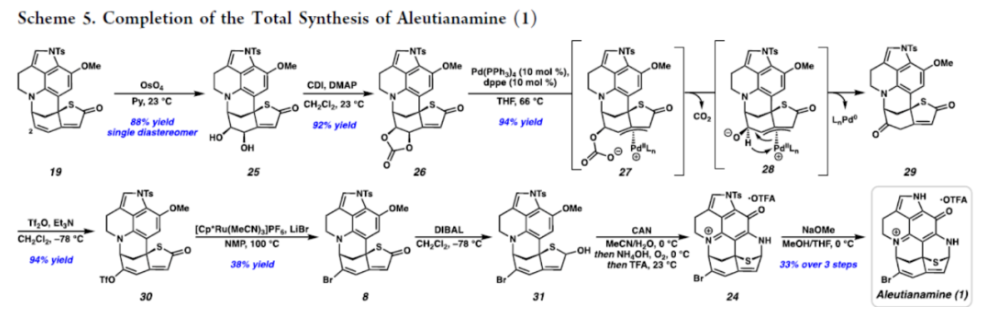
正文 从历史上看,天然产物对药物发现和新疗法做出了重大贡献,尤其是在癌症和传染病领域。事实上,癌症的几种最先进的治疗方法是天然产物或天然产物衍生物的使用。2019年,Hamann课题组分离出一种Aleutianamine(1),其是一种海洋生物碱,对实体瘤细胞系具有强效和选择性的细胞毒性。值得注意的是,它对人胰腺癌细胞系PANC-1的IC50为25 nM。这种效力是FDA批准的化疗剂Gemcitabine的160多倍,进一步证明了该天然产物的治疗潜力。Aleutianamine(1)属于吡咯亚氨基醌(pyrroloiminoquinone)生物碱家族的天然产物,由其保守的中心平面三环骨架定义。这些天然产物由于其复杂的分子骨架和广泛的生物活性而受到合成界的极大关注。从结构上讲,Aleutianamine(1)具有一个独特的七环骨架,该骨架由吡咯亚氨基醌单元、一个位阻较大的三级烷基硫醚和烯基溴取代的桥联氮杂双环[3.3.1]壬烷环骨架和另一个桥联硫代胺缩醛(thioaminal)键组成(Figure 1A)。前期,Aleutianamine(1)主要由MakaluvamineF(2)或Discorhabdin B(3)通过生物合成途径生成(Figure 1A)。2023年,Tokuyama课题组(J. Am. Chem. Soc. 2023, 145, 18233.)通过仿生方法完成了Aleutianamine(1)的首次全合成,其中Discorhabdin B类似物经历阳离子重排以产生Aleutianamine(1)环骨架,支持所提出的生物合成途径。在此,Stoltz课题组设计了一种替代的非仿生方法,其中心是桥联[3.3.1]环骨架的形成,然后是后期芳烃氧化,与以前的吡咯亚氨基醌合成相比,这是一种独特的策略(Figure 1B)。噻吩的去芳构化是实现该策略的关键转化,因为该反应将在单个合成步骤中构建桥联[3.3.1]环骨架和位阻较大的三级桥头硫醚(Figure 1C)。下载化学加APP到你手机,更加方便,更多收获。 (图片来源:J. Am. Chem. Soc.) 首先,作者进行了逆合成的分析(Scheme 1)。Aleutianamine(1)可由砌块8经环化、C-H胺化与芳烃的氧化反应制备。砌块8可由砌块9经氧化与官能团化反应制备。砌块9可由砌块10经Buchwald-Hartwig偶联与还原胺化反应制备。砌块10可由色胺化合物11和氨基噻吩化合物12经汇聚性偶联反应制备。 (图片来源:J. Am. Chem. Soc.) 砌块15的合成(Scheme 2A)。以芳基肼13与二氢呋喃为底物,在H2SO4/DMA条件下反应,可以29%的收率得到吲哚衍生物14。化合物14通过Mitsunobu反应、N-对甲苯磺酰基化与Staudinger还原的过程,可以三步52%的收率得到色胺化合物11。化合物11通过分子内Buchwald−Hartwig胺化反应,可以90%的收率得到三环苯胺化合物15。 砌块12的合成(Scheme 2B)。以氨基噻吩衍生物16为底物,在KOH/EtOH、TFA/CH2Cl2以及TFAA/Py条件下分别进行皂化、脱羧以及氨基的保护,可以三步50%的收率得到化合物12。 (图片来源:J. Am. Chem. Soc.) 砌块18的合成(Scheme 3)。化合物15与12在InCl3/Et3SiH条件下进行偶联反应,并在NBS/THF条件下进行溴化反应,可以两步49%的收率得到化合物10。化合物10在Pd(dba)2/ XPhos/K2CO3条件下进行去芳构化环化反应,可以60%的收率得到硫代亚胺酸酯(thioimidate)化合物17。化合物17在TsCl/Py条件下进行N-对甲苯磺酰基化反应,可以90%的收率得到化合物18。同时,以化合物10为底物,通过上述的串联过程,可以两步71%的收率得到化合物18。 (图片来源:J. Am. Chem. Soc.) 砌块23的合成(Scheme 4)。化合物18在NaOH/THF/EtOH/H2O条件下进行水解反应,可以83%的收率得到硫代丁烯酸内酯化合物9。化合物9在TBSOTf/Et3N条件下进行烯醇化反应,并在DDQ/2,6-lutidine条件下进行氧化反应,可以两步53%的收率得到二烯酮化合物19。化合物19在DIBAL/CH2Cl2条件下进行还原反应,可以95%的收率得到二烯醇化合物20。化合物20在CAN/MeCN/H2O条件下进行氧化反应,在NH4OH/O2条件下进行胺化与氧化反应,并在TFA条件下进行脱水环化反应,可以50%的收率得到化合物23。然而,化合物23在随后的溴化反应中失败,所有尝试的溴化条件都导致其分解或得到不期望的区域选择性。 (图片来源:J. Am. Chem. Soc.) Aleutianamine(1)的合成(Scheme 5)。为了避免后期溴化的不成功,作者试图增加二烯化合物19上C2-位的氧化态,这将为溴化提供一个功能手柄。通过大量的条件优化后发现,化合物19在OsO4/Py条件下进行双羟基化反应,可以88%的收率得到二醇化合物25。化合物25在CDI/DMAP/CH2Cl2条件下反应,可以92%的收率得到碳酸酯化合物26。化合物26在Pd(PPh3)4/dppe条件下进行脱羧频哪醇型重排,可以94%的收率得到酮化合物29。该过程可能是通过π-烯丙基Pd(II)中间体27脱羧得到中间体28,中间体28随后进行β-氢消除和互变异构化得到所需的酮化合物29。值得注意的是,该过程代表了第一个钯催化烯丙基碳酸酯的脱羧频哪醇型重排的例子。化合物29在Tf2O/Et3N条件下进行羟基的保护,可以94%的收率得到化合物30。化合物30在[Cp*Ru(MeCN)3]PF6/LiBr/NMP条件下进行三氟甲酸酯−卤素交换反应,可以38%的收率得到烯基溴化物8。化合物8在DIBAL/CH2Cl2条件下还原反应(制备化合物31),在CAN/MeCN/H2O条件下进行氧化反应,在NH4OH/O2条件下进行胺化与好氧氧化反应,在TFA条件下进行脱水环化反应(制备化合物24),并在NaOMe/MeOH/THF条件下进行脱保护反应,可以三步33%的总收率得到Aleutianamine(1)。 (图片来源:J. Am. Chem. Soc.) 总结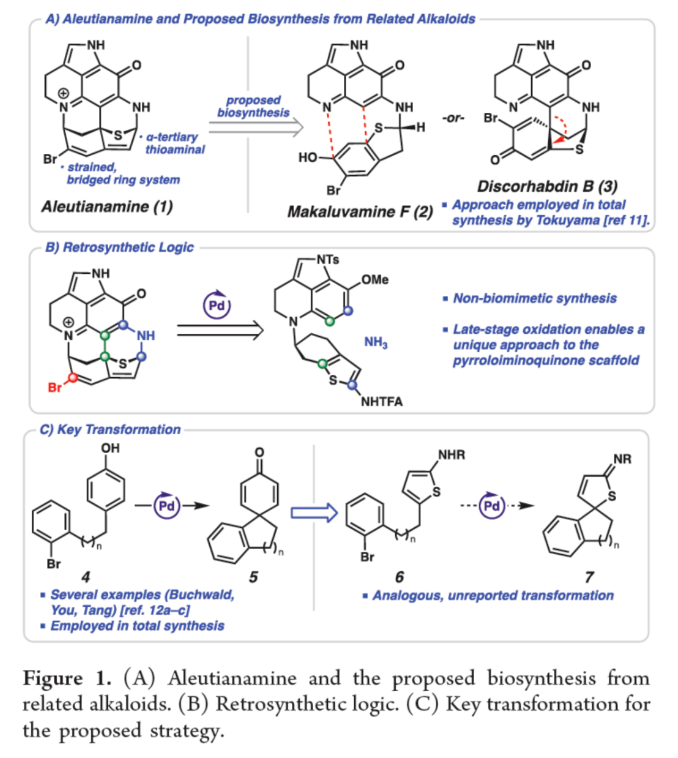
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn