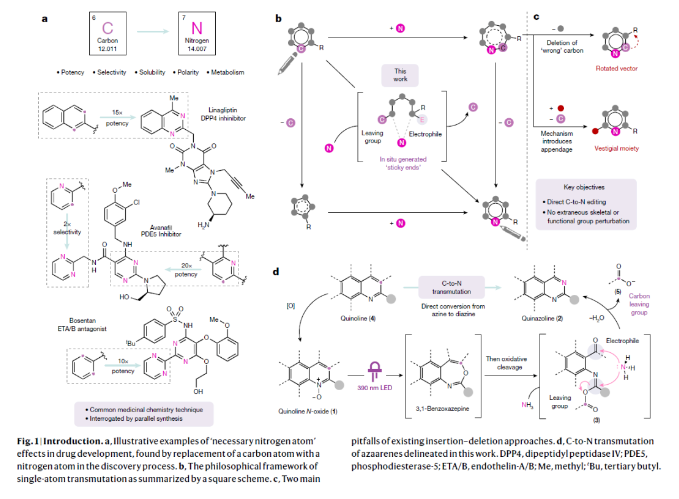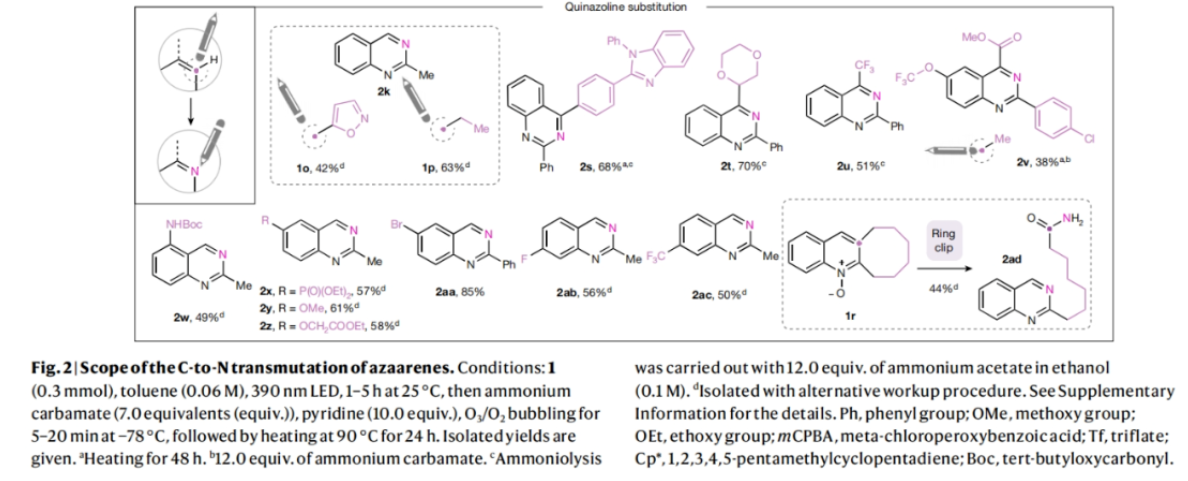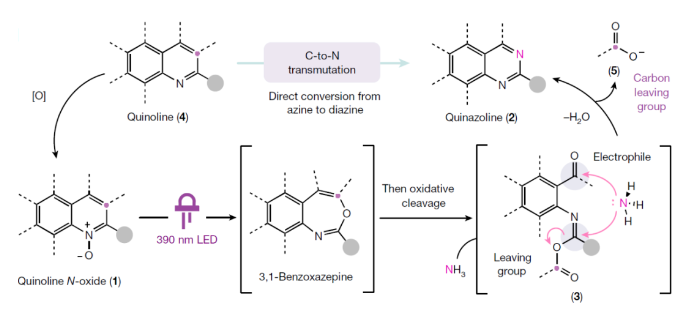
当化学家们寻找一个理想的分子来实现特定功能(如药物)时,成功与失败的区别往往仅相差一个原子。利用氮原子代替芳香碳原子将有助于发现潜在的药物,但目前只有通过平行合成等间接的方法来实现这种由C到N的转化。最近,美国芝加哥大学Mark D. Levin课题组和美国默克公司Alec H. Christian合作发展了一个新的转化,其可以直接将氮杂芳烃的碳原子转化为氮原子,将喹啉骨架转化为喹唑啉骨架(Fig. 1)。下载化学加APP到你手机,更加方便,更多收获。首先,作者选用2-苯基喹啉氮氧化物作为模板底物进行反应探索。通过对一系列反应参数的筛选,作者发现当使用2-苯基喹啉氮氧化物(0.3 mmol)在甲苯(0.06 M), 390 nm LED照射下25 °C反应;随后加入NH4H2NCO2 (7.0 equiv.), 吡啶 (10.0 equiv.), 在-78 °C利用O3鼓吹,并加热到90 °C反应24小时可以以68%的产率得到喹唑啉产物2a。此外,该策略还可以将氮氧化过程与碳原子替换为氮原子的过程结合在一锅体系中进行。当首先将喹啉在m-CPBA存在下氧化,再经历上述碳原子替换过程,在1.0 mmol规模下仍可以以55%的产率得到喹唑啉产物2a。随后,作者对反应的底物适用性进行了考察(Fig. 2)。实验结果表明,一系列不同C2取代的喹啉氮氧化物均可顺利实现转化,以37-90%的产率得到相应的喹唑啉产物2b-2n。其中包括不同取代的芳基、杂芳基、酯基、烷基等均可兼容。值得注意的是,对于双氮氧化物1a同样可以实现此转化,以47%的产率得到双喹唑啉产物2h。此外,此转化对C3取代的底物同样具有良好的兼容性,以25-74%的产率得到相应的产物1b-1l。由于氮氧化物可以在过渡金属催化过程中作为导向基实现喹啉C8位的C-H官能团化。因此,作者使用铑催化,导向的C-H碘化(1n, 71%)与此过程串联,以75%的产率得到喹唑啉产物2r,由此突出了骨架官能团化和骨架编辑之间协同作用的应用潜力。最后,作者通过对底物进行进一步考察,发现一系列官能团如二氧六环(2t)、三氟甲基(2u)、2-氧乙酸乙酯(2z)、甲氧基(2y)和、氨基甲酸酯(2w)、氟(2ab)和三氟甲基(2ac)以及可以发生进一步合成转化的基团溴(2aa)和膦酸盐(2x)均可兼容,以49-85%的产率得到相应的产物。当C2和C3碳被一个八元环(1r)固定时,这个环可以被“剪断”形成相应的喹唑啉产物2ad(44%),同时保留原来的C3碳作为C2位的一个官能团。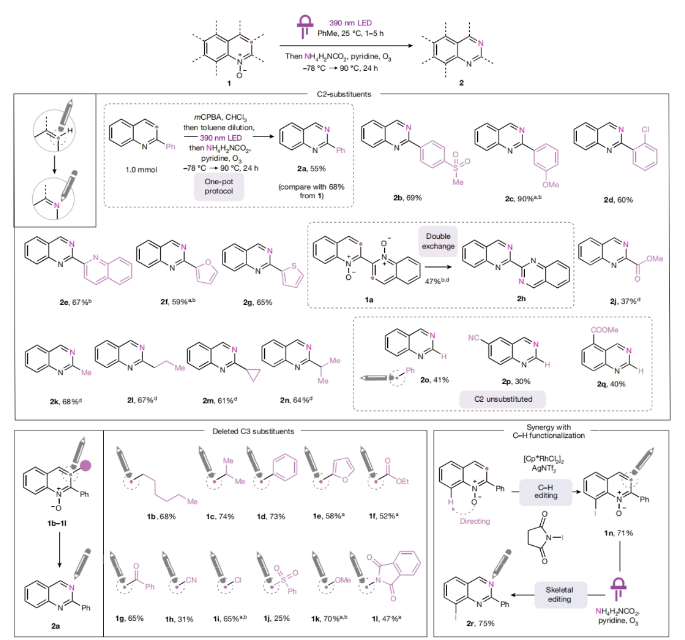
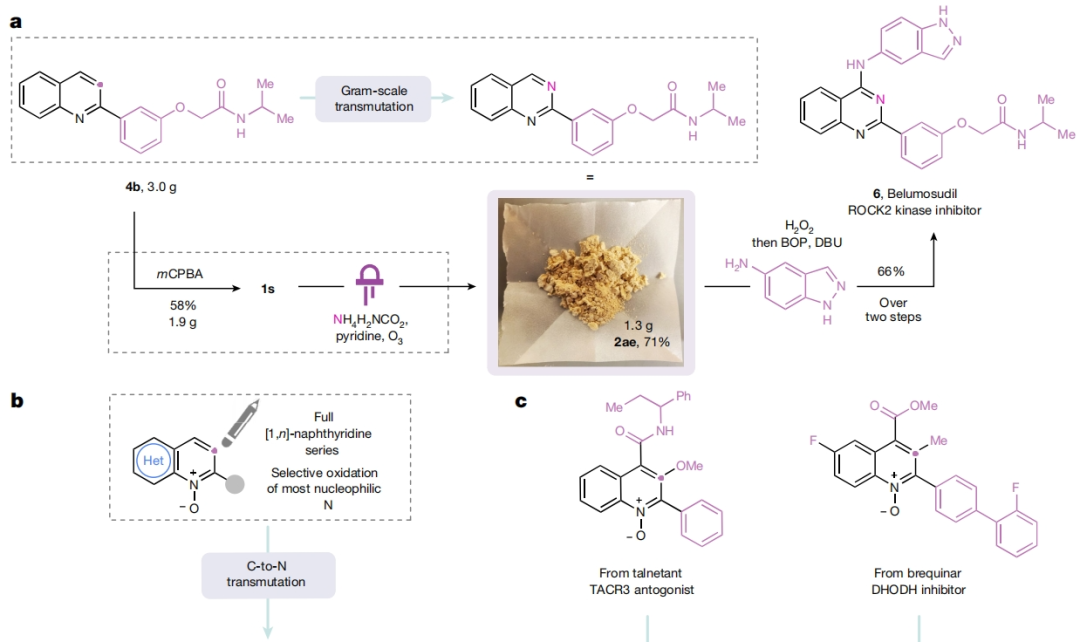
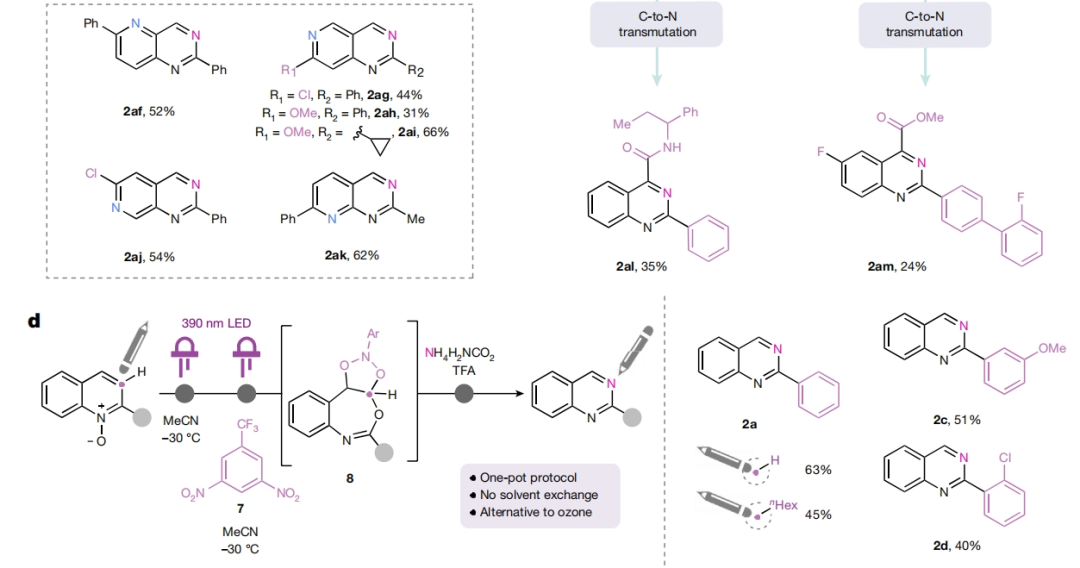
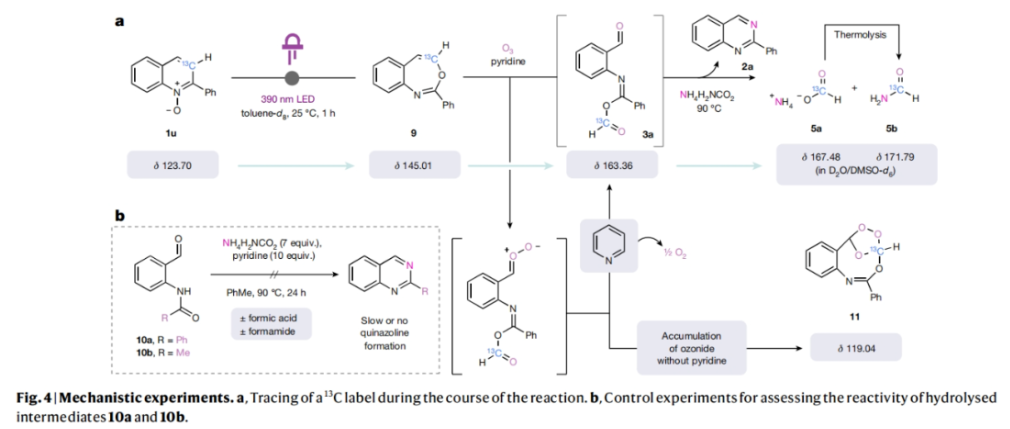
由于臭氧分解已被化学家们应用于药物的工业规模合成中。因此,作者希望利用发展的方法来实现2021年FDA批准药物belumosudil(6)的克级规模合成(Fig. 3a)。首先作者以3-喹啉基苯酚为起始原料,分两步制得喹啉前体4b,经氮氧化和碳氮原子转换两步,由1.9 g的1s制得1.3 g喹唑啉2ae。而2ae通两步C-H胺化以66%的产率得到6。此外,作者还使用不同的 [1,n]-萘啶作为起始原料,利用此策略以31-66%的产率直接实现了罕见的[1,3,n]-三氮杂萘2af-2ak的合成(Fig. 3b)。值得注意的是,作者还分别利用FDA批准的TACR3受体拮抗剂talnetant和二氢乙酸脱氢酶抑制剂衍生物brequinar作为起始原料,利用此策略分别以35%和24%的产率实现了其相应类似物2al和2am的合成(Fig. 3c)。由于一些化学家无法使用臭氧发生器,因此作者基于最近由Parasram和Leonori开发的硝基芳烃促进的光化学方法发展了一种补充的氧化断裂策略(Fig. 3d)。在-30 oC的乙腈中,将硝基芳烃7加入到经LED光解生成的8中,并用相同的LED继续光解,然后加入氨基甲酸铵和三氟乙酸反应,可以以63%的产率得到喹唑啉产物2a。此外,利用此策略还可以以40-51%的产率实现其它取代的喹唑啉产物2b-2d的合成。为了深入理解反应机理,作者制备了13C-标记的喹啉氮氧化物1u。通过核磁共振实验监测反应,作者认为5b(171.79 pm)是由5a(167.48 ppm)在加热时通过转胺化形成的(Fig. 4a)。如前所述,作者试图分离3的时候总是伴随着水解生成的2-氨基苯甲醛产物10。接下来,作者利用上述中间体进行控制试验(Fig. 4b)。在标准反应条件下,包括在反应混合物中加入额外的甲酸或甲酰胺时,这些物种均不能得到相应的喹唑啉产物。此外,作者注意到甲酰胺和甲酸的加入确实诱导了一部分10到喹唑啉的转化。但在相同的时间内,与酸酐中间体3相比,其转化率较低。总的来说,这些实验结果强调了‘sticky end’中间体3的关键作用,它不仅可以活化C3作为羧酸离去基,还可以通过活化C2取代基为亚胺酸酐来促进氨的缩合过程。Mark D. Levin课题组和Alec H. Christian合作发展了一种直接将氮杂芳烃的碳原子替换为氮原子的方法,喹啉骨架一步即可转化为喹唑啉类化合物。反应中通过氮杂芳烃的氧化重组得到了一个带有亲电位点的开环中间体,为离去基的移除和再次环化提供了条件。此方法的发展颠覆了现有的原子插入-删除方法,从而避免了分子骨架编辑中常见的骨架旋转和取代基干扰等问题。此反应的发展为利用喹啉合成喹唑啉提供了新的思路。文献详情:
Jisoo Woo, Colin Stein, Alec H. Christian*, Mark D. Levin*. Carbon-to-nitrogen single-atom transmutation of azaarenes. Nature, 2023, https://doi.org/10.1038/s41586-023-06613-4.