

(图片来源:Angew. Chem. Int. Ed.)
正文
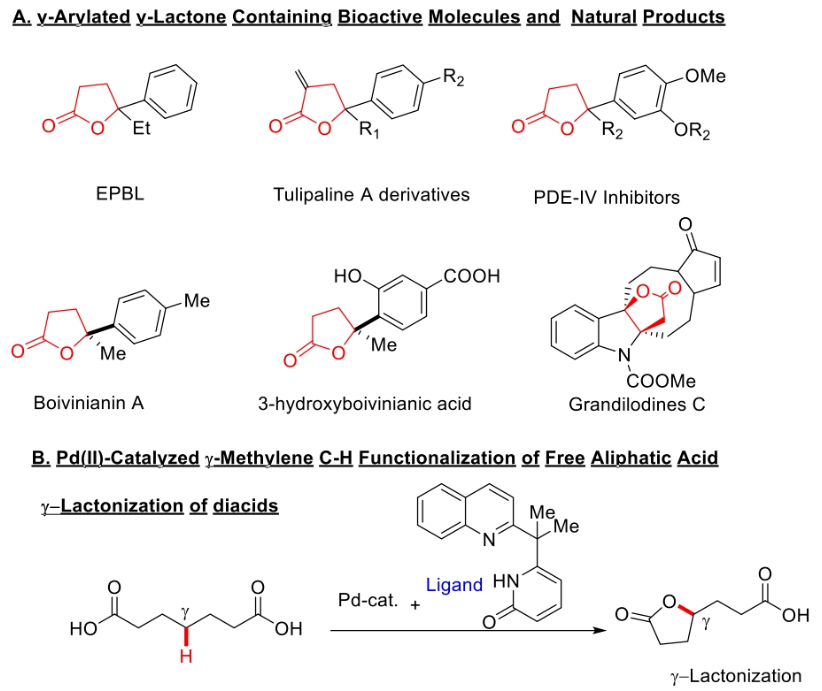
据统计,接近三分之一的天然产物和药用活性分子中均含有内酯骨架。特别是,与氧原子相邻的原子为三级中心的γ-丁内酯骨架在天然产物中非常常见(Scheme 1A),其可以作为生物活性靶点的合成中间体。通常来讲,这些γ-叔芳基化γ-丁内酯衍生物是由不饱和羧酸通过亲电内酯化或氢内酯化合成的。因此,开发利用简单易得的起始原料来合成芳基化γ-丁内酯的新催化方法是目前药物化学的研究热点。而利用过渡金属催化的双γ-C(sp3)-H官能团化策略是快速构建γ-丁内酯的理想选择。下载化学加APP到你手机,更加方便,更多收获。
由于脂肪酸广泛存在于生物活性分子和有机分子中,因此其在钯催化下的C(sp3)-H官能团化备受化学家们的关注。到目前为止,化学家们已经开发了一系列催化体系,来实现末端β-或γ-甲基C(sp3)-H键的官能团化,从而实现一系列转化。尽管目前已经取得了一定的进展,但在甲基C-H键存在的情况下选择性的实现亚甲基C-H键活化仍具有一定的挑战性,这主要是由于甲基C-H键在钯催化的C-H活化反应具有更高的反应活性。
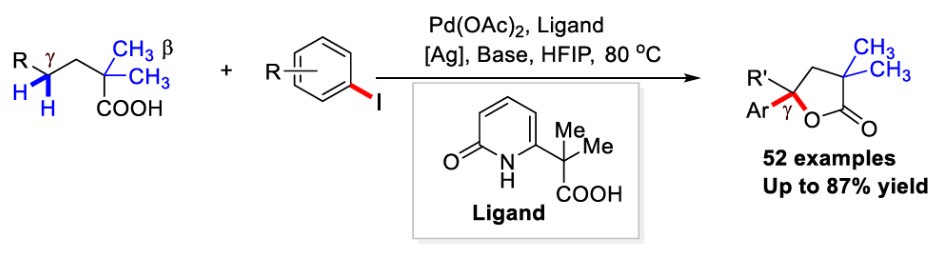
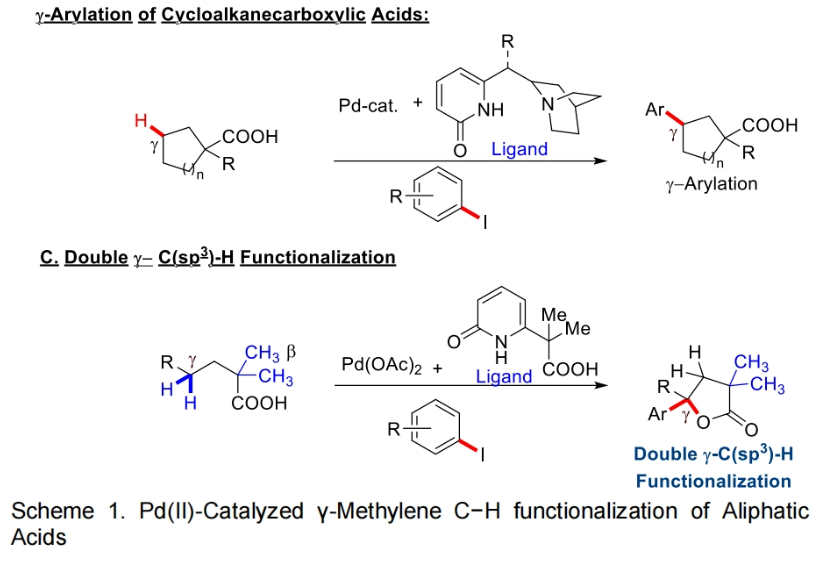
2022年,余金权课题组发展了钯催化,吡啶-吡啶酮配体促进的γ-亚甲基C-H内酯化反应(Science, 2022, 376, 1481-1487)。随后,其证明使用新开发的奎宁-吡啶酮配体可以在钯催化下实现环羧酸的跨环C(sp3)-H芳基化反应(Nature, 2023, 618, 519-525)。然而,反应中γ-内酯化过程仅限于二酸,而γ-C(sp3)-H芳基化仅适用于环状底物(Scheme 1B)。因此,开发有效的催化体系和反应策略来实现线性脂肪酸的γ-亚甲基C(sp3)-H键官能团化仍然具有一定的挑战。最近,美国斯克里普斯研究所余金权课题组发展了在L,X-型羧基-吡啶酮配体促进下,实现了Pd(II)-催化脂肪酸的串联γ-芳基化和γ-内酯化反应(Scheme 1C)。
(图片来源:Angew. Chem. Int. Ed.)
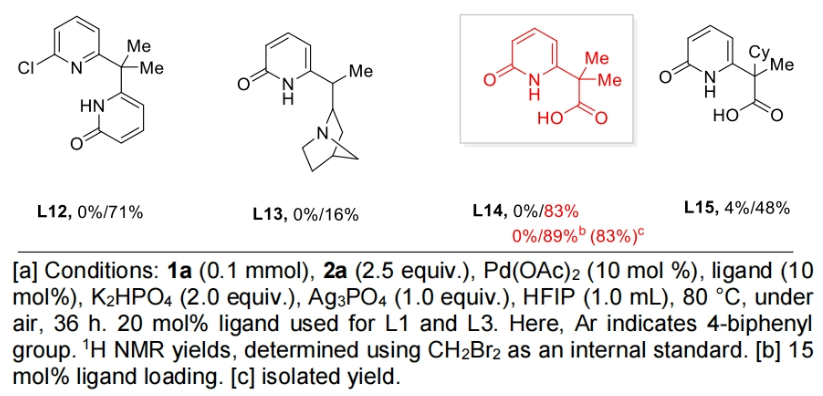
首先,作者以2,2-二甲基戊酸1a作为模板底物,4-碘联苯作为偶联配偶体,对此反应进行了探索。通过一系列条件筛选,作者发现配体对实现此过程至关重要。且在不存在额外配体的条件下,仅可以观察到β-甲基C(sp3)-H芳基化产物。随后,作者对一系列配体进行筛选,发现当在1a (0.1 mmol), 4-碘联苯(2.5 equiv.), Pd(OAc)2 (10 mol %), 羧基-吡啶酮配体L14 (15 mol%), K2HPO4 (2.0 equiv.), Ag3PO4 (1.0 equiv.), 在HFIP (1.0 mL)中80 °C,空气氛围下反应36小时可以以83%的分离产率得到γ-芳基化γ-内酯产物3(Table 1)。

(图片来源:Angew. Chem. Int. Ed.)
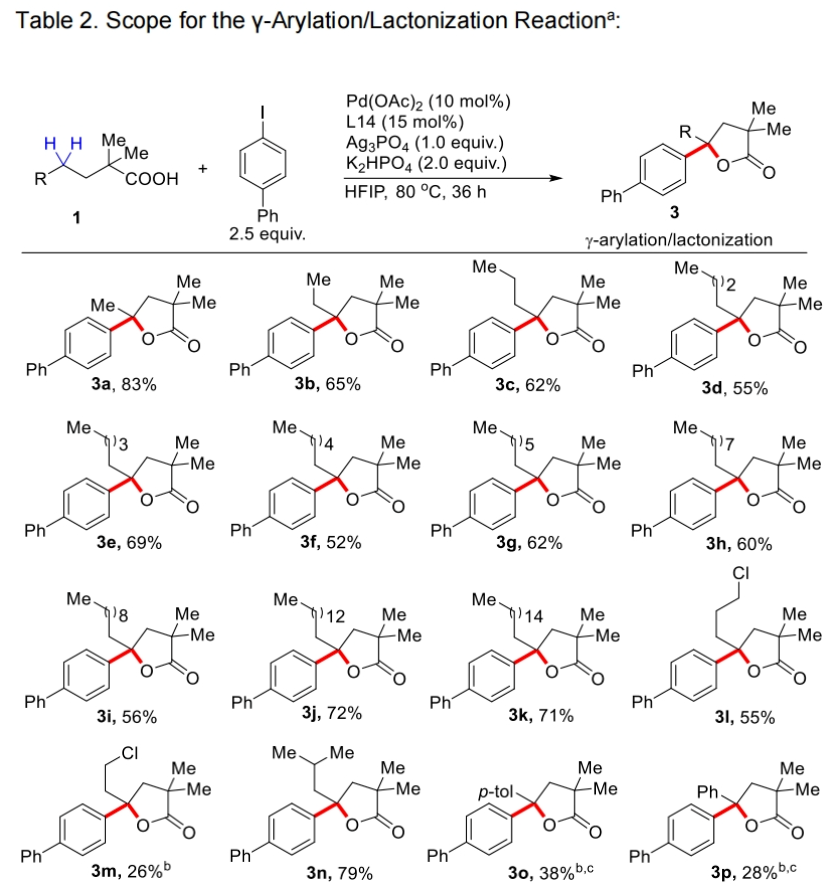
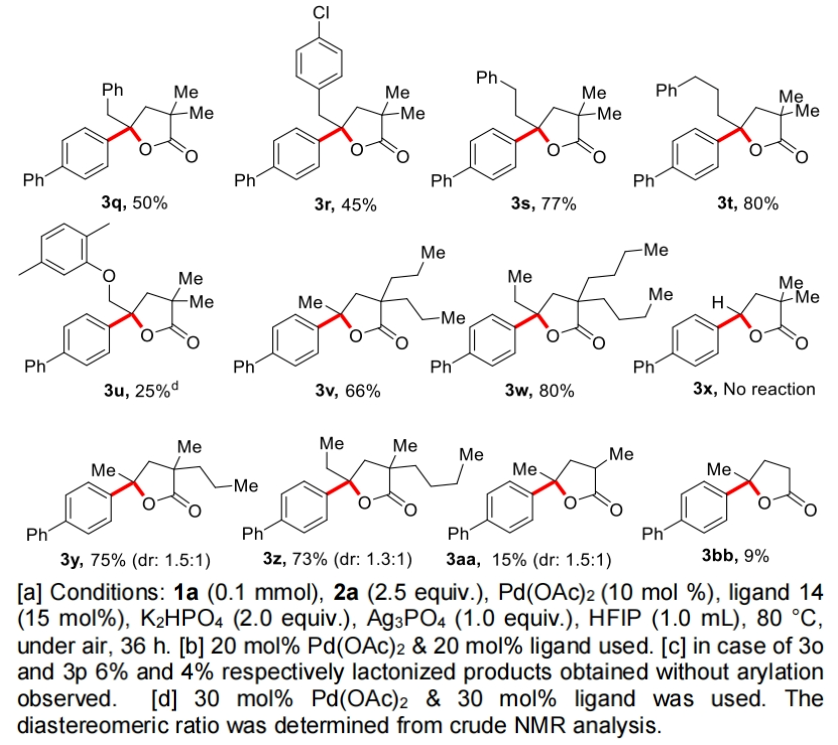
在得到了最优反应条件后,作者首先对不同取代线性羧酸的兼容性进行了考察(Table 2)。实验结果表明此转化对于一系列不同链长(5,6,7-20)的脂肪酸均具有良好的兼容性,以52-83%的产率得到相应的产物3a-3k。此外,氯取代的脂肪链底物,支链底物、γ-芳环取代、以及α-位不同取代的底物均可顺利实现转化,以25-80%的产率得到相应的产物3l-3w。值得注意的是,市售药物Gemfibrozil (1u)也可兼容,以25%的产率得到产物3u。遗憾的是,含有一级γ-C-H键的2,2-二甲基丁酸不能实现转化,且作者仅观察到了未反应的起始原料1x。由此表明作者所发展的反应体系对γ-亚甲基C-H键活化具有很高的选择性。此外,对于α-位不同取代的底物连有两个不同取代基的底物1y和1z,可以分别以75%和73%的产率得到相应的产物3y(d.r. = 1.5:1)和3z(d.r. = 1.3:1)。而α-位单取代底物以及α-位没有取代的底物,可能是由于缺乏Thorpe-Ingold效应,产率相对较低(3aa, 15%; 3ab, 9%)。
(图片来源:Angew. Chem. Int. Ed.)
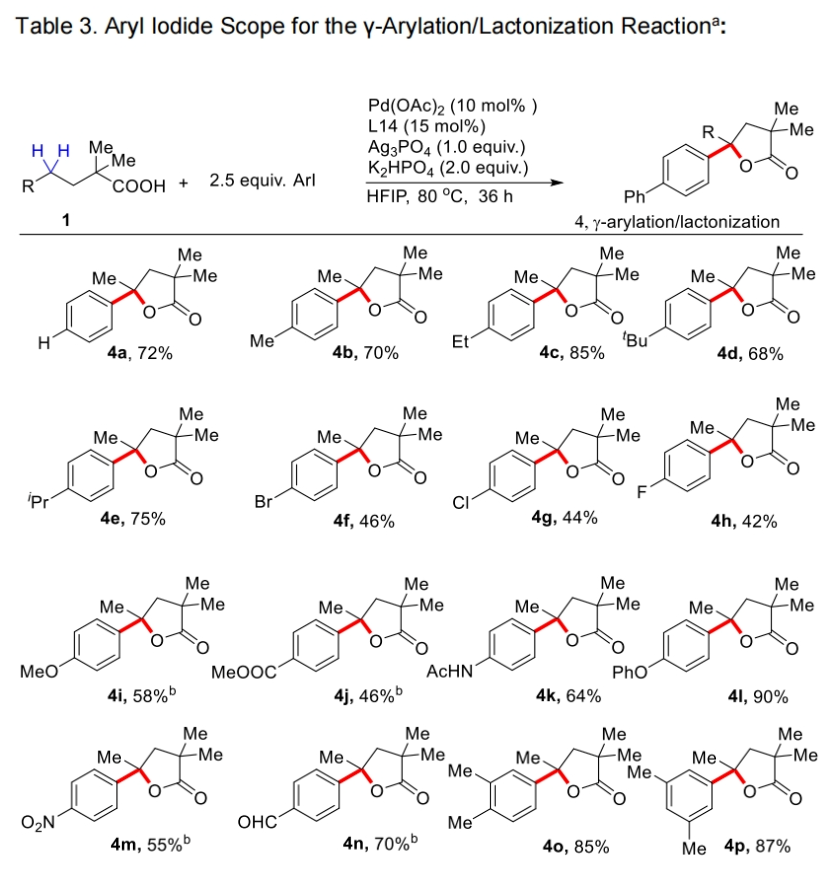
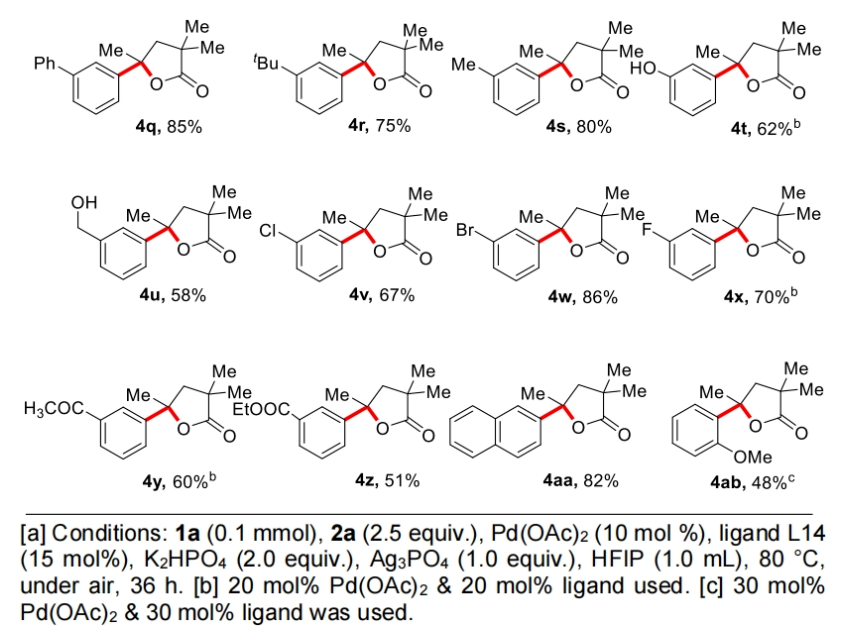
接下来,作者对芳基碘偶联配偶体的兼容性进行了探索(Table 3)。实验结果表明一系列不同取代的芳基碘化物均可兼容,以42-85%的产率得到产物4a-4z, 4aa, 4ab。芳基碘化物的3-和4-位上含有各种脂肪族取代基的底物均提供了优异的选择性和良好的γ-芳基化γ-内酯产物产率。包含氟、氯和溴取代基的卤素取代的芳基碘显示出良好的相容性,后者特别适用于随后通过交叉偶联反应进行的多样化。
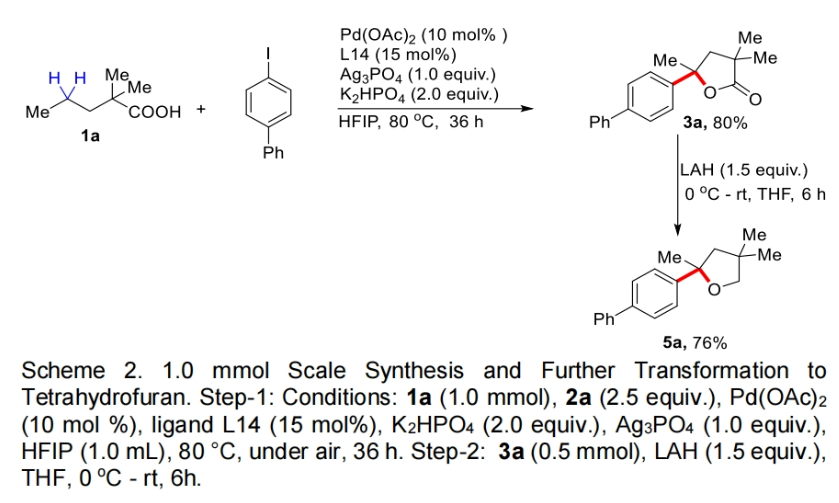
接下来,为了证明此转化的实用性,作者进行了大规模实验和产物的合成转化(Scheme 2)。当作者使用1a与4-碘联苯在1.0 mmol规模下反应时,仍可以以80%的产率得到产物3a。且产物3a在LAH的还原下可以以76%的产率得到天然产物和药物分子中常见的四氢呋喃骨架产物5a。
(图片来源:Angew. Chem. Int. Ed.)
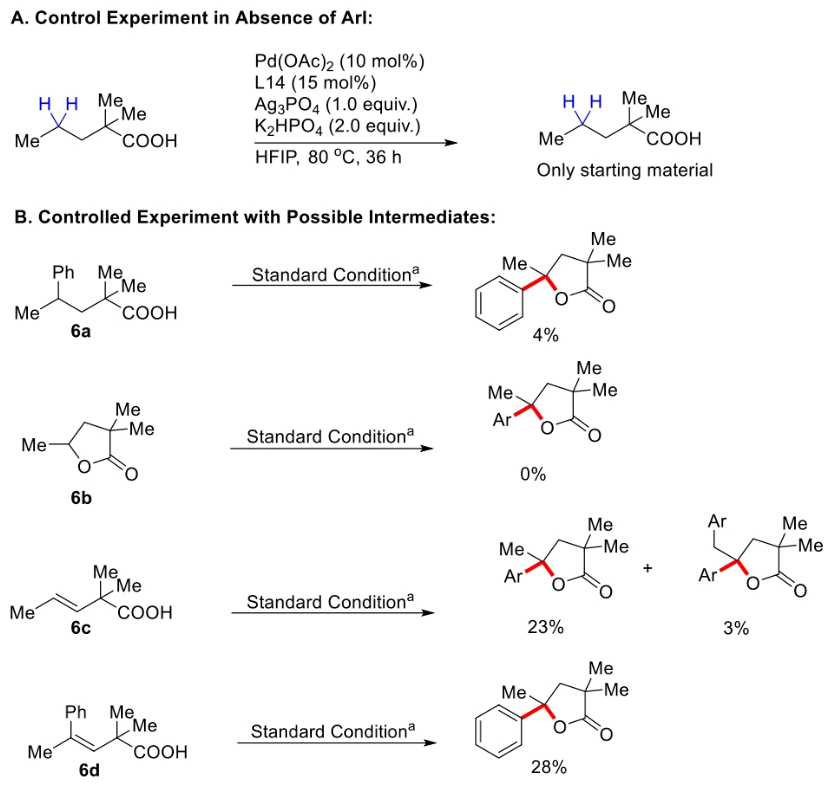
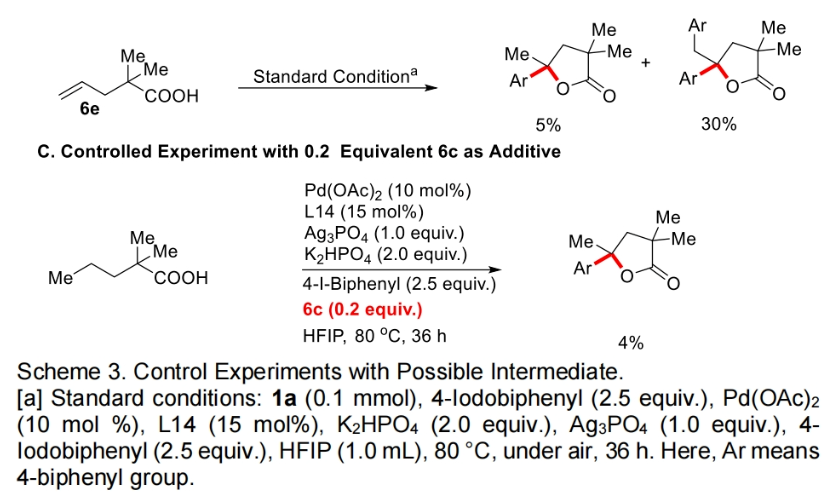
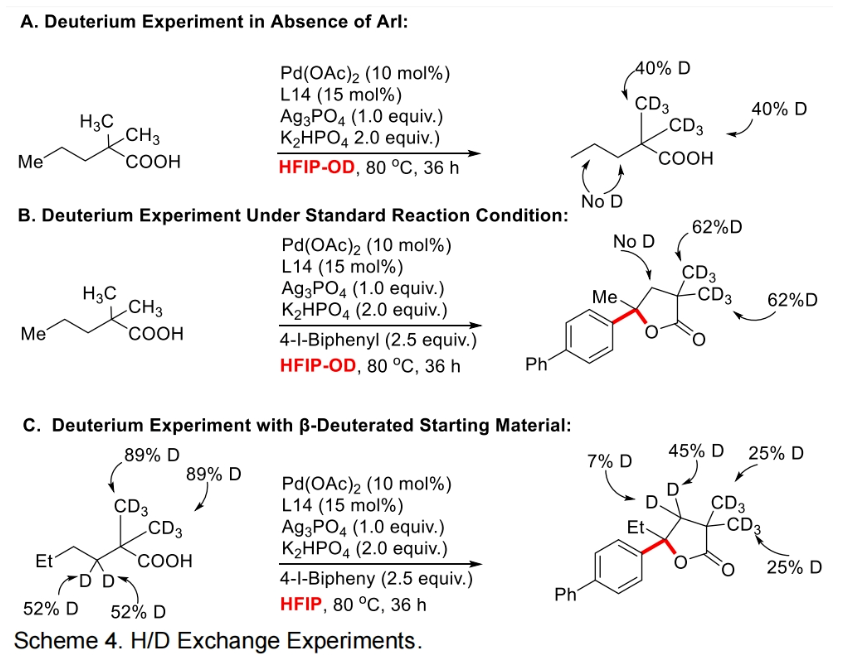
为了深入理解反应机理,作者进行了控制实验,并得出如下结论(Scheme 3):1)在不存在芳基碘时反应不发生,证明芳基碘在反应中起到重要的作用;2)6a和6b不是此反应的中间体,而6c和6d可能是此反应的中间体;3)反应中不可能经历γ,δ-脱氢路径;4)过量烯烃的存在会抑制催化剂的催化活性。最后,作者通过H/D交换实验得出反应中经历了可逆的β-甲基C-H活化过程(Scheme 4)。
(图片来源:Angew. Chem. Int. Ed.)
(图片来源:Angew. Chem. Int. Ed.)
总结
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn