

(图片来源:Adv. Funct. Mater)
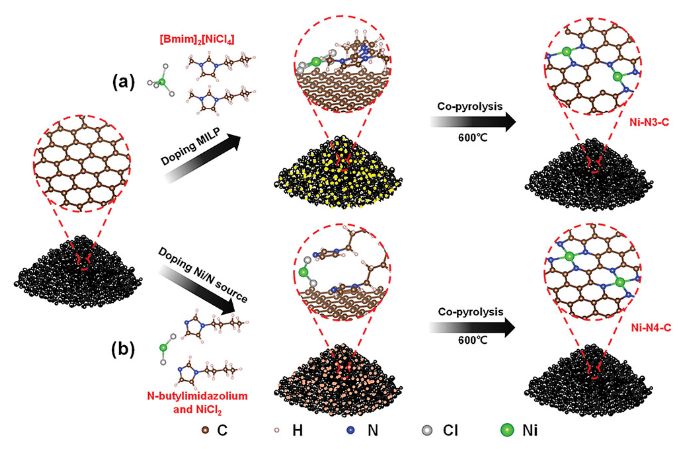
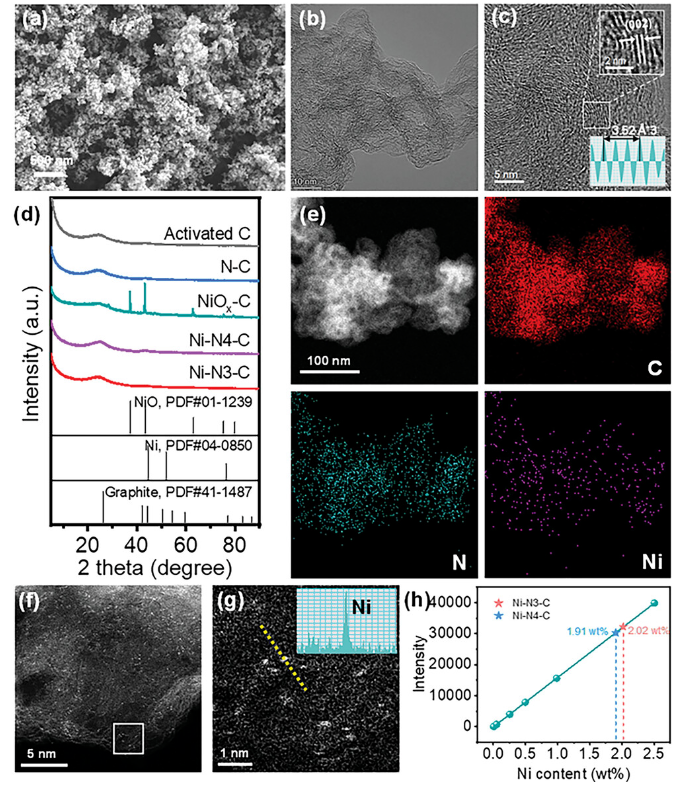
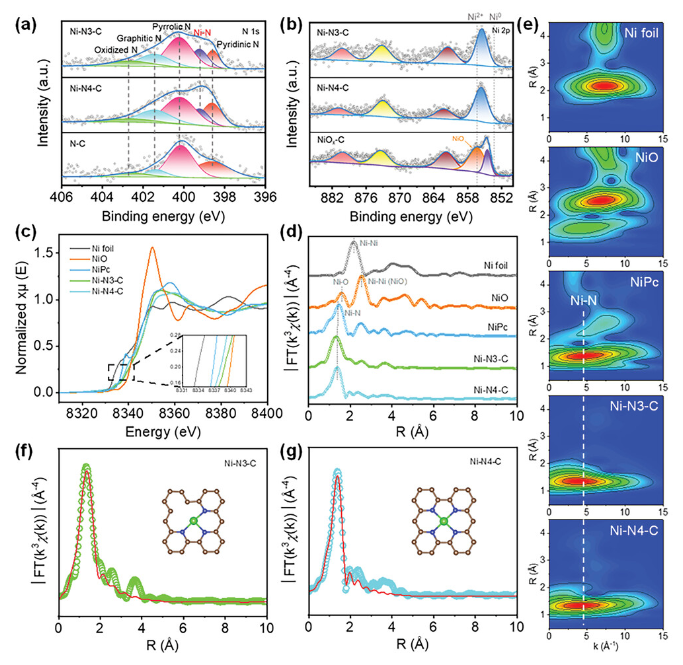
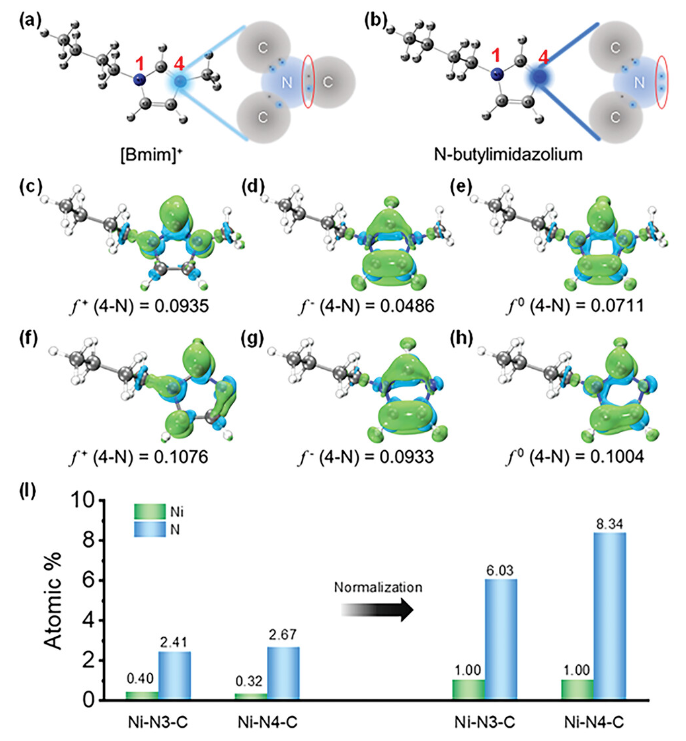
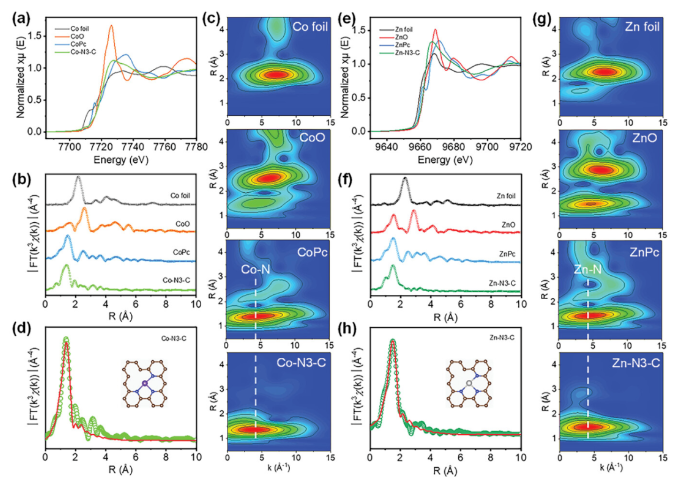
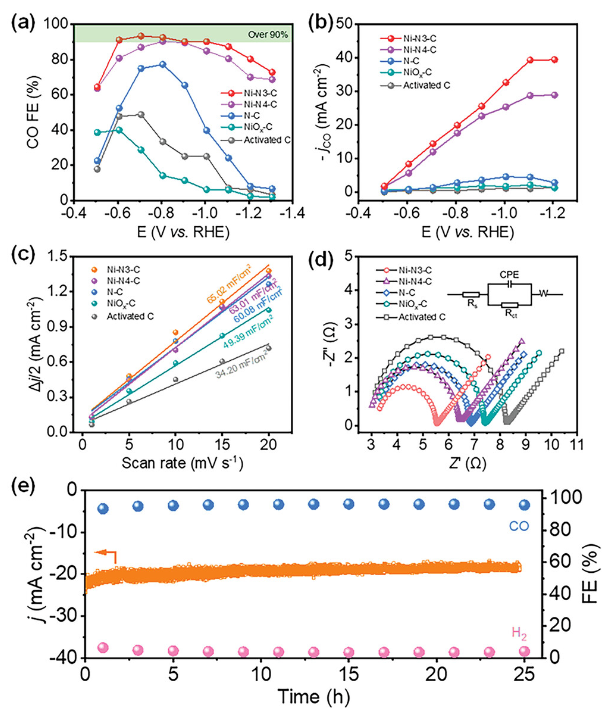
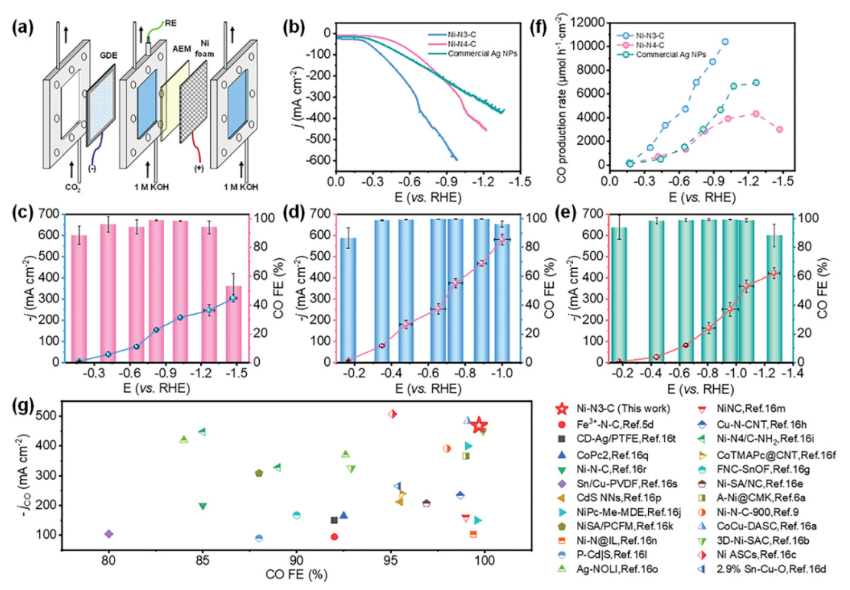
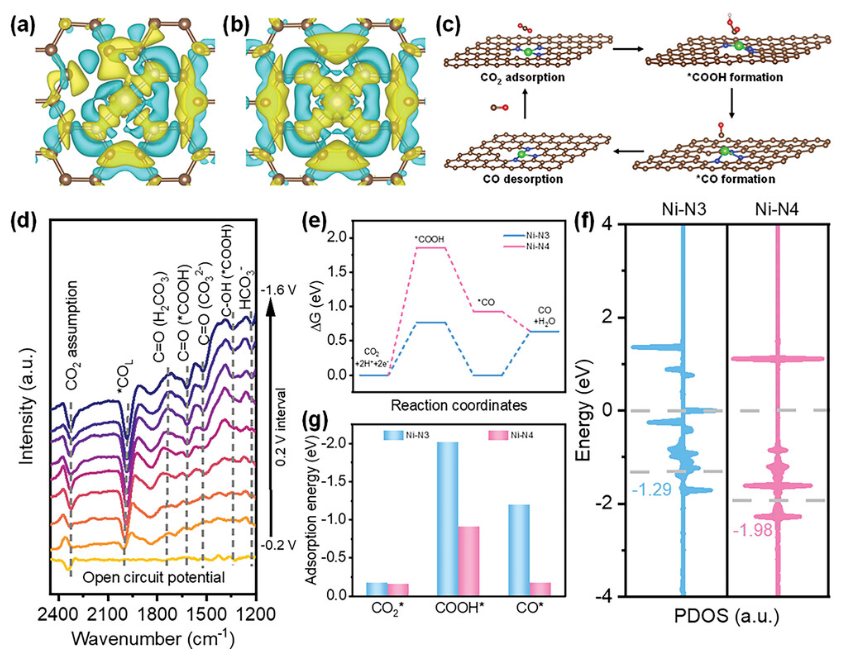
正文 如图1所示,作者制备了两种Ni SACs,其中[Bmim]2[NiCl4]的MILPs和N-丁基咪唑和NiCl2·6H2O的非MILPs分别与导电炭黑(CB)充分掺杂并进一步共热解得到Ni-N3 SACs (记为Ni-N3-C)和Ni-N4 SACs (记为Ni-N4-C)。 图1. 不同配位环境(Ni-NX)的SACs的合成工艺 Ni-N3-C和Ni-N4-C的扫描电子显微镜图像均显示出珊瑚状的多孔结构(图2a),这有利于CO2分子的传质促进CO2的电还原。透射电子显微镜(TEM)图像(图2b,c)表明,Ni-N3-C和Ni-N4-C的形貌类似于活性C或N-C,没有明显的纳米颗粒。同时,图2d中的X-射线衍射结果表明,NiOX-C的X-射线衍射谱中的主要峰可以被指标化为NiO相,而在其他样品中只有24.6°和43.4°的峰被检测到,并归因于石墨碳的(002)和(100)面。没有其他衍射峰进一步表明没有金属相或团簇。图2e的能量色散X-射线能谱(EDS)图谱表明,Ni和N成功地引入到碳基质中,并均匀分布在Ni-N3-C和Ni-N4-C中。作者用像差校正的高角度环形暗场扫描电子显微镜对Ni-N3-C和Ni-N4-C进行的原子尺度观察表明(图2f),Ni物种在Ni-N3-C中是原子分散的,没有纳米团簇(图2g)。电感耦合等离子体原子发射光谱(图2h)分析表明,Ni-N3-C和Ni-N4-C中的Ni含量分别为2.02wt%和1.91wt%。 图片来源:Adv. Funct. Mater 图3a中Ni-N3-C、Ni-N4-C和N- C的高分辨率N 1s光谱表明,Ni原子在Ni-N3-C和Ni-N4-C中主要与N原子结合。同时,Ni-N3-C和Ni-N4-C的高分辨Ni 2p谱说明了Ni-N3-C和Ni-N4-C中Ni原子的价态在0 ~ +2之间(图3b)。图3c中X-射线吸收光谱(XAS)进一步证实了Ni-N3-C和Ni-N4-C中Ni原子的价态在0 ~ +2之间。如图3d所示,Ni箔中Ni─Ni键在2.17 Å处明显存在,NiO中Ni─O键在1.60 Å处和Ni─Ni键在2.55 Å处明显存在,而Ni-N3-C和Ni-N4-C中Ni─Ni键几乎消失。Ni-N3-C和Ni-N4-C的主峰均位于1.41 Å附近,与Ni─N散射路径的主峰相对应。小波变换结果(图3e)证明了Ni SACs的成功制备,因为Ni原子只与N原子成键。根据定量EXAFS拟合结果(图3f、g)发现,非离子液体原料制备的Ni-N4-C中Ni─N配位数约为3.8±0.1,表明孤立的Ni原子与近4倍的N原子配位。而用[Bmim]2[NiCl4]的MILPs制备的Ni-N3-C中的Ni─N配位数仅为3.2±0.2,说明Ni-N3-C中主要由Ni和N原子形成Ni-N3中心。上述结果表明,用MILPs制备的Ni SACs可以降低Ni与N原子之间的配位数,生成以Ni-N3为中心的SACs。 作者对比图4a,b中的优化结构,[Bmim]+和N-丁基咪唑的阳离子中的4位N原子存在明显的电子结构差异。在图4c-h中,[Bmim]+中的电离4位N原子的Fukui函数值比N-丁基咪唑中的降低,表明[Bmim]+中4位N原子的性质更稳定。此外,这两种SACs中元素的原子含量也进一步证实了上述结论。如图4i所示,根据Ni原子含量对Ni-N3-C和Ni-N4-C中N原子的原子含量进行归一化后,Ni-N3-C中的N原子含量(6.03%)仅占Ni-N4-C中的72.30%(8.34%)。结果表明,MILPs策略对1位N原子的亲电性几乎没有影响,它主要是通过电离[Bmim]+中的4位N原子而不是N-丁基咪唑中的N原子来调节L壳层的电子结构,导致其热解过程中的亲电性和配位活性下降约50%,从而导致N原子含量较低,从而定向合成了以Ni-N3为中心的低配位SACs。 图5中的XAS精细结构表征证实,Co-N3-C和Zn-N3-C中分别仅存在Co─N或Zn─N键,而不存在金属键,这表明SACs的成功合成。在Co-N3-C或Zn-N3-C SACs中,孤立的金属原子Co或Zn均与三重N原子配位,这意味着MILPs策略对于M-N3中心定向合成SACs具有良好的普适性。总之,MILPs策略为SACs协调环境的调节开辟了一条前所未有的新途径。 在相同条件下,在H型电池中评估了Ni-N3-C、Ni-N4-C和其他样品(例如 N-C、NiOx-C和活化C)的eCO2-to-CO性能。结果表明,Ni-N3-C和Ni-N4-C均表现出比N-C、NiOx-C和活化C更好的起始电位,而Ni-N3-C的起始电位较低,且在相应的负电位下,电流响应值比Ni-N4-C更高。此外,如图6a、b所示,活化C的eCO2-to-CO性能仅为48.8% CO FE,在0.69 V下jCO为0.53 mA·cm−2。Ni-N3-C和Ni-N4-C的CO FE和jCO在不同电势下均优于其他电催化剂,进一步证实了SACs由于其独特的中心而具有优异的eCO2-to-CO性能。此外,MILPs制备的Ni-N3-C比Ni-N4-C表现出更好的eCO2-to-CO性能。在图6c中,Ni-N3-C和Ni-N4-C的ECSA分别为65.02和63.01 mF cm−2,大于其他电催化剂。最重要的是,作者进行了连续25小时的CO2电解实验来评估Ni-N3 SACs的稳定性(图6e),发现在长期电解过程中CO FEs稳定保持在90%以上,电流密度没有明显衰减。上述结果表明,MILPs策略调制的Ni-N3-C对eCO2-to-CO表现出优异的稳定性。 由于H型电池中CO2供应量低且传质不良,作者采用配备气体扩散电极(GDE)的流通池来改善上述困境,并研究了不同浓度的Ni SACs的eCO2-to-CO性能(图7a)。阴极和阳极均使用1 M KOH作为电解质。CO2进料引入单独的气室,并通过GDE直接扩散到催化剂/电解质界面使eCO2-to-CO。具体来说,Ni-N3-C在不同电位下的反应电流响应值明显大于Ni-N4-C以及商业Ag NPs(图7b),表明Ni-N3-C表现出最好的CO2催化活性。尽管 Ni-N4-C在-1.02 V下实现了98.3% CO FE的出色eCO2-to-CO性能和210.25 mA·cm−2的工业级jCO(图7c),但Ni-N3-C在−0.89 V下获得了467.55 mA·cm−2的超高 jCO(图 7d),甚至超过了商用Ag NPs在-0.96 V下获得的99.3% CO FE和250.18 mA·cm−2的最佳eCO2-to-CO性能(图7e)。此外,即使在-1.00 V的更负电位下,Ni-N3-C可以实现96.2% CO FE和558.41 mA·cm−2的jCO的卓越性能(图7f),优于Ni-N4-C和商业Ag NP两倍以上。与文献中报道的电催化剂的eCO2-to-CO性能相比(图7g),通过MILPs策略调制的Ni-N3-C无论是CO选择性还是部分电流密度,几乎超过了其他电催化剂,是目前最先进的eCO2-to-CO电催化剂之一。 为了进一步揭示不同Ni─N配位环境对Ni SACs电子结构的影响,作者在VASP软件包中进行DFT计算。以Ni-N3和Ni-N4为中心的SAC的电荷密度差结果分别如图8a、b所示。证实了Ni-N3结构中Ni原子周围的负电荷比Ni-N4位点更利于CO2分子的吸附和转化。如图8c的反应路径,CO2分子首先吸附在Ni单原子中心,获得电子并偶联质子后形成*COOH中间体,进一步获得电子和质子,生成*CO和H2O。最后,通过*CO的解吸产生气态CO。如图 8d 所示,原位ATR-SEIRAS结果证实电催化剂表面存在*COOH和*CO中间体,这与eCO2-to-CO的路径和DFT计算的假设一致。 作者计算了具有不同Ni─N配位环境的Ni SACs上eCO2-to-CO路径中各中间体的自由能,结果如图8e所示。发现eCO2-to-CO路径中的关键*COOH 中间体更容易在Ni-N3位点上进行。此外,作者进一步深入研究了其电子结构的差异(图8f)。Ni-N3中心的Ni 3d电子态部分密度(PDOS)的计算d带中心为-1.29 eV,比Ni-N4位点的-1.98 eV更正,有利于提高中间体在Ni单原子位点的吸附能力。Ni 3d PDOS在不同Ni─N配位环境下的差异可以很好地解释中间体和低配位Ni-N3中心之间的吸附能高于Ni-N4位点 (图8g)。结果表明,Ni-N3位点的配位环境可以更强地吸附*COOH关键中间体,加速eCO2-to-CO,从而提高催化活性和反应速率,这也与较高电流密度的结果很好地吻合。 总结
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn