

(图片来源:Angew. Chem. Int. Ed.)
正文
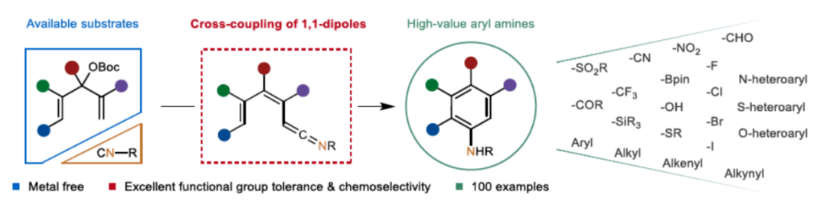
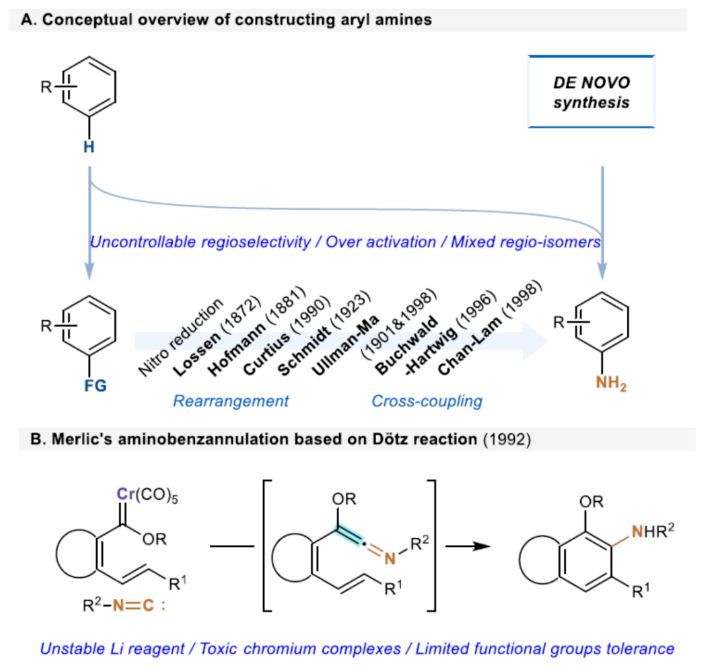
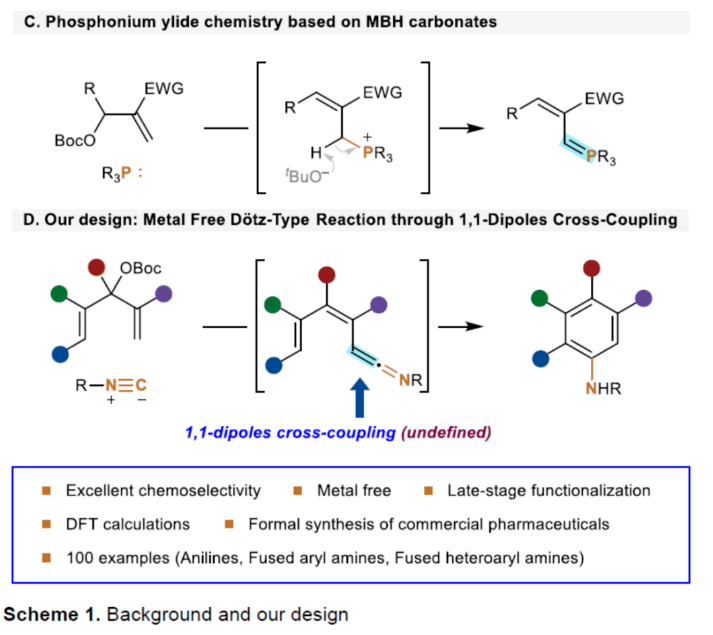
芳基胺骨架广泛存在于各类天然产物、药物和有机材料中,通过硝基还原、Curtis、Schmidt和其它重排策略是合成芳基胺的一个成熟且不断改进的领域(Scheme 1A)。Ullmann-Ma、Buchwald-Hartwig、Chan-Lam和其它交叉偶联反应已经彻底改变了这一领域,并在工业中得到了广泛的应用。此外,电/光化学芳香族C-H键的胺化为构建这些重要的骨架提供了一种更为经济的方法。然而,此类反应常存在使用特定的预官能团化的底物、特定的导向基团、位点选择性、过度活化等问题。相比之下,芳胺的从头合成可以通过设计合理的底物来规避芳香族化学的选择性问题。1992年,Merlic课题组(J. Am. Chem. Soc. 1992, 114, 8722.)利用异氰化物和Fisher铬卡宾精心构建了烯酮亚胺,并实现了Dötz-型氨基苯环化反应(Scheme 1B)。然而,氨基苯环化经常伴随着茚和环丁烯酮的形成,并且表现出有限的官能团耐受性。尽管多步合成铬配合物可以在一定程度上解决这个问题,但化学计量不稳定的有机锂试剂和有毒铬配合物的不可避免的使用限制了其进一步发展,因此仍然迫切需要更简洁、更安全的合成策略。近年来,异氰化物参与的Ugi反应、Passerini反应以及[1+n]偶极环加成反应备受关注。理论上,两个1,1-偶极子的偶联可以得到一个双键。相应地,当使用异氰化物作为关键的反应底物时,可以获得相应的烯酮亚胺。基于黄有课题组(Org. Lett. 2022, 24, 1593; Org. Lett. 2019, 21, 2843; Eur. J. Org. Chem. 2014, 2014, 1189.)对鏻叶立德化学的广泛研究(Scheme 1C),这里,南开大学黄有课题组报道了一种全新的无金属参与的异氰化物和Morita-Baylis-Hillman(MBH)碳酸酯的Dötz-型氨基苯环化反应。更具体地说,亲核进攻和E2消除过程促进了交叉偶联过程,导致烯酮亚胺的形成。随后的6π-电环化和芳构化过程完成了Dötz-型反应(Scheme 1D)。下载化学加APP到你手机,更加方便,更多收获。
(图片来源:Angew. Chem. Int. Ed.)
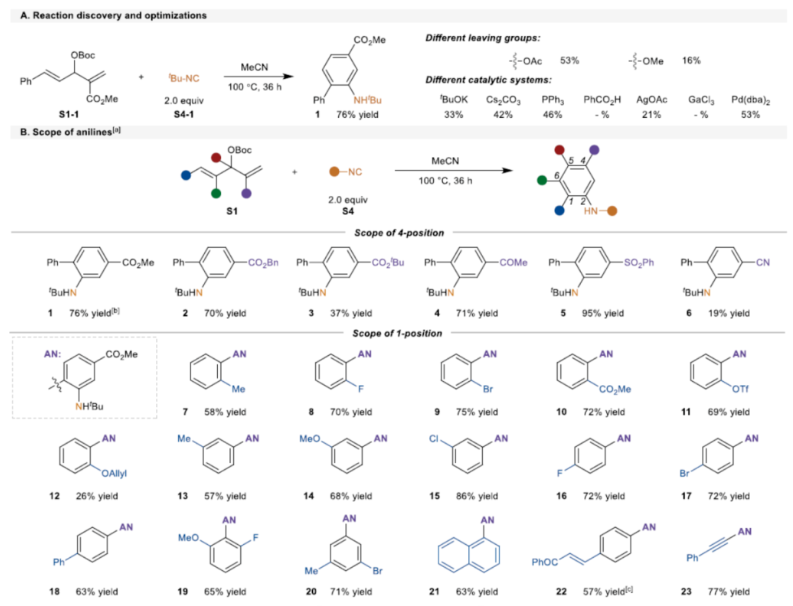
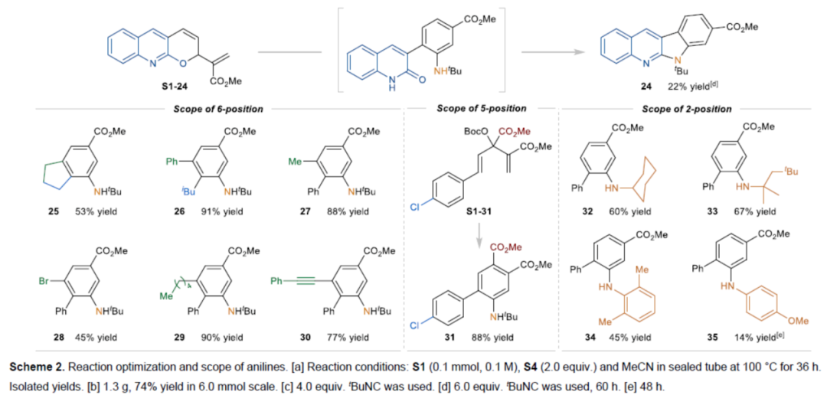
首先,作者以MBH 碳酸酯S1-1与异氰化物S4-1(2.0 eq.)作为模型底物,进行了相关反应条件的筛选(Scheme 2A)。当在乙腈溶剂中100 oC反应36 h,可以76%的收率得到产物1。
在获得上述最佳反应条件后,作者对苯胺的范围进行了扩展(Scheme 2B)。首先,当底物中含有各种吸电子基团(如烷氧羰基、乙酰基、苯基磺酰基和氰基)时,均可顺利进行反应,获得相应的4-位不同取代的苯胺产物2-6,收率为19-95%。同时,苯胺产物中的邻位取代基团可以是芳基、烯基、炔基或烷基,如7-23,收率为26-77%。其次,2-氯-3-甲醛衍生的MBH加合物S1-24,可以24%的收率得到产物24。三取代烯基MBH碳酸酯,也是合适的底物,获得相应的产物25-26,收率为53-91%。苯胺产物中的6-位取代基团可以是卤素、烷基和炔基,如27-30,收率为45-90%。烯基酮酸酯衍生的底物,可以88%的收率得到产物31。此外,各种异氰化物S4还可与MBH碳酸酯S1-1顺利反应,获得相应的苯胺产物32-35,收率为14-67%。
(图片来源:Angew. Chem. Int. Ed.)
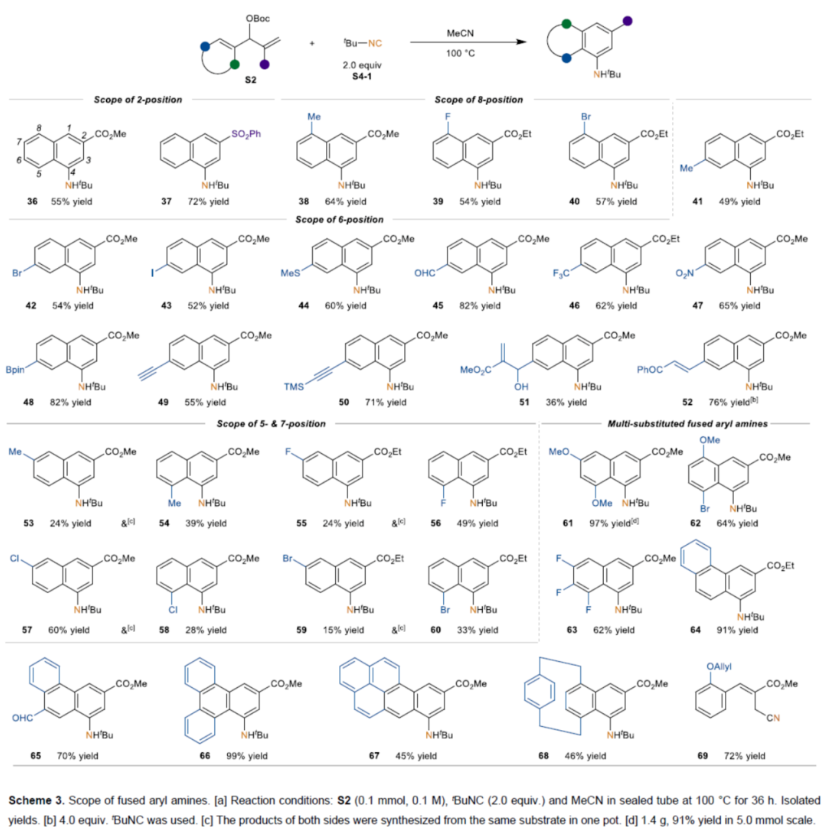
随后,作者对稠合芳基胺的范围进行了扩展(Scheme 3)。首先,2-取代的苯基MBH碳酸酯,可顺利进行反应,获得相应的2,8-取代的萘胺产物36-40,收率为54-72%。多种4-取代苯基MBH碳酸酯,也能够平稳反应,获得相应的2,6-取代萘胺产物41-52,收率为36-82%。3-取代的苯基MBH碳酸酯,也与体系兼容,同时获得相应的2,5-和2,7-取代的萘胺产物53-60,总收率为48-88%。此外,通过该策略还可合成一系列多取代稠合苯胺产物61-69,收率为46-99%。
(图片来源:Angew. Chem. Int. Ed.)
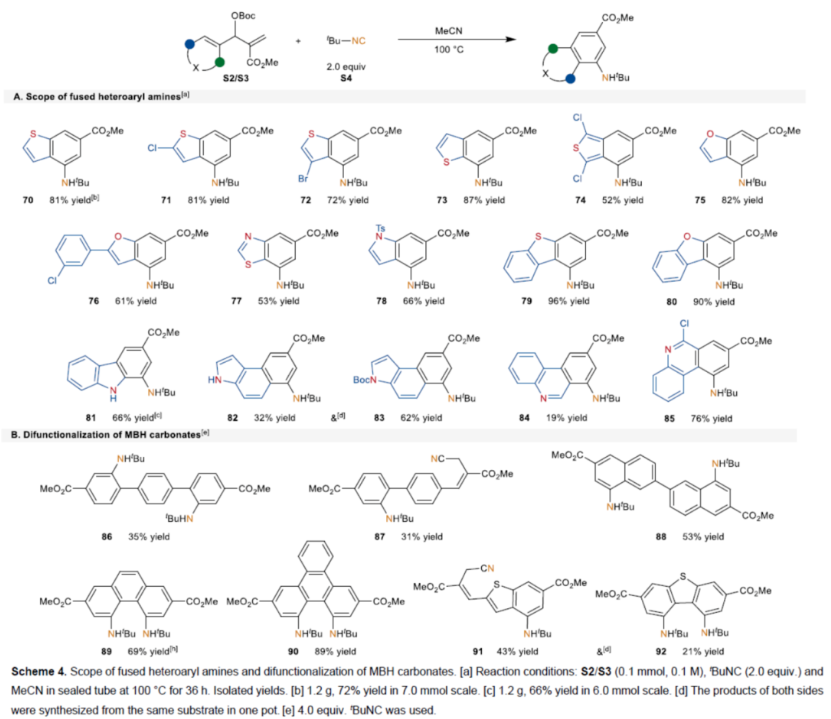
同时,一系列含有S-、O-和N-杂芳基的底物,均可顺利进行反应,获得相应的稠合杂芳基胺产物70-85,收率为19-96%(Scheme 4A)。并且,对于双取代的MBH碳酸酯底物,反应能够顺利进行双官能化反应,获得相应的稠合产物86-92,收率为31-89%
(图片来源:Angew. Chem. Int. Ed.)
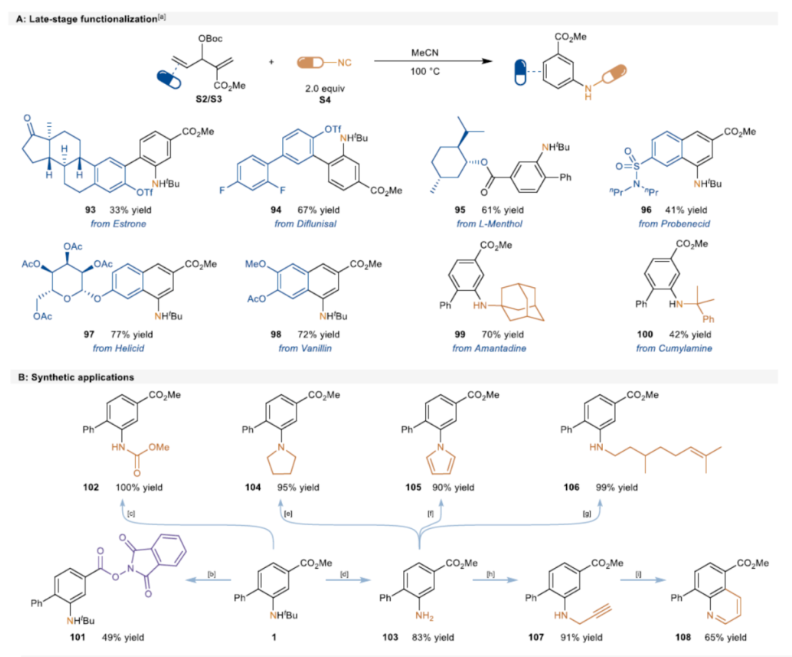
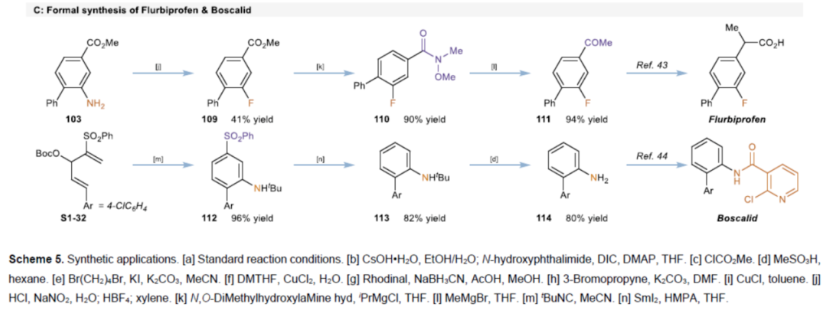
紧接着,作者对反应的实用性进行了研究(Scheme 5)。首先,该策略可用于一些生物活性分子的后期衍生化,获得相应的产物93-100,收率为33-77%(Scheme 5A)。其次,1可进行多种转化,获得一系列含氮化合物101-108,收率为49-100%(Scheme 5B)。此外,以103为底物,通过Sandmeyer反应,可生成氟苯中间体109。然后,在两种Grignard试剂的介导下通过Weinreb酰胺中间体110可进一步转化为苯乙酮中间体111,这是合成氟比洛芬的关键中间体(Scheme 5C)。同时,通过该方法可以有效地构建苯基磺酰基取代的苯胺112,并在随后的苯磺酰基和叔丁基保护基脱除后,能够合成啶酰菌胺的关键中间体114。
(图片来源:Angew. Chem. Int. Ed.)
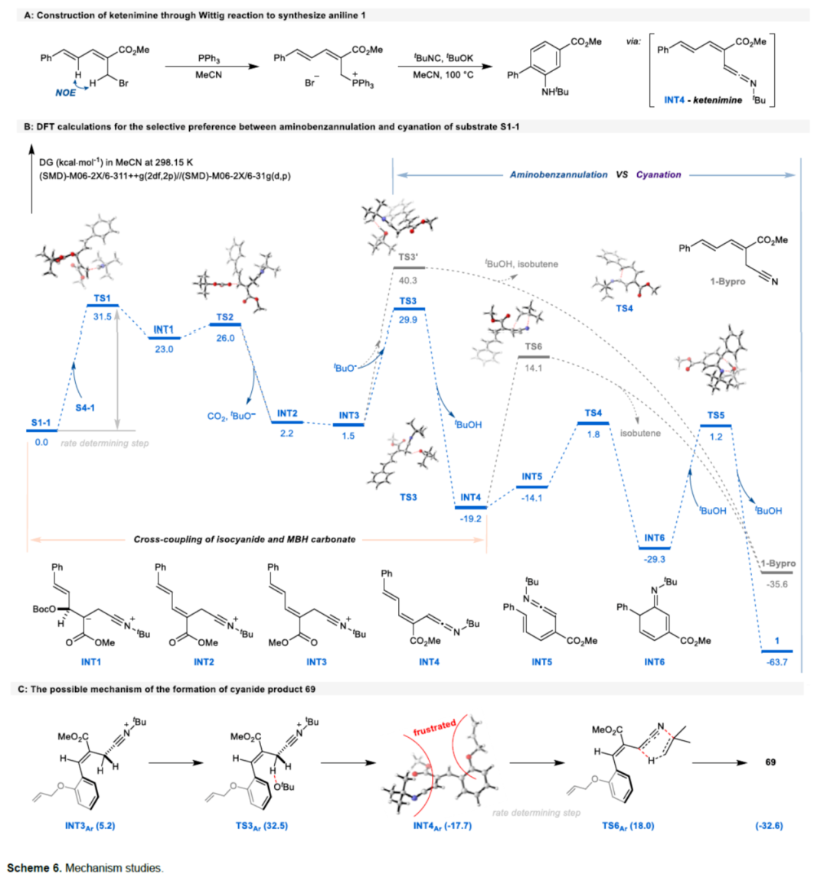
最后,作者还对反应机理进行了进一步的研究(Scheme 6A)。通过Wittig反应制备了一种关键中间体,该中间体可在标准条件下反应,并以25%的收率得到苯胺衍生物1,进一步证实了1,1-偶极交叉偶联途径。同时,作者还通过DFT计算,进一步阐明反应途径以及反应的选择性(Scheme 6B)。首先,异氰化物通过亲核性进攻MBH碳酸酯以启动SN2'过程,原位生成CO2、tBuO−和INT2。tBuO−能够促进E2消除,以实现交叉偶联并形成烯酮亚胺INT4。随后的6π-电环化(TS4)和tBuOH辅助芳构化(TS5)串联过程,可实现Dötz-型氨基苯环化反应。值得注意的是INT3和INT4可以分别进行E1cb消除(TS3’)和逆Ene反应(TS6),生成化合物69。研究结果表明,氨基苯环化在热力学和动力学上比氰化更有利。然而,在生成69的反应中,空间位阻大的烯丙氧基使相应的烯酮亚胺构型不适合6π-电环化(Scheme 6C)。这种情况突出了这种氨基苯环化反应的潜在化学选择性,并为利用异氰化物作为氰源提供了新的途径。
(图片来源:Angew. Chem. Int. Ed.)
总结
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn