- 首页
- 资讯
师徒两代两篇JACS:两种(+)-Ineleganolide全合成策略
来源:化学加原创 2023-08-28
导读:近期,美国加州理工学院Brian M. Stoltz课题组报道了一种呋喃丁烯内酯(furanobutenolide)衍生的二萜(+)-Ineleganolide的汇聚性全合成。其中,该方法依赖于两个对映富集砌块(分别衍生自(-)-芳樟醇和(+)-去甲香芹酮(norcarvone))的汇聚性偶联过程。一种高收率、一步Michael加成和Aldol串联反应,可获得一种具有单一非对映异构体的五环骨架,从而克服了前期在立体化学控制方面的挑战。O2-促进的C-H氧化和二碘化钐诱导的Semipinacol重排,可构建具有高度刚性中心的七元环骨架。文章链接DOI:10.1021/jacs.3c02142。值得一提的是,Stoltz的导师John L. Wood教授也曾于2022年在JACS发表过(+)-Ineleganolide的全合成(DOI:10.1021/jacs.2c09826)
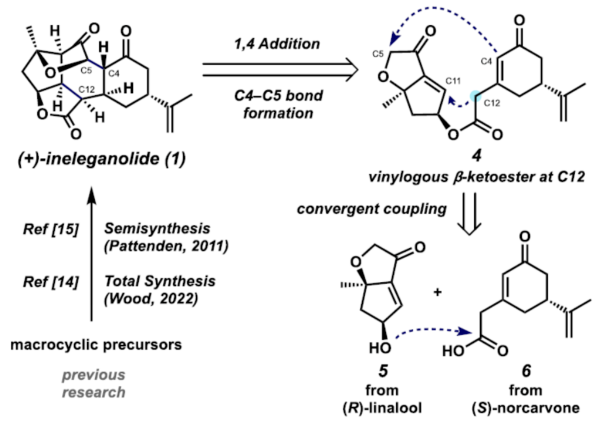
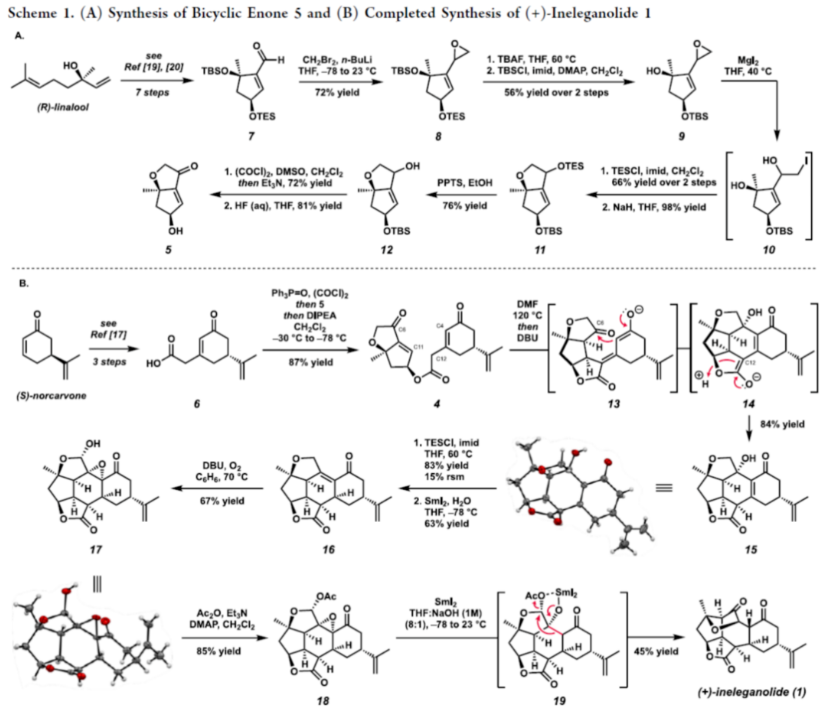
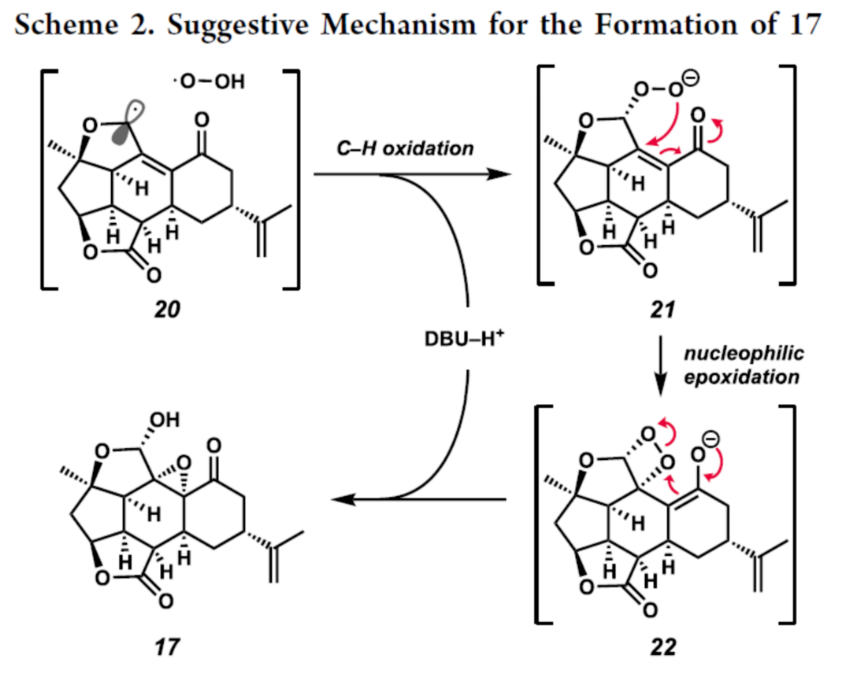
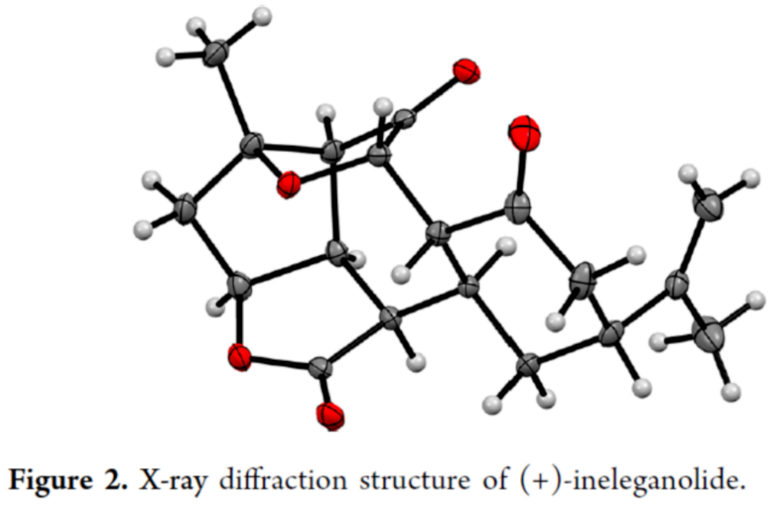
Cembranoid和Norcembranoid二萜是从软珊瑚物种中分离出来的一大类天然产物。由于其独特、高度复杂的结构,呋喃丁烯内酯衍生的二萜类化合物在过去几十年中受到了合成化学家的极大关注。这些分子的一个子类包含大环结构,如神经毒素Lophotoxin(2),其作为烟碱型乙酰胆碱受体的不可逆抑制剂(Figure 1)。在生物合成方面,这些大环可进行进一步的修饰,以生成密集官能团化的多环骨架。这些结构的一个典型例子反映在Bielschowskysin(3)中,它显示出对非小细胞肺癌和癌症有很好的细胞毒性。1999年,Duh课题组从Formosan软珊瑚Sinularia inelegans中分离出Ineleganolide(1)。它已显示出对P-380白血病细胞系的初步细胞毒性。从结构上讲, Ineleganolide含有一个高度刚性的氧化骨架,该骨架含有一个关键的中心七元环、一个远端异丙烯基和一个桥接的β-酮基四氢呋喃单元。由于其独特且具有挑战性的骨架,在过去的二十年里,合成Ineleganolide一直是一个尚未解决的难题。2022年,John L. Wood课题组(J. Am. Chem. Soc. 2022, 144, 20539.)首次实现了Ineleganolide的全合成。在优雅地构建大环前体之后,Wood课题组能够通过跨环Michael加成形成最后一个键,类似于Pattenden课题组(Tetrahedron 2011, 67, 10045.)在2011年报道1的仿生半合成那样,分别以34.5%的收率合成了Sinulochmodin C和以11.5%的收率合成了Ineleganolide。除了上述的两种合成Ineleganolide策略以外,作者通过逆合成分析发现,Ineleganolide还可通过乙烯基β-酮基酯衍生物4经1,4-加成反应生成,而4可通过羧酸衍生物6和醇衍生物5的汇聚性偶联反应制备。下载化学加APP到你手机,更加方便,更多收获。 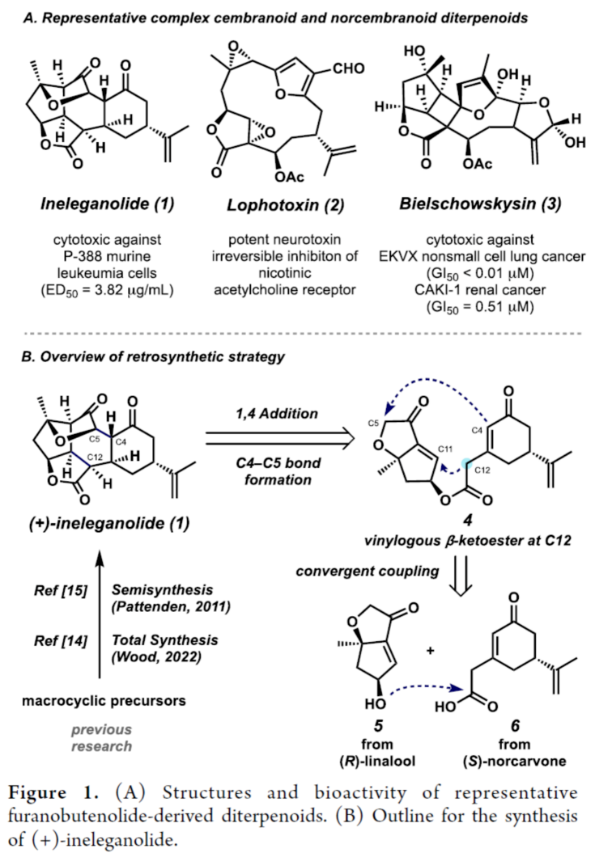 双环烯酮砌块5的合成(Scheme 1A)。以(R)-芳樟醇为初始底物,根据相关的文献(Science 2016, 352, 1078; J. Am. Chem. Soc. 2022, 144, 20232.),经七步反应后,可生成醛中间体7。醛中间体7在CH2Br2/n-BuLi/THF条件下进行环化反应,可以72%的收率得到环氧化物8。环氧化物8中的两个硅基可在TBAF/THF条件下脱除,然后使用TBSCl可选择性对二级醇进行硅基化反应,以两步56%的总收率得到三级醇中间体9。中间体9在MgI2/THF条件下进行开环反应(生成碘代醇中间体10),使用TBSCl对二级醇进行选择性的硅基化反应,可以两步66%的总收率得到双硅基保护的三级醇中间体。双硅基保护的三级醇中间体在NaH/THF条件下进行分子内取代反应,可以98%的收率得到双环中间体11。双环中间体11在PPTS/EtOH条件下进行选择性的脱保护,可以76%的收率得到醇中间体12。醇中间体12发生Swern氧化反应,可以72%的收率得到烯酮中间体。烯酮中间体在HF水溶液进行脱保护,可以81%的收率得到双环烯酮砌块5。砌块15的合成(Scheme 1B)。以(S)-去甲香芹酮为底物,根据相关的文献(Chem. Sci. 2017, 8, 507.),经三步反应后,可生成羧酸中间体6。通过进一步的条件优化后发现,羧酸中间体6在Ph3P=O/(COCl)2/DIPEA条件下进行酯化反应,可以87%的收率得到酯中间体4。酯中间体4在DMF溶剂中进行高温(即120 oC)加热,随后加入DBU进行分子内Michael加成反应,可以84%的收率得到五环中间体15。机理研究表明,酯中间体4首先进行Michael加成反应,实现了C12-C11键的构建。C12-位的第二个质子(即14)可以再次被攫取,生成共轭烯醇化物13。烯醇化物13可在C4-位与相邻的羰基进行Aldol加成并异构化,生成中间体14。在sp2-杂化的情况下,C12-位的烯醇化物优先从凸面质子化,从而得到15作为单个非对映异构体。总的来说,这种Michael加成和Aldol串联反应,可以高收率构建两个键和四个手性中心,且为单一的非对映体,这对于C12-位的立体化学至关重要。砌块17的合成(Scheme 1B)。五环中间体15在TESCl/imid/THF条件下对三级醇进行选择性的硅基化反应,可以83%的收率得到硅基保护的中间体。硅基保护的中间体可在SmI2/H2O/THF条件下进行还原消除,可以63%的收率得到烯酮中间体16。烯酮中间体16在DBU/O2条件下进行氧化,可以67%的收率得到环氧化物半缩醛17。值得注意的是,上述的氧化过程中三重态氧可以促进自由基H原子的攫取,在烯酮的γ-位形成高度稳定的captodative自由基20。在自由基重组时,可以形成初始过氧化物,其可以被去质子化以形成化合物21(Scheme 2)。在碱性条件下,过氧阴离子21可与烯酮进行分子内亲核环氧化,生成中间体22。中间体22可进一步转化为环氧化物半缩醛17。(+)-Ineleganolide(1)的全合成(Scheme 1B)。环氧化物半缩醛17在Ac2O/Et3N/DMAP条件下进行乙酰化反应后,可以85%的收率得到乙酰化中间体18。乙酰化中间体18在SmI2/THF/NaOH条件下进行Semipinacol重排,可以45%的收率得到(+)-Ineleganolide(1)。值得注意的是,通过X-射线晶体结构,进一步确认了(+)-Ineleganolide(1)的立体化学信息(Figure 2)。美国加州理工学院Brian M. Stoltz课题组报道了一种以(-)-芳樟醇为初始底物,通过23步反应,实现了(+)-Ineleganolide的汇聚性全合成。该汇聚性策略依赖于两个对映富集砌块的偶联过程(5+6→4)。同时,通过使用三苯基氧化膦和草酰氯作为活化试剂,可促进上述的酯化过程。此外,通过Michael加成和Aldol串联反应,可获得一种具有单一非对映异构体的五环骨架(4→15)。在后期阶段,作者发现了一种独特的空气氧化和环氧化的串联过程,从而实现了所需的氧化模式(16→17)。最终,通过二碘化钐诱导的Semipinacol重排,实现了(+)-Ineleganolide的全合成(18→1)。
双环烯酮砌块5的合成(Scheme 1A)。以(R)-芳樟醇为初始底物,根据相关的文献(Science 2016, 352, 1078; J. Am. Chem. Soc. 2022, 144, 20232.),经七步反应后,可生成醛中间体7。醛中间体7在CH2Br2/n-BuLi/THF条件下进行环化反应,可以72%的收率得到环氧化物8。环氧化物8中的两个硅基可在TBAF/THF条件下脱除,然后使用TBSCl可选择性对二级醇进行硅基化反应,以两步56%的总收率得到三级醇中间体9。中间体9在MgI2/THF条件下进行开环反应(生成碘代醇中间体10),使用TBSCl对二级醇进行选择性的硅基化反应,可以两步66%的总收率得到双硅基保护的三级醇中间体。双硅基保护的三级醇中间体在NaH/THF条件下进行分子内取代反应,可以98%的收率得到双环中间体11。双环中间体11在PPTS/EtOH条件下进行选择性的脱保护,可以76%的收率得到醇中间体12。醇中间体12发生Swern氧化反应,可以72%的收率得到烯酮中间体。烯酮中间体在HF水溶液进行脱保护,可以81%的收率得到双环烯酮砌块5。砌块15的合成(Scheme 1B)。以(S)-去甲香芹酮为底物,根据相关的文献(Chem. Sci. 2017, 8, 507.),经三步反应后,可生成羧酸中间体6。通过进一步的条件优化后发现,羧酸中间体6在Ph3P=O/(COCl)2/DIPEA条件下进行酯化反应,可以87%的收率得到酯中间体4。酯中间体4在DMF溶剂中进行高温(即120 oC)加热,随后加入DBU进行分子内Michael加成反应,可以84%的收率得到五环中间体15。机理研究表明,酯中间体4首先进行Michael加成反应,实现了C12-C11键的构建。C12-位的第二个质子(即14)可以再次被攫取,生成共轭烯醇化物13。烯醇化物13可在C4-位与相邻的羰基进行Aldol加成并异构化,生成中间体14。在sp2-杂化的情况下,C12-位的烯醇化物优先从凸面质子化,从而得到15作为单个非对映异构体。总的来说,这种Michael加成和Aldol串联反应,可以高收率构建两个键和四个手性中心,且为单一的非对映体,这对于C12-位的立体化学至关重要。砌块17的合成(Scheme 1B)。五环中间体15在TESCl/imid/THF条件下对三级醇进行选择性的硅基化反应,可以83%的收率得到硅基保护的中间体。硅基保护的中间体可在SmI2/H2O/THF条件下进行还原消除,可以63%的收率得到烯酮中间体16。烯酮中间体16在DBU/O2条件下进行氧化,可以67%的收率得到环氧化物半缩醛17。值得注意的是,上述的氧化过程中三重态氧可以促进自由基H原子的攫取,在烯酮的γ-位形成高度稳定的captodative自由基20。在自由基重组时,可以形成初始过氧化物,其可以被去质子化以形成化合物21(Scheme 2)。在碱性条件下,过氧阴离子21可与烯酮进行分子内亲核环氧化,生成中间体22。中间体22可进一步转化为环氧化物半缩醛17。(+)-Ineleganolide(1)的全合成(Scheme 1B)。环氧化物半缩醛17在Ac2O/Et3N/DMAP条件下进行乙酰化反应后,可以85%的收率得到乙酰化中间体18。乙酰化中间体18在SmI2/THF/NaOH条件下进行Semipinacol重排,可以45%的收率得到(+)-Ineleganolide(1)。值得注意的是,通过X-射线晶体结构,进一步确认了(+)-Ineleganolide(1)的立体化学信息(Figure 2)。美国加州理工学院Brian M. Stoltz课题组报道了一种以(-)-芳樟醇为初始底物,通过23步反应,实现了(+)-Ineleganolide的汇聚性全合成。该汇聚性策略依赖于两个对映富集砌块的偶联过程(5+6→4)。同时,通过使用三苯基氧化膦和草酰氯作为活化试剂,可促进上述的酯化过程。此外,通过Michael加成和Aldol串联反应,可获得一种具有单一非对映异构体的五环骨架(4→15)。在后期阶段,作者发现了一种独特的空气氧化和环氧化的串联过程,从而实现了所需的氧化模式(16→17)。最终,通过二碘化钐诱导的Semipinacol重排,实现了(+)-Ineleganolide的全合成(18→1)。文献详情:
Benjamin M. Gross, Seo-Jung Han, Scott C. Virgil, Brian M. Stoltz*. A Convergent Total Synthesis of (+)-Ineleganolide. J. Am. Chem. Soc. 2023, https://doi.org/10.1021/jacs.3c02142
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn