- 首页
- 资讯
OL首任主编最新JACS:Neaumycin B的全合成
来源:化学加原创 2023-08-21
导读:近日,美国宾夕法尼亚大学Amos B. Smith, III课题组(Org. Lett.杂志的创始主编,今年已79岁)报道了一种大环内酯类天然产物Neaumycin B(1)的立体选择性全合成,在90 mg规模上的总收率为2.3%。该合成以克级规模的镍催化还原交叉偶联/螺缩酮化为关键步骤,构建了Neaumycin B中螺环缩酮骨架。合成Neaumycin B的C3-C6、C8-C14和C20-C41片段的立体结构通过X-射线晶体学得到了明确的验证。文章链接DOI:10.1021/jacs.3c06573
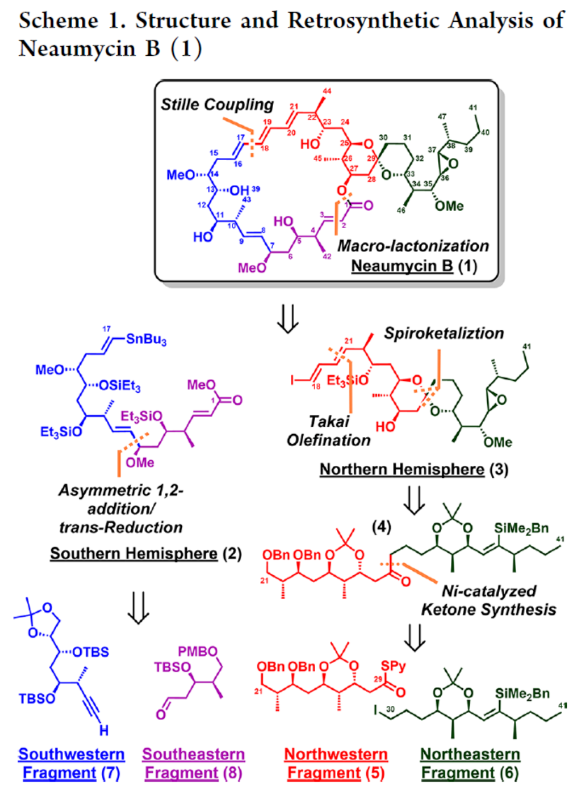
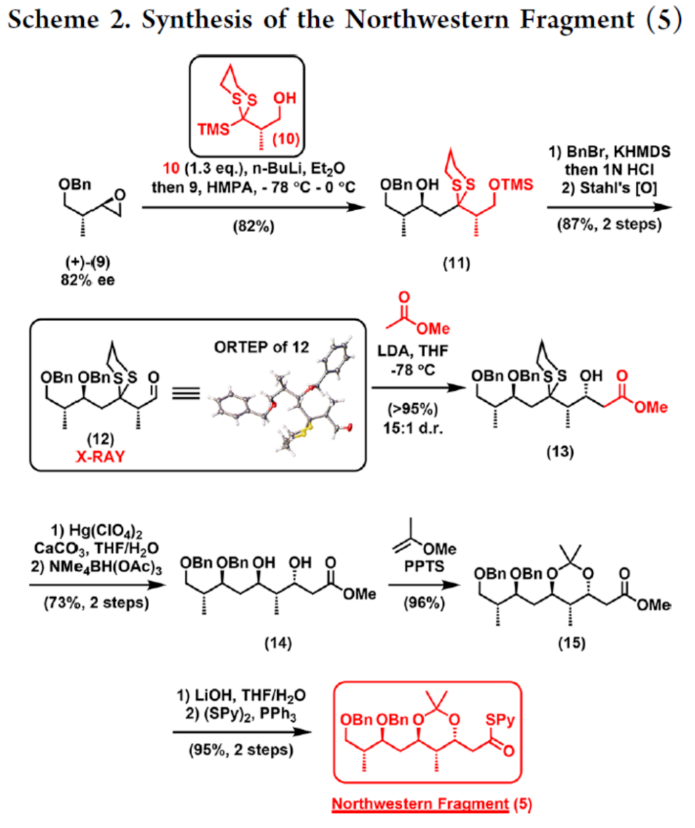
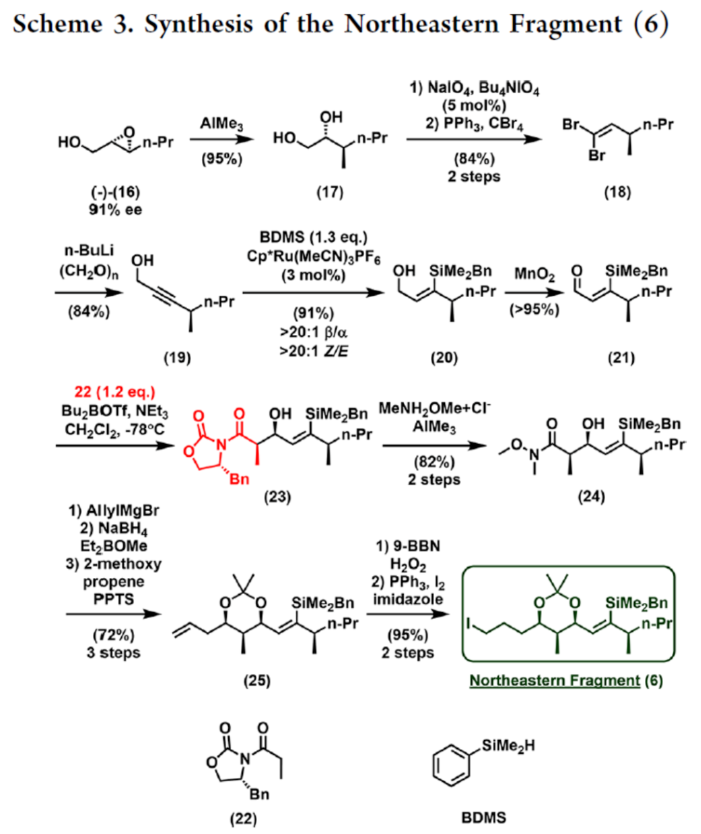
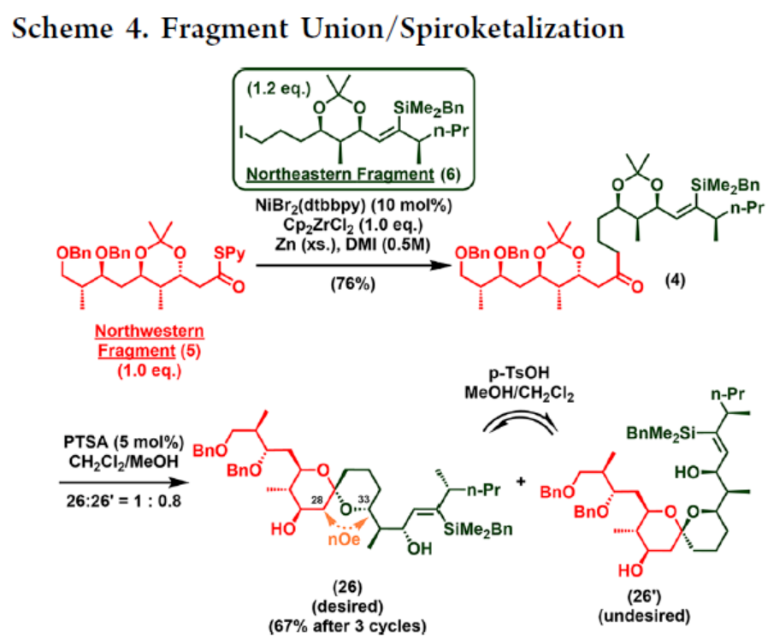
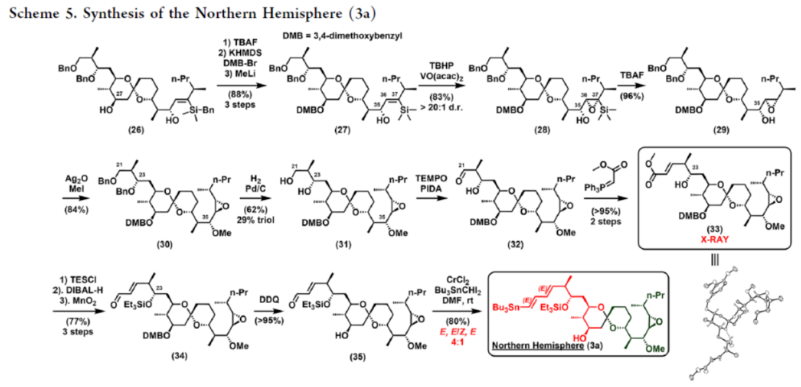
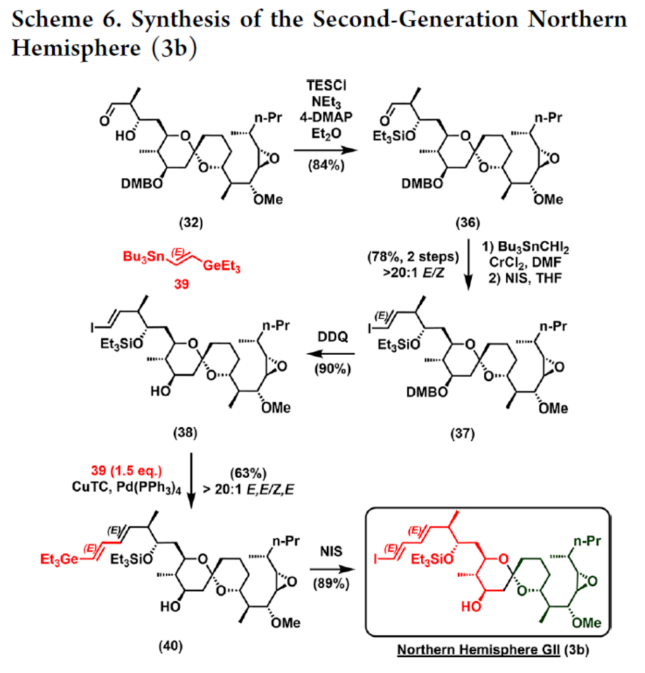
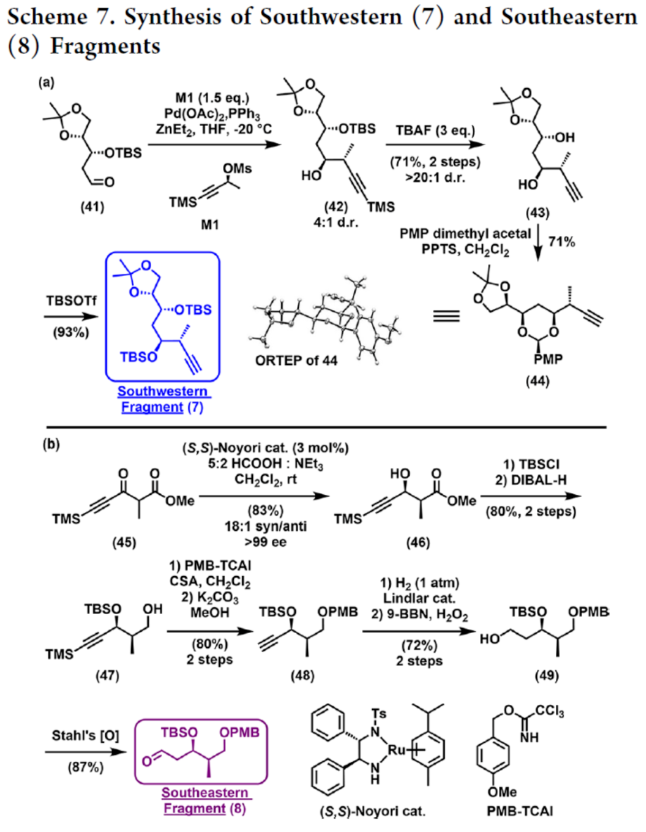
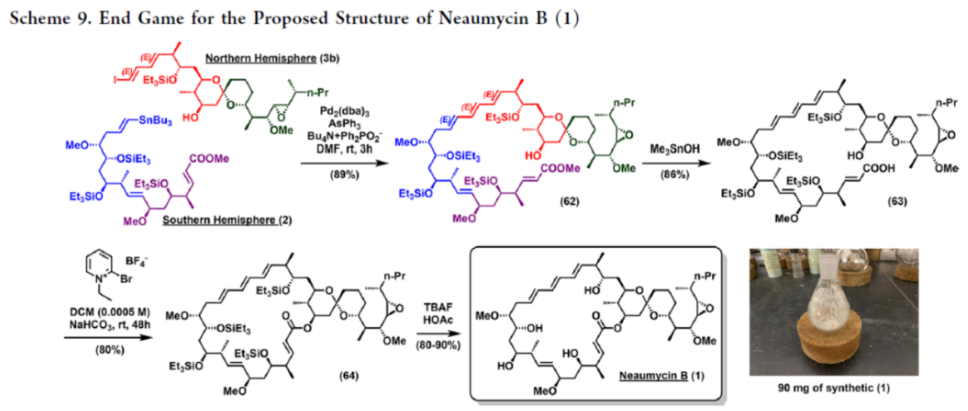
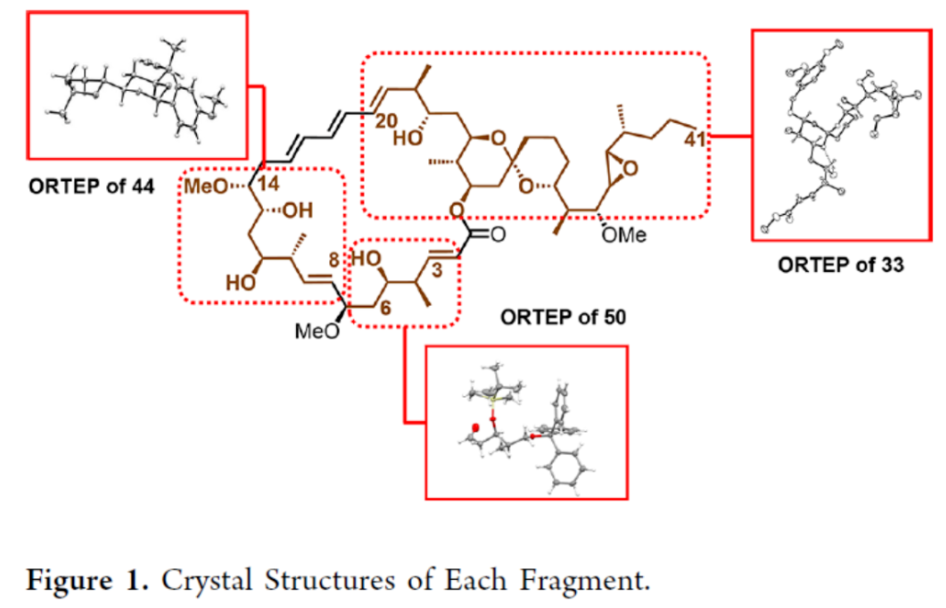
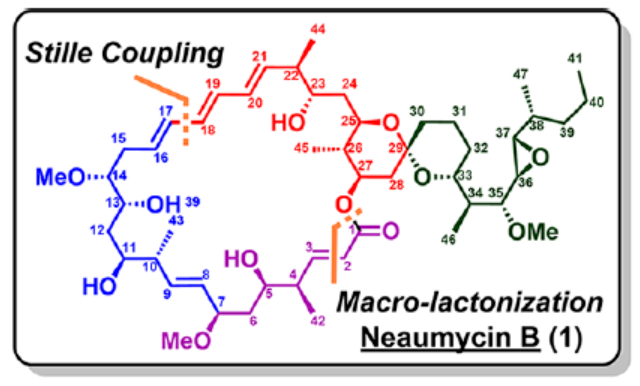 2012年,沈奔团队从土壤放线菌链霉菌Streptomyces sp.NEAU-x21中分离出第一个Neaumycin同源物。2015年,通过对Neaumycin的结构进行了实质性修改,分离出了Neaumycin A和同类Neaumycin B,但没有相关的立体化学。2018年,Jenson和Fenical等课题组从巴哈马群岛采集的热带褐藻Stypodium zonale的表面分离出一种海洋微生物小单孢菌属(菌株 CNY-010)的物质。基因组数据和2D NMR研究的结合导致Neaumycin B的归属为1。Neaumycin B针对几种癌症细胞系的初步体外研究显示出显著的效力,特别是对U87人胶质母细胞瘤的选择性。Neaumycin B的生物活性有望成为药物设计的先导结构。因此,开发新型Neaumycin B(1)的全合成具有重要意义。近日,美国宾夕法尼亚大学Amos B. Smith, III课题组首次实现了Neaumycin B(1)的全合成。通过逆合成分析发现(Scheme 1),Neaumycin B(1)可由砌块2和3合成。砌块3可由砌块5与6制备。砌块2可由砌块7与8通过不对称1,2-加成制备。下载化学加APP到你手机,更加方便,更多收获。砌块5的合成(Scheme 2)。环氧化物(+)-9与二噻烷10通过Brook重排/环氧化物开环的串联过程,可以82%的收率得到中间体11。中间体11经苄基保护、三甲基硅基醚水解与Cu/TEMPO催化的有氧氧化反应,可以两步87%的总收率得到醛中间体12。中间体12与衍生自乙酸甲酯的烯醇化物进行Felkin-Anh选择性Aldol反应,可以>95%的收率得到中间体13,dr为15:1。中间体13经二硫代缩醛水解以及Evans-Saksena还原反应后,可以两步73%的总收率得到中间体14。中间体14通过进一步的1,3-二醇保护后,可以96%的收率得到中间体15。中间体15通过甲酯的皂化和随后的硫酯化反应,可以两步95%的收率得到砌块5。砌块6的合成(Scheme 3)。以环氧醇(-)-16为底物,通过区域选择性开环,可以95%的收率得到二醇中间体17。中间体17通过双相的高碘酸盐的断裂和二溴-烯化反应,可以两步84%的收率得到二溴中间体18。中间体18与n-BuLi和甲醛反应后,可以84%的收率得到炔丙醇中间体19。中间体19通过钌催化羟基导向反式硅氢化反应,可以91%的收率得到醇中间体20,Z/E > 20:1,β/α > 20:1。中间体20在使用MnO2氧化后,可以>95%的收率得到醛中间体21。中间体21可与化合物22进行Evans Aldol以及酰胺基转移反应(transamidation),可以两步82%的收率得到酰胺中间体24。中间体24与烯丙基溴化镁进行单加成生成β-羟基酮,随后通过Narasaka-Prasad还原和缩醛保护后,可以三步72%的收率得到中间体25。中间体25通过硼氢化、氧化以及Appel反应,可以两步95%的收率得到砌块6。砌块26的合成(Scheme 4)。中间体5和6通过镍催化还原交叉偶联反应,可以76%的收率得到中间体4。中间体4经脱保护/螺缩酮化反应,可以1:0.8的混合物形式合成中间体26和差向异构体26’,其可通过色谱分离。令人高兴的是,将差向异构体26’暴露于相同的酸性条件下重新建立了平衡,从而允许在每次色谱分离/再平衡时获得中间体26,可以67%的总收率得到中间体26。砌块3a的合成(Scheme 5)。中间体26在TBAF/KHMDS与DMB-Br/MeLi条件下,可以三步88%的收率得到中间体27。中间体27通过环氧化后,可以83%的收率得到中间体28,dr > 20:1。中间体28在使用TBAF进行去硅基化后,可以96%的收率得到中间体29。中间体29在Ag2O/MeI进行甲基化后,可以84%的收率得到中间体30。中间体30通过氢解后,可以62%的收率得到二醇中间体31。中间体31在TEMPO/PIDA条件下进行化学选择性氧化,随后与三苯基膦试剂反应,可以两步>95%的收率得到中间体33。中间体33通过三乙基硅基保护、酯的还原和MnO2的氧化反应,可以三步77%的收率得到中间体34。中间体34使用DDQ进行脱保护后,可以>95%的收率得到中间体35。中间体35通过Takai-Utimoto烯化反应,可以80%的收率得到中间体3a,(E,E)/(Z,E)为4:1。砌块3b的合成(Scheme 6)。中间体32通过三乙基硅基保护以及Takai-Utimoto反应后,可以84%的收率得到中间体36。中间体36在CrCl2/Bu3SnCHI2条件下进行Takai烯化以及碘化反应,可以两步78%的收率得到碘化中间体37,E/Z > 20:1。中间体37通过DDQ进行3,4-二甲氧基苄基去保护,可以90%的收率得到中间体38。中间体38与锗基锡烷39通过Stille交叉偶联反应,可以63%的收率得到中间体40,(E,E)/(Z,E) > 20:1。中间体40在NIS条件下进行碘化反应,可以89%的收率得到中间体3b。砌块7的合成(Scheme 7a)。醛中间体41通过Marshall不对称炔丙基化反应以及使用TBAF进行脱保护,可以两步71%的收率得到二醇中间体43,dr > 20:1。为了证明7的立体结构,中间体43通过PMP缩醛化后,可以71%的收率得到中间体44,通过X-射线晶体学分析进一步证明结构的正确性。中间体43在TBSOTf条件下进行硅基乙醚的保护,可以93%的收率得到砌块7。砌块8的合成(Scheme 7b)。β-酮酯化合物45通过催化不对称动态动力学拆分,可以良好的收率、优异的对映和非对映选择性得到醇中间体46。中间体46通过TBS保护以及使用二异丁基铝(DIBAL)还原,可以两步80%的收率得到中间体47。中间体47通过4-甲氧基苄基(PMB)保护以及在温和的碱性条件下除去TMS基团,可以两步80%的收率得到中间体48。中间体48通过半氢化、硼氢化/氧化反应,可以两步72%的收率得到中间体49。中间体49通过Cu/TEMPO催化的有氧氧化反应,可以87%的收率得到砌块8。砌块2的合成(Scheme 8)。中间体7与中间体8通过Carreira不对称炔化反应,可以90%的收率得到中间体51,dr > 20:1。中间体51通过锡氢化反应,可以72%的收率得到中间体52与52’。中间体52与52’ 通过去锡化反应,可以99%的收率得到中间体53。中间体53通过甲基化反应,可以87%的收率得到中间体54。中间体54在TFA/CH2Cl2条件下进行脱保护,可以87%的收率得到三醇中间体55。中间体55通过选择性对甲苯磺酰化、环氧化物闭环以及重新引入硅基保护基,可以三步92%的收率得到中间体56。中间体56通过BF3-辅助的亲核开环反应,可以97%的收率得到中间体57。中间体57通过使用Meerwein试剂进行甲基化反应,可以90%的收率得到中间体58。中间体58通过使用TBAF去除全部的硅基保护剂后,再用三乙基硅烷重新进行羟基的保护,可以两步90%的收率得到中间体59。中间体59通过PMB保护基去除、Dess-Martin氧化反应以及Horner-Wadsworth-Emmons(HWE)烯化反应,可以三步71%的收率得到中间体61。中间体61通过溴化以及锡氢化反应,可以两步87%的收率得到砌块2。Neaumycin B(1)的合成(Scheme 9)。中间体2与中间体3通过Stille偶联反应,可以89%的收率得到中间体62。中间体62通过甲酯水解,可以86%的收率得到中间体63。中间体63通过大环内酯化反应,可以80%的收率得到中间体64。中间体64在TBAF/HOAc条件下脱去全部硅基保护基,可以80-90%的收率得到Neaumycin B(1)。值得注意的是,1是在单批次中以90 mg的规模制备的,总产率为2.3%。不幸的是,化合物1的1H NMR与Fenical等人报道的数据存在显著偏差。重要的是,化合物1的立体化学归属来自每个片段的X-射线晶体学分析(Figure 1)。也就是说,化合物33、44和50的晶体结构分别证实了合成Neaumycin B的C20−C41、C8−C14和C3−C6的立体化学。Mosher酯分析也证实了C7的立体化学。根据本文报道的证据,作者确信本文制备的合成Neaumycin B(1)与Fenical等人报道的结构相匹配。美国宾夕法尼亚大学Amos B. Smith, III课题组报道了一种大环内酯类天然产物Neaumycin B(1)的立体选择性全合成,在90 mg规模上的总收率为2.3%。该合成以克级规模的镍催化还原交叉偶联/螺缩酮化为关键步骤,构建了Neaumycin B中螺环缩酮骨架。合成Neaumycin B的C3-C6、C8-C14和C20-C41片段的立体结构通过X-射线晶体学得到了明确的验证。
2012年,沈奔团队从土壤放线菌链霉菌Streptomyces sp.NEAU-x21中分离出第一个Neaumycin同源物。2015年,通过对Neaumycin的结构进行了实质性修改,分离出了Neaumycin A和同类Neaumycin B,但没有相关的立体化学。2018年,Jenson和Fenical等课题组从巴哈马群岛采集的热带褐藻Stypodium zonale的表面分离出一种海洋微生物小单孢菌属(菌株 CNY-010)的物质。基因组数据和2D NMR研究的结合导致Neaumycin B的归属为1。Neaumycin B针对几种癌症细胞系的初步体外研究显示出显著的效力,特别是对U87人胶质母细胞瘤的选择性。Neaumycin B的生物活性有望成为药物设计的先导结构。因此,开发新型Neaumycin B(1)的全合成具有重要意义。近日,美国宾夕法尼亚大学Amos B. Smith, III课题组首次实现了Neaumycin B(1)的全合成。通过逆合成分析发现(Scheme 1),Neaumycin B(1)可由砌块2和3合成。砌块3可由砌块5与6制备。砌块2可由砌块7与8通过不对称1,2-加成制备。下载化学加APP到你手机,更加方便,更多收获。砌块5的合成(Scheme 2)。环氧化物(+)-9与二噻烷10通过Brook重排/环氧化物开环的串联过程,可以82%的收率得到中间体11。中间体11经苄基保护、三甲基硅基醚水解与Cu/TEMPO催化的有氧氧化反应,可以两步87%的总收率得到醛中间体12。中间体12与衍生自乙酸甲酯的烯醇化物进行Felkin-Anh选择性Aldol反应,可以>95%的收率得到中间体13,dr为15:1。中间体13经二硫代缩醛水解以及Evans-Saksena还原反应后,可以两步73%的总收率得到中间体14。中间体14通过进一步的1,3-二醇保护后,可以96%的收率得到中间体15。中间体15通过甲酯的皂化和随后的硫酯化反应,可以两步95%的收率得到砌块5。砌块6的合成(Scheme 3)。以环氧醇(-)-16为底物,通过区域选择性开环,可以95%的收率得到二醇中间体17。中间体17通过双相的高碘酸盐的断裂和二溴-烯化反应,可以两步84%的收率得到二溴中间体18。中间体18与n-BuLi和甲醛反应后,可以84%的收率得到炔丙醇中间体19。中间体19通过钌催化羟基导向反式硅氢化反应,可以91%的收率得到醇中间体20,Z/E > 20:1,β/α > 20:1。中间体20在使用MnO2氧化后,可以>95%的收率得到醛中间体21。中间体21可与化合物22进行Evans Aldol以及酰胺基转移反应(transamidation),可以两步82%的收率得到酰胺中间体24。中间体24与烯丙基溴化镁进行单加成生成β-羟基酮,随后通过Narasaka-Prasad还原和缩醛保护后,可以三步72%的收率得到中间体25。中间体25通过硼氢化、氧化以及Appel反应,可以两步95%的收率得到砌块6。砌块26的合成(Scheme 4)。中间体5和6通过镍催化还原交叉偶联反应,可以76%的收率得到中间体4。中间体4经脱保护/螺缩酮化反应,可以1:0.8的混合物形式合成中间体26和差向异构体26’,其可通过色谱分离。令人高兴的是,将差向异构体26’暴露于相同的酸性条件下重新建立了平衡,从而允许在每次色谱分离/再平衡时获得中间体26,可以67%的总收率得到中间体26。砌块3a的合成(Scheme 5)。中间体26在TBAF/KHMDS与DMB-Br/MeLi条件下,可以三步88%的收率得到中间体27。中间体27通过环氧化后,可以83%的收率得到中间体28,dr > 20:1。中间体28在使用TBAF进行去硅基化后,可以96%的收率得到中间体29。中间体29在Ag2O/MeI进行甲基化后,可以84%的收率得到中间体30。中间体30通过氢解后,可以62%的收率得到二醇中间体31。中间体31在TEMPO/PIDA条件下进行化学选择性氧化,随后与三苯基膦试剂反应,可以两步>95%的收率得到中间体33。中间体33通过三乙基硅基保护、酯的还原和MnO2的氧化反应,可以三步77%的收率得到中间体34。中间体34使用DDQ进行脱保护后,可以>95%的收率得到中间体35。中间体35通过Takai-Utimoto烯化反应,可以80%的收率得到中间体3a,(E,E)/(Z,E)为4:1。砌块3b的合成(Scheme 6)。中间体32通过三乙基硅基保护以及Takai-Utimoto反应后,可以84%的收率得到中间体36。中间体36在CrCl2/Bu3SnCHI2条件下进行Takai烯化以及碘化反应,可以两步78%的收率得到碘化中间体37,E/Z > 20:1。中间体37通过DDQ进行3,4-二甲氧基苄基去保护,可以90%的收率得到中间体38。中间体38与锗基锡烷39通过Stille交叉偶联反应,可以63%的收率得到中间体40,(E,E)/(Z,E) > 20:1。中间体40在NIS条件下进行碘化反应,可以89%的收率得到中间体3b。砌块7的合成(Scheme 7a)。醛中间体41通过Marshall不对称炔丙基化反应以及使用TBAF进行脱保护,可以两步71%的收率得到二醇中间体43,dr > 20:1。为了证明7的立体结构,中间体43通过PMP缩醛化后,可以71%的收率得到中间体44,通过X-射线晶体学分析进一步证明结构的正确性。中间体43在TBSOTf条件下进行硅基乙醚的保护,可以93%的收率得到砌块7。砌块8的合成(Scheme 7b)。β-酮酯化合物45通过催化不对称动态动力学拆分,可以良好的收率、优异的对映和非对映选择性得到醇中间体46。中间体46通过TBS保护以及使用二异丁基铝(DIBAL)还原,可以两步80%的收率得到中间体47。中间体47通过4-甲氧基苄基(PMB)保护以及在温和的碱性条件下除去TMS基团,可以两步80%的收率得到中间体48。中间体48通过半氢化、硼氢化/氧化反应,可以两步72%的收率得到中间体49。中间体49通过Cu/TEMPO催化的有氧氧化反应,可以87%的收率得到砌块8。砌块2的合成(Scheme 8)。中间体7与中间体8通过Carreira不对称炔化反应,可以90%的收率得到中间体51,dr > 20:1。中间体51通过锡氢化反应,可以72%的收率得到中间体52与52’。中间体52与52’ 通过去锡化反应,可以99%的收率得到中间体53。中间体53通过甲基化反应,可以87%的收率得到中间体54。中间体54在TFA/CH2Cl2条件下进行脱保护,可以87%的收率得到三醇中间体55。中间体55通过选择性对甲苯磺酰化、环氧化物闭环以及重新引入硅基保护基,可以三步92%的收率得到中间体56。中间体56通过BF3-辅助的亲核开环反应,可以97%的收率得到中间体57。中间体57通过使用Meerwein试剂进行甲基化反应,可以90%的收率得到中间体58。中间体58通过使用TBAF去除全部的硅基保护剂后,再用三乙基硅烷重新进行羟基的保护,可以两步90%的收率得到中间体59。中间体59通过PMB保护基去除、Dess-Martin氧化反应以及Horner-Wadsworth-Emmons(HWE)烯化反应,可以三步71%的收率得到中间体61。中间体61通过溴化以及锡氢化反应,可以两步87%的收率得到砌块2。Neaumycin B(1)的合成(Scheme 9)。中间体2与中间体3通过Stille偶联反应,可以89%的收率得到中间体62。中间体62通过甲酯水解,可以86%的收率得到中间体63。中间体63通过大环内酯化反应,可以80%的收率得到中间体64。中间体64在TBAF/HOAc条件下脱去全部硅基保护基,可以80-90%的收率得到Neaumycin B(1)。值得注意的是,1是在单批次中以90 mg的规模制备的,总产率为2.3%。不幸的是,化合物1的1H NMR与Fenical等人报道的数据存在显著偏差。重要的是,化合物1的立体化学归属来自每个片段的X-射线晶体学分析(Figure 1)。也就是说,化合物33、44和50的晶体结构分别证实了合成Neaumycin B的C20−C41、C8−C14和C3−C6的立体化学。Mosher酯分析也证实了C7的立体化学。根据本文报道的证据,作者确信本文制备的合成Neaumycin B(1)与Fenical等人报道的结构相匹配。美国宾夕法尼亚大学Amos B. Smith, III课题组报道了一种大环内酯类天然产物Neaumycin B(1)的立体选择性全合成,在90 mg规模上的总收率为2.3%。该合成以克级规模的镍催化还原交叉偶联/螺缩酮化为关键步骤,构建了Neaumycin B中螺环缩酮骨架。合成Neaumycin B的C3-C6、C8-C14和C20-C41片段的立体结构通过X-射线晶体学得到了明确的验证。文献详情:
Jiaming Ding, Amos B. Smith, III*. Total Synthesis of the Reported Structure of Neaumycin B. J. Am. Chem. Soc. 2023, https://doi.org/10.1021/jacs.3c06573
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn