(图片来源:Angew. Chem. Int. Ed.)
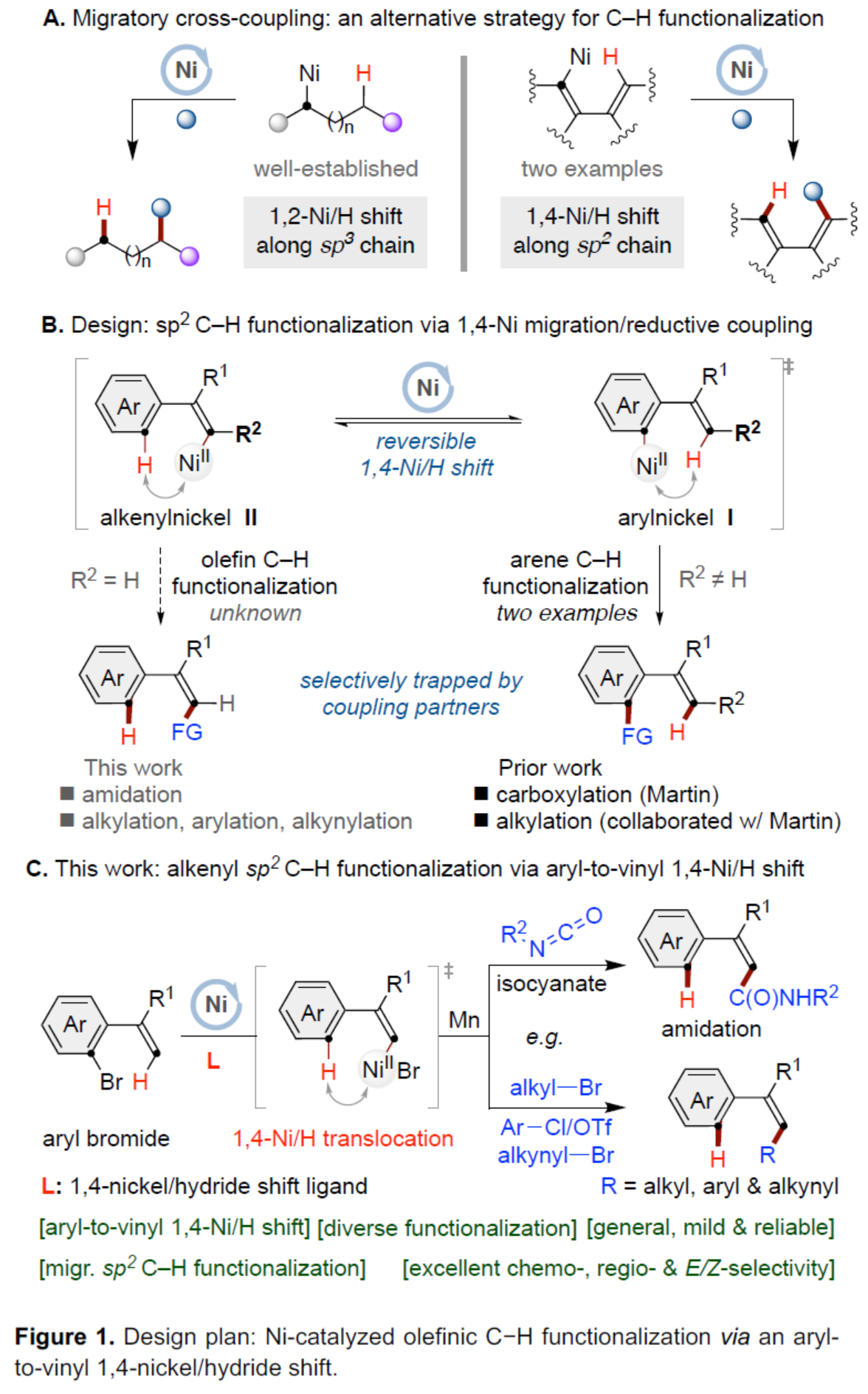
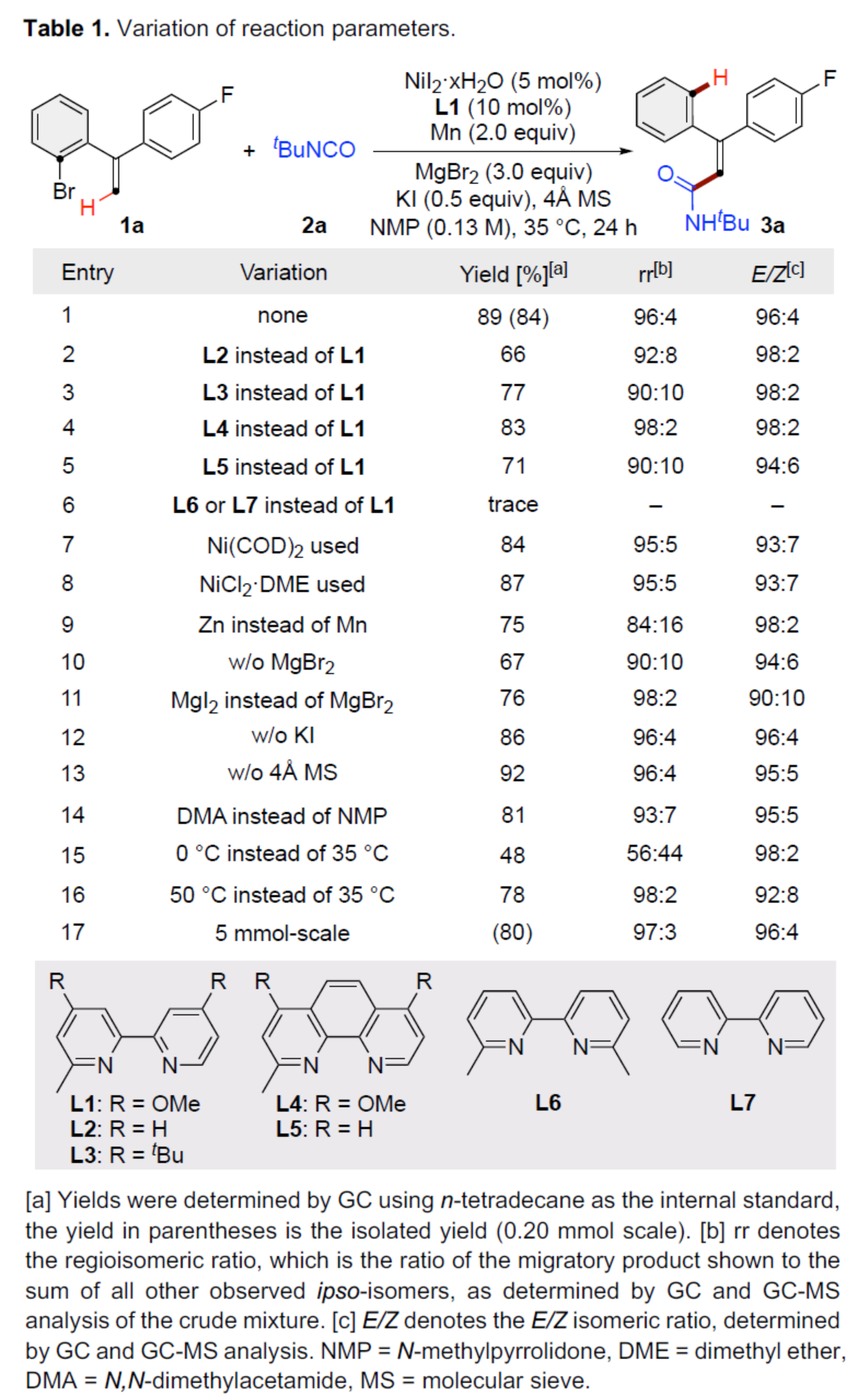
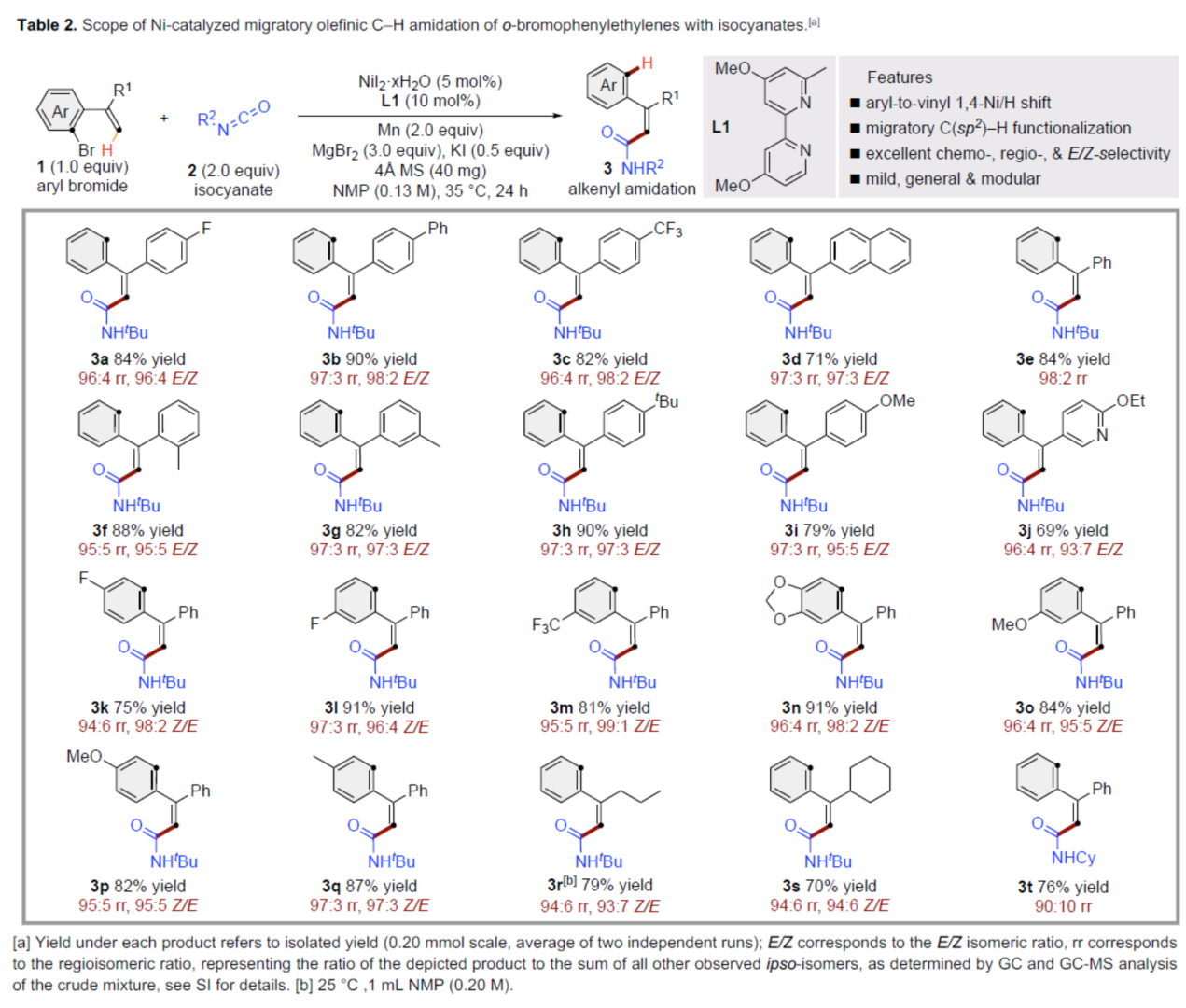
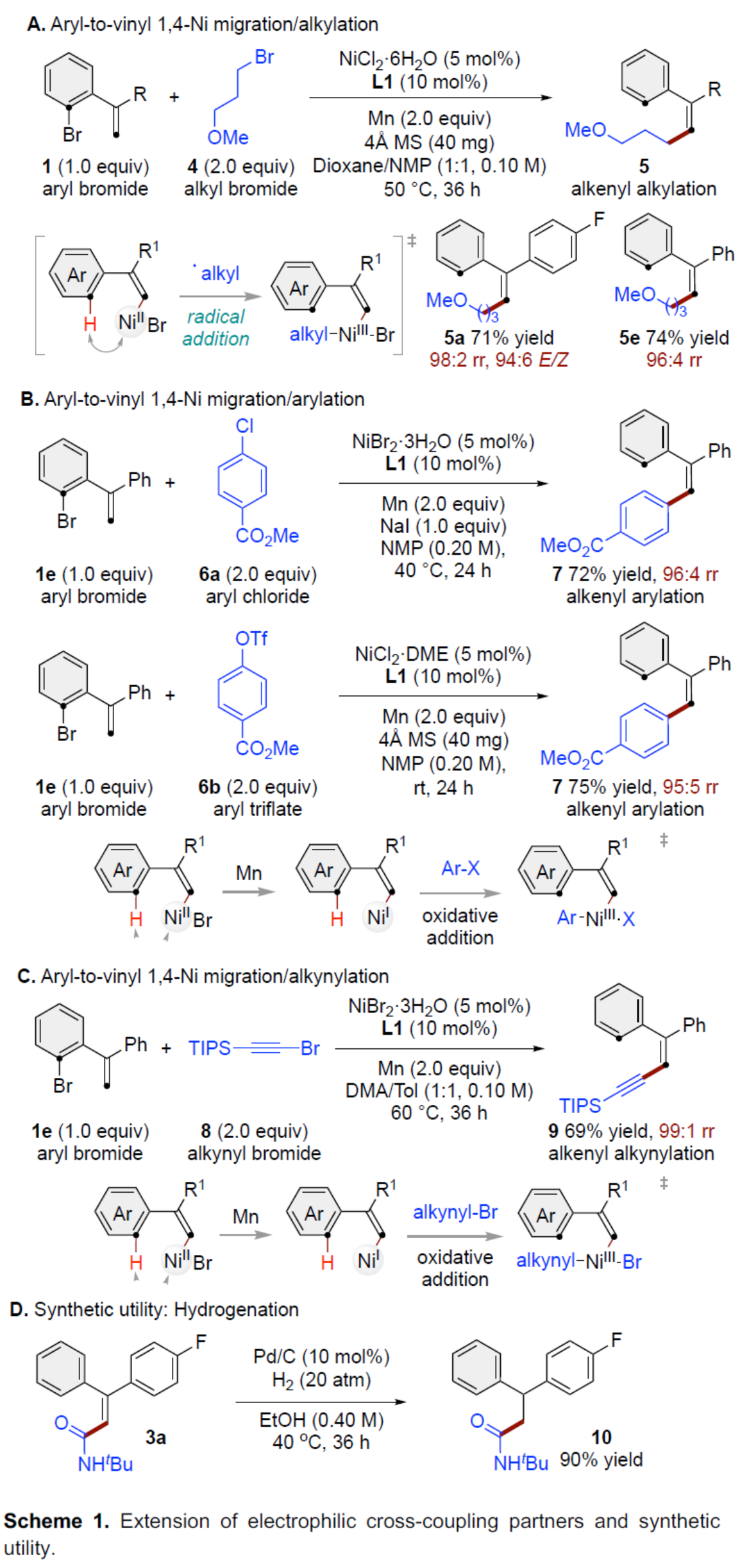
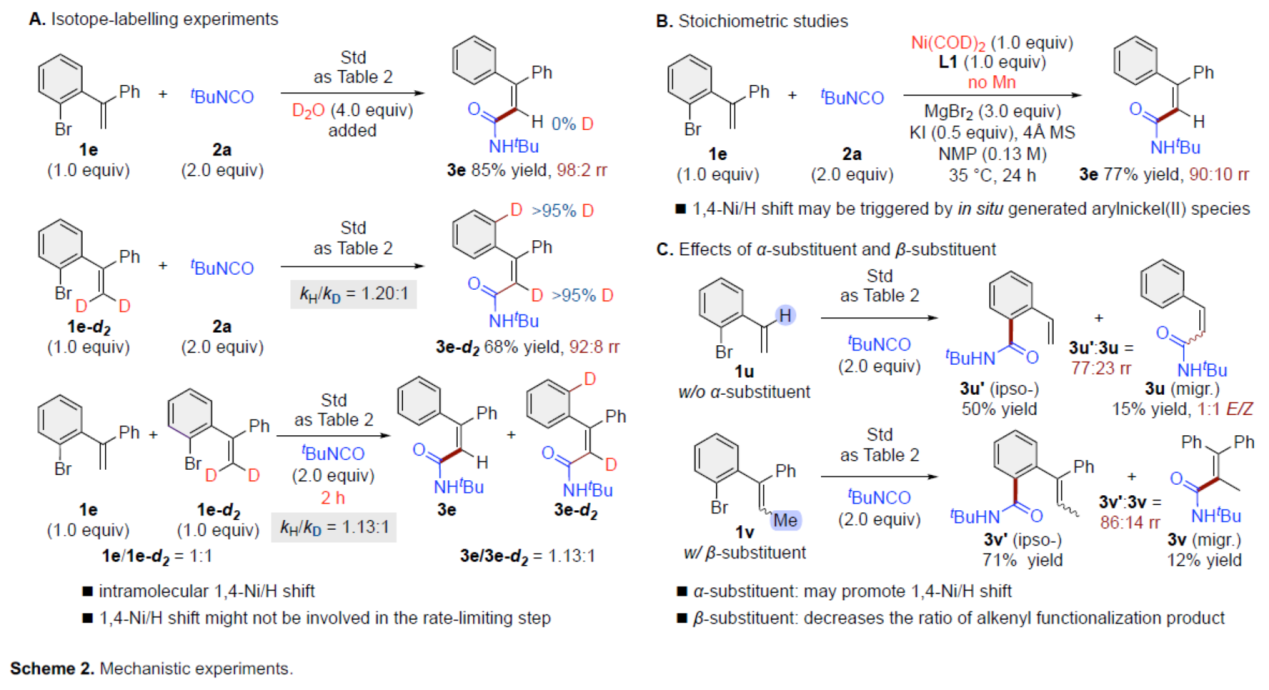
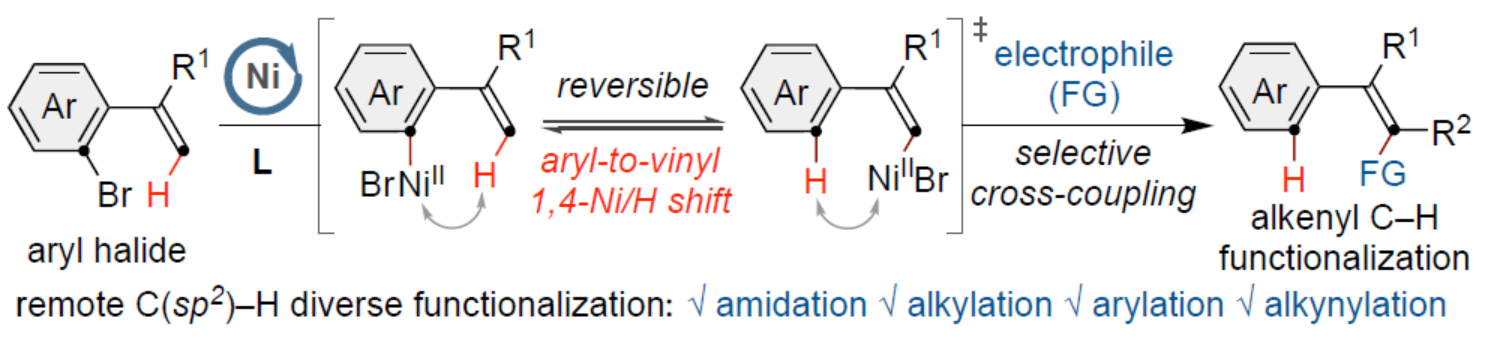
交叉偶联反应在有机合成中具有重要的地位。在这些转化中,通过对两个偶联配偶体中活化基团原始位点的预引入,可形成一种新的共价键。同时,通过形式1,n-金属/氢化物迁移的迁移交叉偶联反应是另一种互补的方法,可选择性地在远端非官能团化的位点引入相应的官能团,从而能够有效地合成各种具有挑战性的结构。在过去的二十年里,基于迭代1,2-或1,3-金属/氢化物迁移(烯烃异构化)的迁移交叉偶联反应已取得一定的进展,并实现了沿着sp3链进行的远程C(sp3)–H键的选择性官能团化反应。同时,通过空间1,4-或1,n-金属/氢化物迁移过程,还可在sp2骨架中的远程位点进行选择性的官能团化反应。传统上,迁移交叉偶联主要使用贵金属催化剂(如钯和铑催化剂),但近年来镍催化剂也对该领域也做出了重大的贡献。目前,对于Ni-催化远程非官能团化C(sp3)–H位点的迁移官能团化反应已取得了巨大的进展(Figure 1A,left),但利用镍迁移用于远端C(sp2)–H键的官能团化反应,却较少有相关的研究报道(Figure 1A,right)。Johnson与Martin课题组在这一领域进行了开创性的研究,利用乙烯基到芳基的1,4-Ni/H迁移策略,前期朱少林课题组和Martin课题组合作,成功实现了芳基C(sp2)–H键官能团化,用于制备多取代的芳烃。然而,利用芳基到乙烯基的1,4-Ni/H迁移,然后在烯基位进行选择性交叉偶联制备多取代烯烃,尚未有相关的研究报道(Figure 1B)。从机理上讲,如果芳基镍I和烯基镍II之间的1,4-Ni/H迁移是可逆的,那么相应的烯基镍化合物(II)也可以在适当迁移配体存在下,从易得的芳基溴起始底物中获得。在R2 = H的情况下,在还原交叉偶联条件下,形成的空间要求较低的烯基镍中间体可能被不同的亲电偶联配偶体选择性的捕获,如异氰酸酯、烷基溴化物、芳基氯化物或炔基溴化物(Figure 1C)。近日,南京大学朱少林课题组利用关键性的芳基到乙烯基的1,4-Ni/H迁移策略,直接实现了远程烯烃的C–H酰胺化、烷基化、芳基化和炔基化反应(Figure 1C)。下载化学加APP到你手机,更加方便,更多收获。(图片来源:Angew. Chem. Int. Ed.)首先,作者以芳基溴衍生物1a与异氰酸酯2a作为模型底物,进行了相关偶联反应条件的筛选(Table 1)。当以NiI2·xH2O(5 mol%)作为催化剂,L1(10 mol%)作为配体,Mn(2.0 equiv)作为还原剂,MgBr2(3.0 equiv)、KI(0.5 equiv)和4Å MS作为添加剂,在NMP溶剂中35 oC反应24 h,可以84%的收率得到产物3a,rr为96:4,E/Z为96:4。(图片来源:Angew. Chem. Int. Ed.)在获得上述最佳反应条件后,作者对底物范围进行了扩展(Table 2)。首先,当底物1中的R1为不同电性取代的芳基、萘基、杂芳基时,均可顺利反应,获得相应的产物3a–3j,收率为69-90%,rr为95:5–98:2,E/Z为93:7–98:2。其次,当底物1中的芳基上含有不同电性的取代基时,也与体系兼容,获得相应的产物3k–3q,收率为75–91%,rr为94:6–97:3,Z/E为95:5–99:1。同时,当底物1中的R1为烷基或环已基取代时,可获得相应的产物3r–3s,收率为70–79%,rr为94:6,Z/E为93:7–94:6。此外,当底物2中的R2为-Cy时,也能够顺利反应,获得相应的产物3t,收率为76%,rr为90:10。(图片来源:Angew. Chem. Int. Ed.)紧接着,作者发现,在这些温和且无碱的条件下,除了异氰酸酯亲电试剂以外,一系列烷基溴化物、芳基氯化物、三氟甲磺酸芳基酯和炔基溴化物均可作为有效的偶联底物,并以良好的收率以优异的区域和E/Z选择性获得不同烷基、芳基和炔基取代的烯烃衍生物(Scheme 1A–C)。同时,3a在Pd/C/H2条件下进行氢化反应,可以90%的收率得到化合物10(Scheme 1D)。(图片来源:Angew. Chem. Int. Ed.)最后,作者还对反应机理进行了进一步的研究(Scheme 2)。首先,同位素标记实验表明,反应中间体和反应介质之间没有进行H-D交换。同时,1,4-Ni/H迁移可能不涉及决速步骤(Scheme 2A)。化学计量实验表明,原位生成的芳基Ni(II)中间体引发了1,4-Ni/H迁移的过程(Scheme 2B)。对照实验表明,α-取代基可能促进1,4-Ni/H迁移的过程(Scheme 2C)。(图片来源:Angew. Chem. Int. Ed.)
南京大学朱少林课题组报道了一种通过关键性的芳基到乙烯基的1,4-Ni/H迁移和选择性的还原交叉偶联反应序列,成功实现了Ni-催化迁移烯基C–H官能团化反应,并以优异的区域和立体选择性地方式获得了一系列三取代烯烃衍生物。同时,该策略还可与一系列其它的亲电试剂(如异氰酸酯、烷基溴化物、芳基氯化物或炔基溴化物)进行反应,获得一系列烷基、芳基和炔基取代的烯烃衍生物。此外,该反应具有良好的化学、区域和E/Z选择控制性,进一步突出了该策略的合成实用性。文献详情:
Jingjie Yang, Zhuofan Gui, Yuli He, Shaolin Zhu*. Functionalization of Olefinic C−H Bonds by an Aryl-to-Vinyl 1,4-Nickel Migration/Reductive Coupling Sequence. Angew. Chem. Int. Ed.2023, https://doi.org/10.1002/anie.202304713