

(图片来源:J. Am. Chem. Soc.)
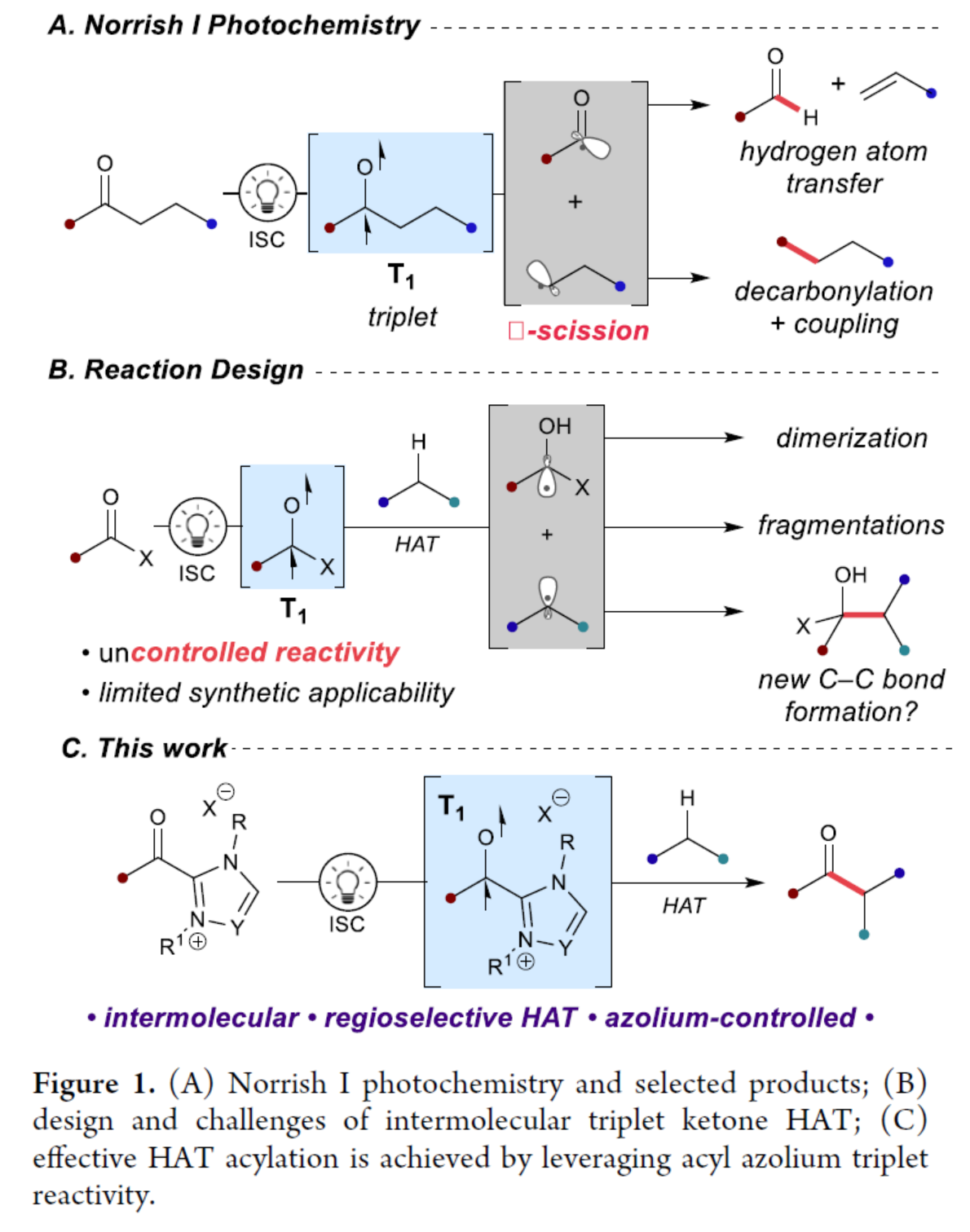
一个多世纪以来,光驱动化学转化的能力一直吸引着合成化学家的注意。1885年,Klinger、Ciamician和Silber团队首次报道了有机光化学的反应,如酮类化合物的光还原反应。其中,芳香酮的乙醚溶液暴露于日光下能够缓慢还原为醇。从那时起,酮的光化学转化已取得巨大的进展。值得注意的是,早期创新性研究包括已发现的Norrish型光化学反应,其中对酮的三重态双自由基的激发可导致快速且不受控制的断裂、攫取和偶联反应。Norrish II和Norrish-Yang反应源于初始分子内氢原子转移(HAT),并发现了各种合成应用,包括天然产物全合成。另一方面,Norrish I型化学是通过酮辐射直接生成酰基和烷基自由基(Figure 1A)。尽管该策略为生成具有价值的自由基配合物提供了一个有吸引力的解决方案,但由于其初始自由基产物的反应性不受控制而限制了其应用。因此,能够从Norrish型过程中提供更可控结果的策略,则更具吸引力。
在过去十年中,HAT作为一种强有力的键形成策略,从而备受关注。与其它生成自由基的方法相比,氢原子的直接攫取提供了独特的区域和化学选择性,并避免了对预官能团化氧化还原活性前体的需要。类似地,三重态酮诱导的HAT已单独用于催化转化以及与过渡金属催化结合。然而,在这些情况下,HAT生成的羰基(ketyl)自由基不会被并入最终产物中。
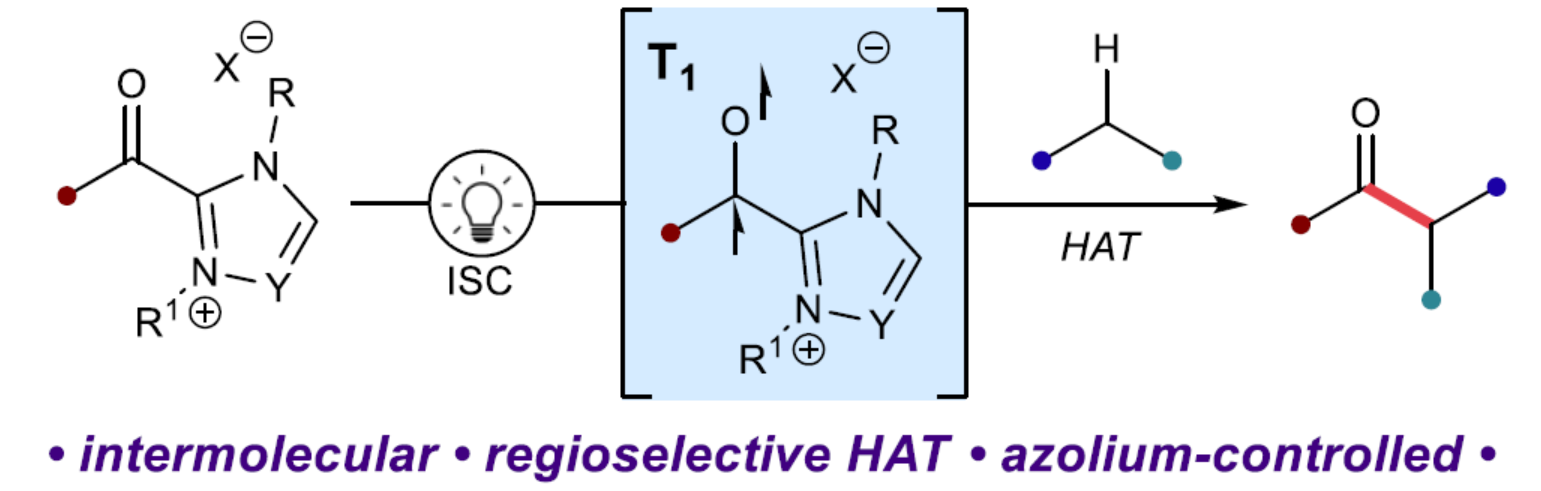
作者设想,若将这两种光化学反应模式相结合,可实现无催化剂的转化,能够将酮与活化C-H键直接连接(Figure 1B)。三重态酮驱动的分子间HAT与Norrish-Yang类自由基-自由基偶联的结合,将为C-C键的形成提供一种新型的策略,但也存在二聚化、断裂和新生成的自由基对之间发生不期望的二次HAT的问题。最近,化学家们在单电子N-杂环卡宾催化的研究中发现,自由基氮唑盐配合物可作为稳定酰基自由基替代物。同时,此类自由基配合物可避免常见的自由基副反应,而有利于选择性自由基-自由基交叉偶联。近日,美国西北大学Karl A. Scheidt与得克萨斯农工大学Osvaldo Gutierrez团队利用酰基氮唑盐作为三重态羰基试剂,实现了所需的HAT/偶联反应(Figure 1C)。首先,酰基氮唑盐与靶底物在光照射下激发后,酰基氮唑盐经系间窜越后生成三重态双自由基配合物。随后,偶联底物经HAT可生成一对自由基,由于酰基氮唑盐自由基的独特反应性,它可以选择性地进行交叉偶联以生成所需的酮。最后,通过添加碱可以容易地释放所需的酰化产物。
(图片来源:J. Am. Chem. Soc.)
首先,作者以苯甲酰基氮唑盐1a与N-Boc-吡咯烷2a作为模型底物,进行了相关反应条件的筛选(Table 1)。当在DCE溶剂中于370 nm LEDs照射下反应2 h后,再以DBU作为碱,在MeCN溶剂中反应25 min,可以67%的收率得到酰化产物3a。

(图片来源:J. Am. Chem. Soc.)
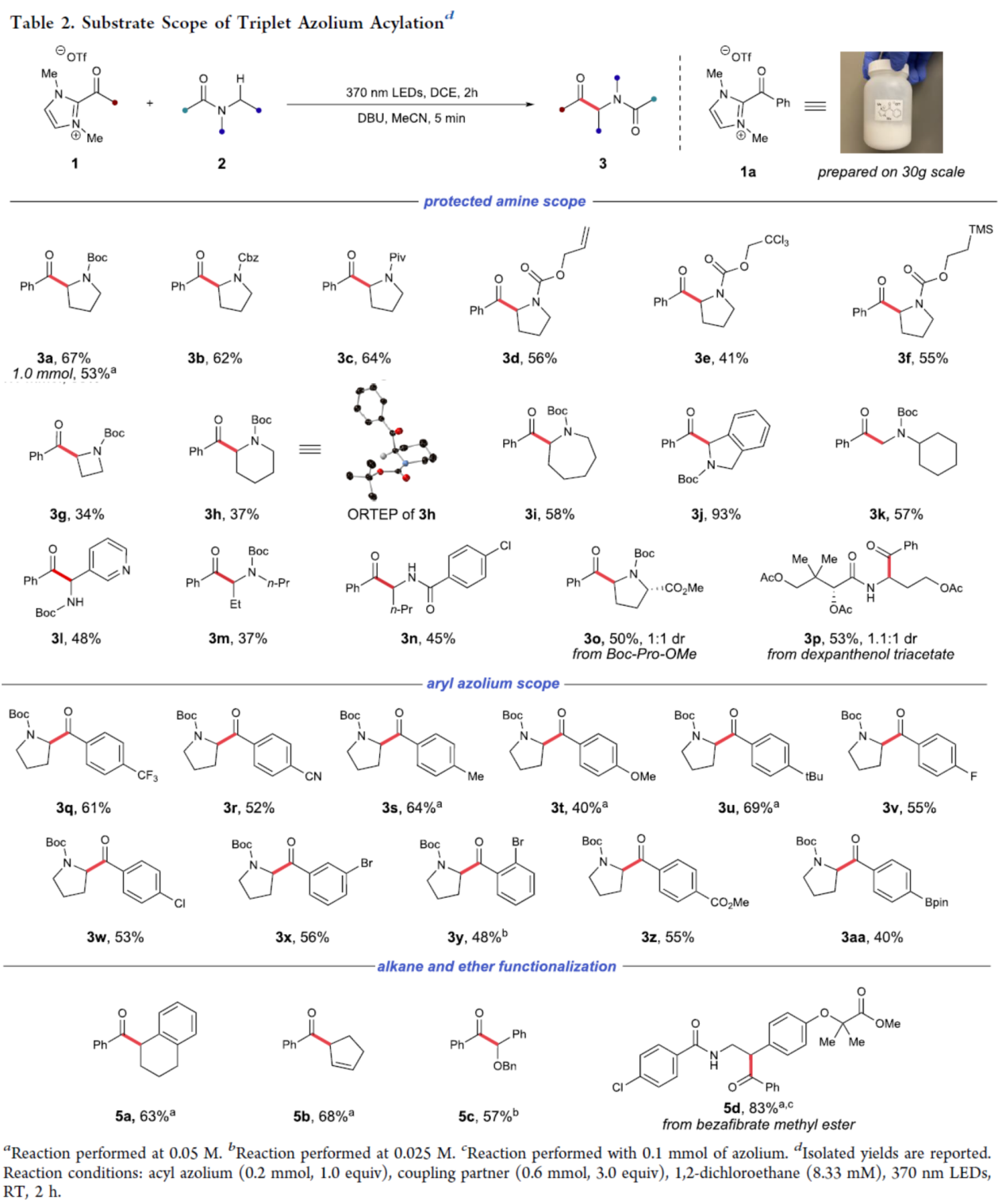
在获得上述最佳反应条件后,作者对底物范围进行了扩展(Table 2)。首先,一系列N-保护的胺底物,均可顺利进行反应,获得相应的产物3a-3p,收率为34-93%。其次,一系列不同电性取代的芳基氮唑盐,也与体系兼容,获得相应的产物3q-3aa,收率为40-69%。此外,四氢萘、环戊烯和二苄基醚衍生物,也是合适的底物,获得相应的产物5a-5c,收率为57-68%。同时,该策略还可用于降脂药苯扎贝特的后期修饰,可以83%的收率得到苄基酮产物5d。
(图片来源:J. Am. Chem. Soc.)
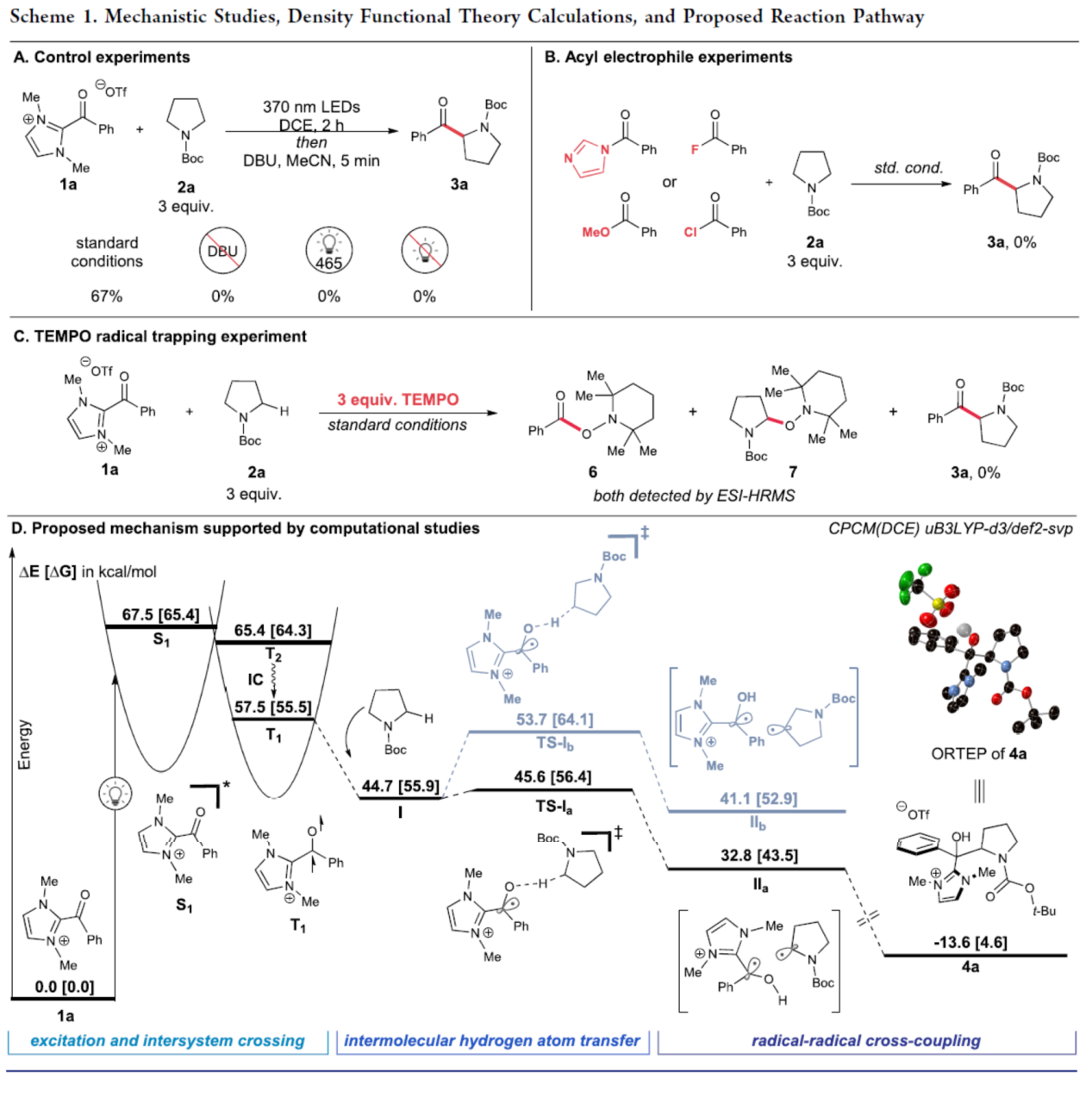
最后,作者对反应机理进行了进一步的研究(Scheme 1)。首先,控制实验表明,酰基氮唑盐的激发是反应的关键(Scheme 1A)。UV/vis光谱研究表明,酰基氮唑盐不会吸收超过400 nm的光。同时,在酰基氮唑盐1a和N-Boc-吡咯烷2a反应时,UV/vis吸收谱没有发生变化,从而排除了形成电子供体-受体配合物的可能性。在1a与2a的反应体系中无DBU时,未能获得所需的产物,进一步支持了在后处理时释放所需酮的中间体的存在。其次,当使用其它的酰基亲电试剂替代1a时,未能获得所需的酮产物3a,从而表明酰基氮唑盐的酰化反应性是独特的(Scheme 1B)。此外,通过自由基捕获实验表明,反应形成了两种自由基,并且TEMPO抑制了自由基酰化过程(Scheme 1C)。基于上述的实验以及相关的理论计算,作者提出了一种合理的反应机理(Scheme 1D)。首先,酰基氮唑盐1a在紫外或UVA照射下可达到单线态激发态S1。S1经系间窜越后,生成三重态激发态(T2),其经快速地分子内转化后可生成最低能量三重态激发态T1。值得注意的是,对优化的T1结构的分析表明,自旋密度主要位于氧原子上,与HAT步骤中选择性的O-H键形成(vs C-H)一致。与观察到的酰化的高区域选择性一致,N-Boc-吡咯烷的α-氨基C-H键中的氢原子攫取通过一个小的能垒(TS-Ia),而HAT在β-位的能垒(TS-Ib)要高得多。这种能量差异和相应的选择性与文献报道的极性匹配和失配HAT动力学一致,并反映了形成的自由基对的相对稳定性(IIb vs IIa)。最后,从自由基对IIa中,经自由基-自由基交叉偶联可以迅速生成叔醇4a,其经进一步处理后可生成产物3a。
(图片来源:J. Am. Chem. Soc.)
总结
美国西北大学Karl A. Scheidt与得克萨斯农工大学Osvaldo Gutierrez团队开发了一种利用稳定的酰基氮唑盐,实现了光诱导活化C-H键的直接酰化反应。该过程无需要使用任何催化剂,并利用酰基氮唑盐三重态激发态的独特反应性。通过简单的照射,酰基氮唑盐可以很容易生成三重态双自由基,其可经高度区域选择性的氢原子转移和随后的自由基-自由基偶联,从而获得四面体中间体。随后,通过简单的碱处理后,可获得所需的酮产物。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn