

C18-和C19-二萜生物碱是一类结构复杂的天然产物,主要存在于乌头属和翠雀属植物中。近年来随着人们对这类植物中具有药物活性天然产物的研究逐渐深入,有超过700种C18-和C19-生物碱得到分离和鉴定(图1)。这类生物碱通常表现出广泛的生物活性,包括抗炎、镇痛、抗心律失常、降压和心动过缓等。大多数C18-和C19-二萜生物碱都具有共同的6/7/5/6/6/5元ABCDEF环骨架。其结构区别和不同的生物活性主要取决于氮杂六元环上含氧基团的数目和位置。
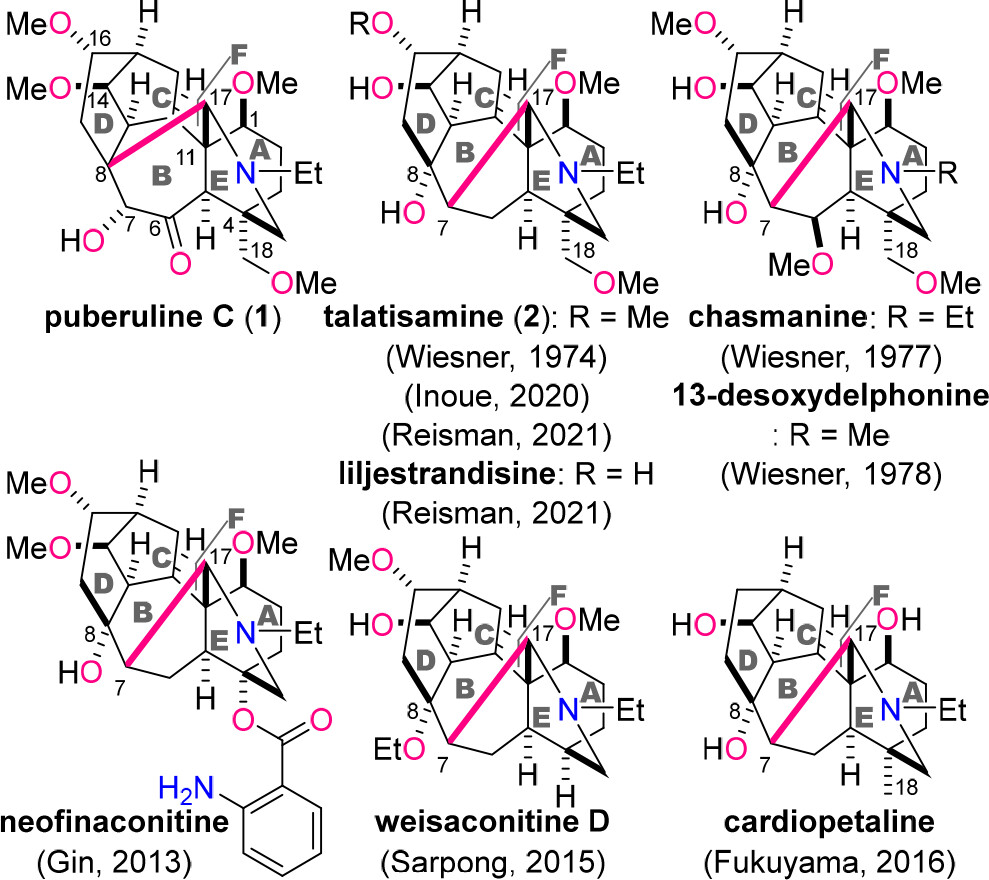
图1. C18-和C19-二萜生物碱的结构(图片来源: J. Am. Chem. Soc.)
Puberuline C (1) 是最近被分离得到的一种罕见的C19-二萜生物碱,其C8-C17键构成六元环而非五元环,因此1具有6/7/5/6/6/6元ABCDEF环系统。1中除C4和C11外,还包括C8位的季碳,具有更为拥挤的分子骨架。1的氮杂六元环还被六个含氧官能团(C1、C6、C7、C14、C16和C18)修饰。但由于天然来源供应不足,该生物碱的详细生物活性尚未阐明。
C18-和C19-二萜生物碱的重要生物活性及其异常复杂的结构长期以来一直激发着合成化学家的兴趣,因此近年来已有众多相关分子的合成被报道。然而此前的研究主要集中在Talatisamine (2)或具有类似6/7/5/6/6/5 ABCDEF环的相关结构上。作者于2020年利用环重组和氧化环化策略作为关键步骤,成功以33步完成了2的全合成。截至目前,仍然没有合成Puberuline C (1)的相关报道。
作者首先对Puberuline C (1)进行了详细的逆合成分析(图2)。该分子含有十二个立体中心和三个季碳中心,作者期望以叔氯化合物5为关键中间体,经历C11-Cl键断裂产生C11桥头自由基,进而完成七元环B和六元环F的构建并引入其中五个立体中心(C8、C9、C10、C11和C17)。随后,化合物4的C16-二苄基缩醛和C14-酮的分子内Mukaiyama羟醛反应将在C13和C16处引入两个三取代碳中心,形成3的D环。最后调整化合物3中BCD环C6、C7、C14和C16处的含氧取代基以完成1的全合成。
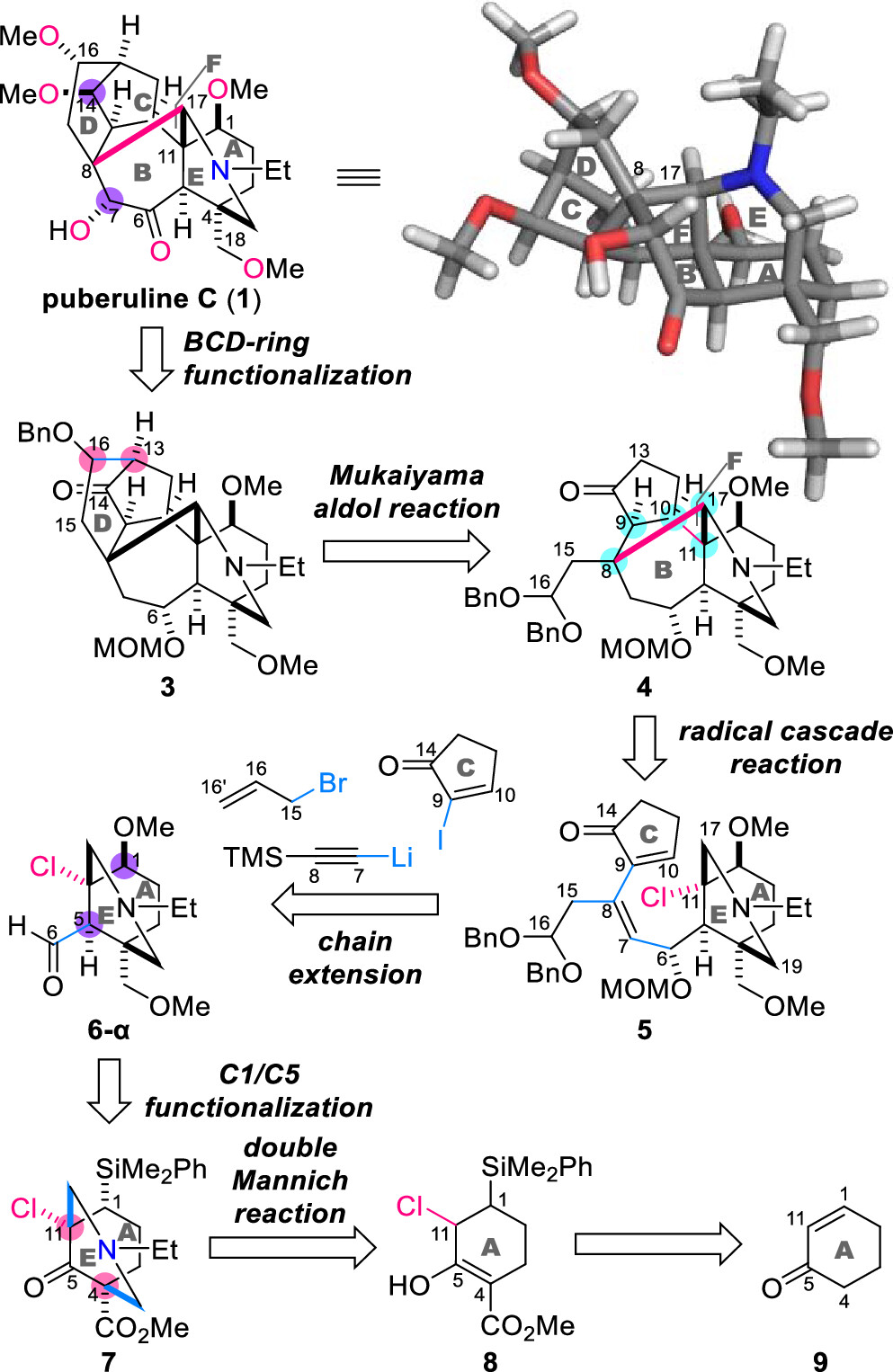
图2. Puberuline C (1)的逆合成分析(图片来源: J. Am. Chem. Soc.)
随后,作者使用2-环己烯酮(9)为起始原料,由20步反应成功完成了自由基串联反应底物5的合成(图3)。具体步骤如下:首先使用LDA和氯甲酸甲酯与9发生酰基化得到化合物10,随后在TMSCl存在下使用Me2PhSiLi和Et2Zn处理烯酮10,生成烯醇硅醚11。将得到的11与N-氯代糖精反应以引入所需的C11-氯代物,生成烯醇形式产物8,其通过在大位阻C1-SiMe2Ph基团的异面进行双Mannich反应,从而以C4/C11立体选择性方式形成7的N-乙基哌啶环部分。使用HBF4·OEt2将7的苯基替换为12中的氟原子后,再进行Fleming-Tamao氧化将其转化为相应的铵盐,然后在AcOH中用AcOOH处理,得到醇13-α,同时保持C1的立体化学。将13-α在DBU存在下于甲苯中反应,通过逆羟醛/羟醛缩合过程完成立体化学反转,得到热力学有利的醇13-β作为主要差向异构体的混合物(13-β/13-α = 2.2:1),将13-β位阻较小的C1-羟基选择性保护为TBS醚14。
中间体14的C5-酮由于相邻的C11-叔氯和季碳中心C4而被空间效应屏蔽,一般的亲核试剂难以与其反应,因此可以在中性条件下使用空间位阻小、反应性高且稳定的Wittig试剂来延长碳链。作者在130 °C下用氰基亚甲基(三甲基)膦处理14,分别以62%和34%的产率生成不饱和腈15-Z和15-E,同时不会影响C1-OTBS、C11-Cl和C4-甲氧羰基。随后,15-Z 的C5 ═ C6双键和C4-甲酯可被LiBH4同时还原,以88%的收率生成16 (16-β/16-α=1:1)。随后,使用n-Bu4NF脱除16-β/16-α的TBS基团,并用MeI完成C1-和C18-羟基的双甲基化生成17 (17-β/17-α=9.8:1)。17-β/17-α的C6位在THF/HMPA中被LDA去质子化,并在-100 °C下使用反式-2-(苯基磺酰基)-3-苯基氧杂嗪进行氧化,随后加入Me2S和Na2CO3水溶液,能以67%的收率生成醛6-β。最后利用TsOH·H2O完成6-β上C5的立体化学完全差向异构化,得到所需的热力学有利产物6-α。最后,AE环片段6-α依次经历炔基化、Sonogashira偶联、炔烃氢-锡化、Stille偶联以及催化双羟基化等步骤成功得到双苄基缩醛5,从而完成后续自由基反应底物的制备。值得注意的是,该合成路线也实现了用于后续Mukaiyama羟醛反应的C16-缩醛结构的引入。
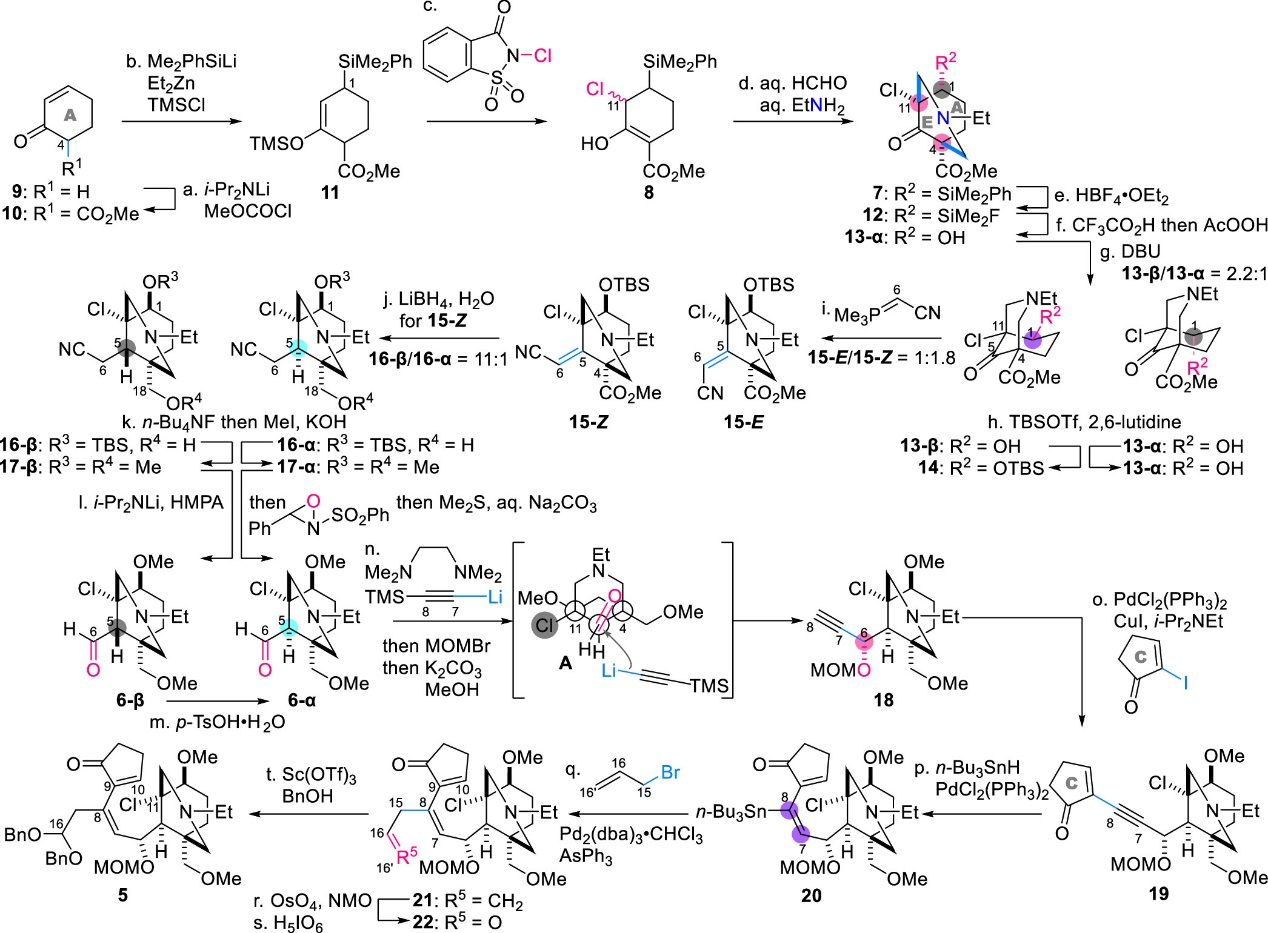
图3. 自由基反应底物5的合成(图片来源: J. Am. Chem. Soc.)
底物5用于自由基串联反应必须首先诱导其C-Cl键发生均裂。然而,相对于烷基溴化物,烷基氯代物由于其反应性低,很少用作天然产物合成中的自由基前体。但作者发现,叔溴代物中间体表现出独特的不稳定性,即当溴代中间体23在100 °C下用MOMCl和i-Pr2Net对羟基进行保护时,23的桥头溴原子会完全发生氯溴交换得到化合物18(图4)。
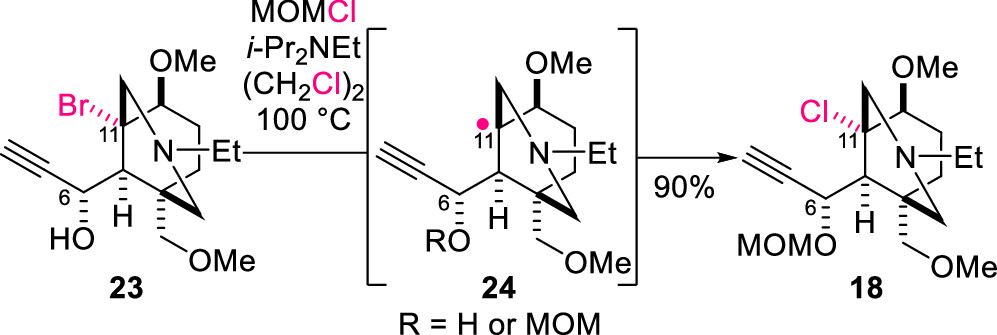
图4. 中间体23脱溴氯化反应(图片来源: J. Am. Chem. Soc.)
随后作者使用氯代底物5为自由基前体化合物,探索了自由基串联环化的反应条件(图5)。作者使用微波反应器作为加热装置以精确控制温度,并使用1,3-双三氟甲苯作为极性溶剂以增强微波能量的吸收。首先,在n-Bu3SnH和自由基引发剂VAm-110的存在下,将5加热至180 °C,仅能以1.9%的收率获得目标环化产物4。反应后大量回收的底物5表明即使在高温下,C-Cl键均裂的效率也很低。随后作者尝试在160 °C下将Ph3SnH与VAm-110结合,产率提升至22%。进一步使用更富电子的(c-Hex)3SnH时,产率得到了更大提升。为了避免底物分解和相关副反应,作者降低了反应温度以及还原剂和自由基引发剂的当量。最终,确定了在110 °C下使用3当量(c-Hex)3SnH和1当量V-40为最佳反应条件。值得注意的是,该自由基串联反应一步即构建了五个相邻的立体中心(C8、C9、C10、C11和C17),包括季碳C8和C11,显著增加了分子复杂性。
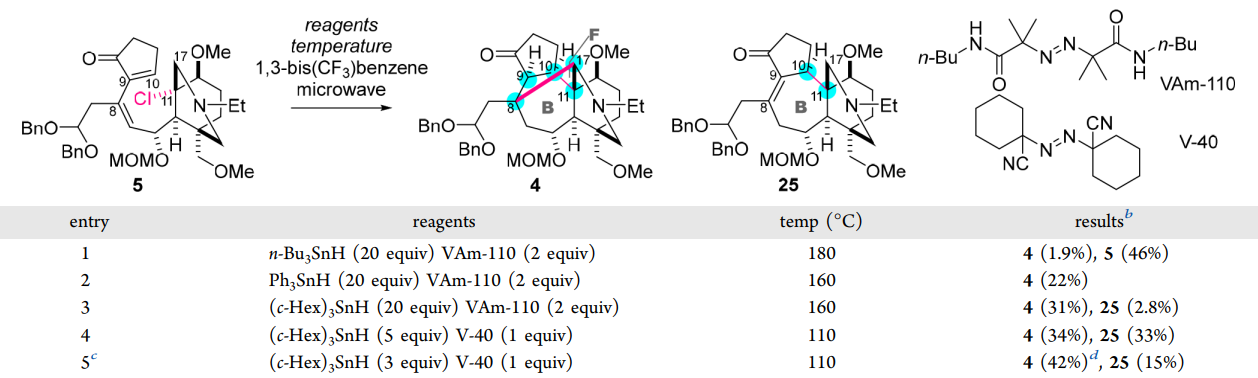
图5. 自由基串联反应条件优化(图片来源: J. Am. Chem. Soc.)
作者同时对该自由基串联过程进行了机理讨论(图6)。该反应包括五个基本历程:(1) 通过C-Cl键均裂形成C11自由基;(2) 在C10和C11处形成七元环B;(3) 从C17到C7的1, 5-氢迁移;(4) 在C17和C8处形成六元环F;(5) C9处自由基与(c-Hex)3SnH间的HAT过程。由于自由基和反应位点之间的良好轨道相互作用,该五步反应具有优异的化学选择性,同时立体选择性可由自由基中间体的空间结构决定。
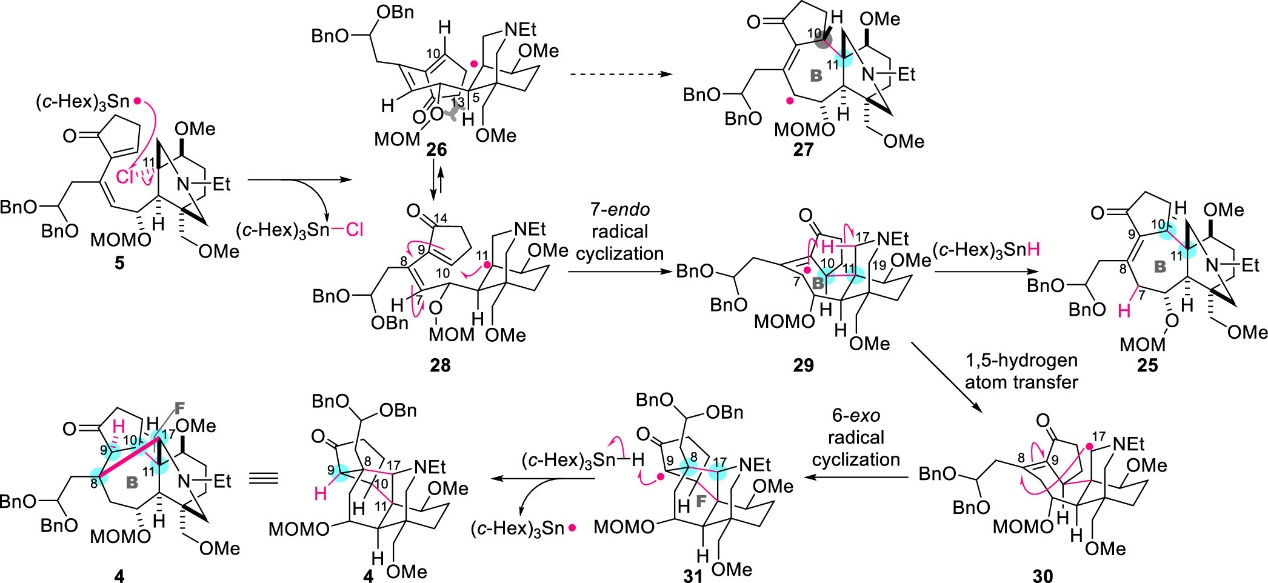
图6. 自由基串联反应的机理推测(图片来源: J. Am. Chem. Soc.)
含ABCEF环的中间体4通过分子内Mukaiyama羟醛反应即可构建最后剩余的六元环D (图7)。首先将4的C14-酮羰基通过TBSOTf和Et3N转化为相应的TBS烯醇醚34。然而,在-20 °C下用SnCl4处理34,仅以7.1%的产率得到缩合产物3-β,主要副产物为醛35。作者利用DFT计算证实了底物与产物相比具有更高的热稳定性,同时32的C16-缩醛位置比C13更接近C14-O。因此,C14-氧原子对C16的亲核进攻会与C13-C16成键过程竞争。这一结果揭示了D环的形成在热力学和动力学上都非常具有挑战性(图8)。
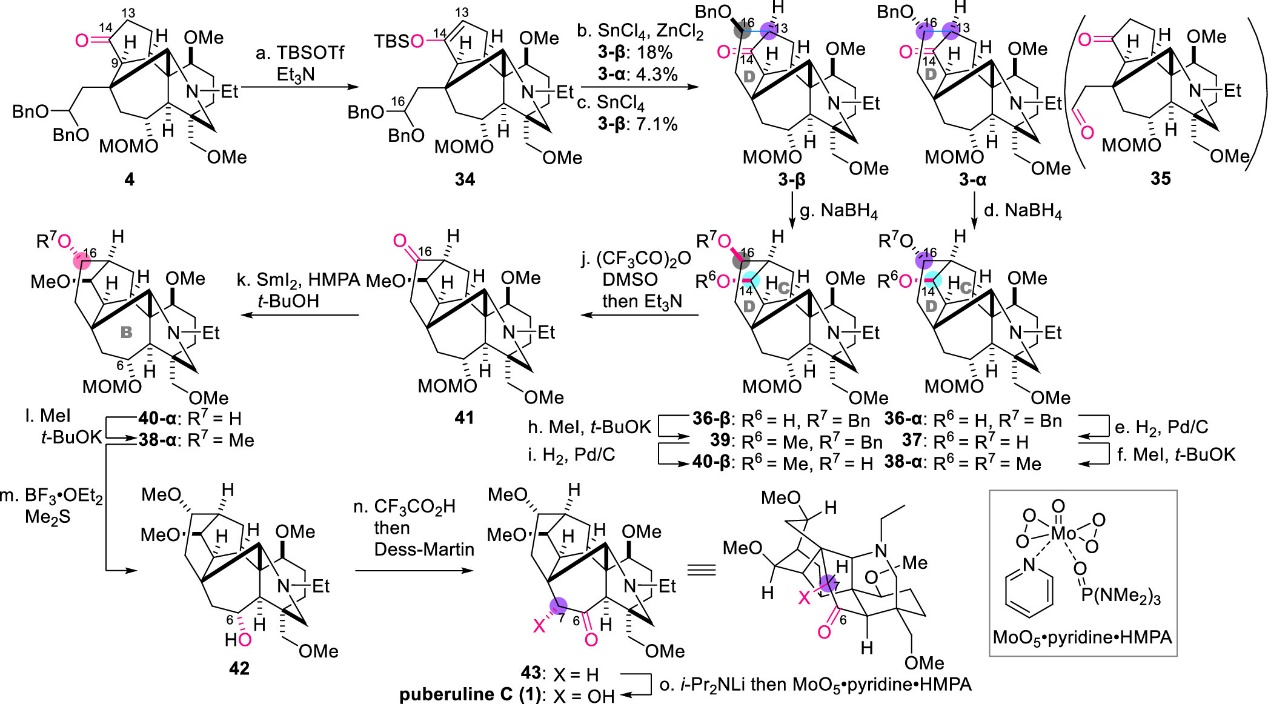
图7. Puberuline C (1)的最终全合成(图片来源: J. Am. Chem. Soc.)
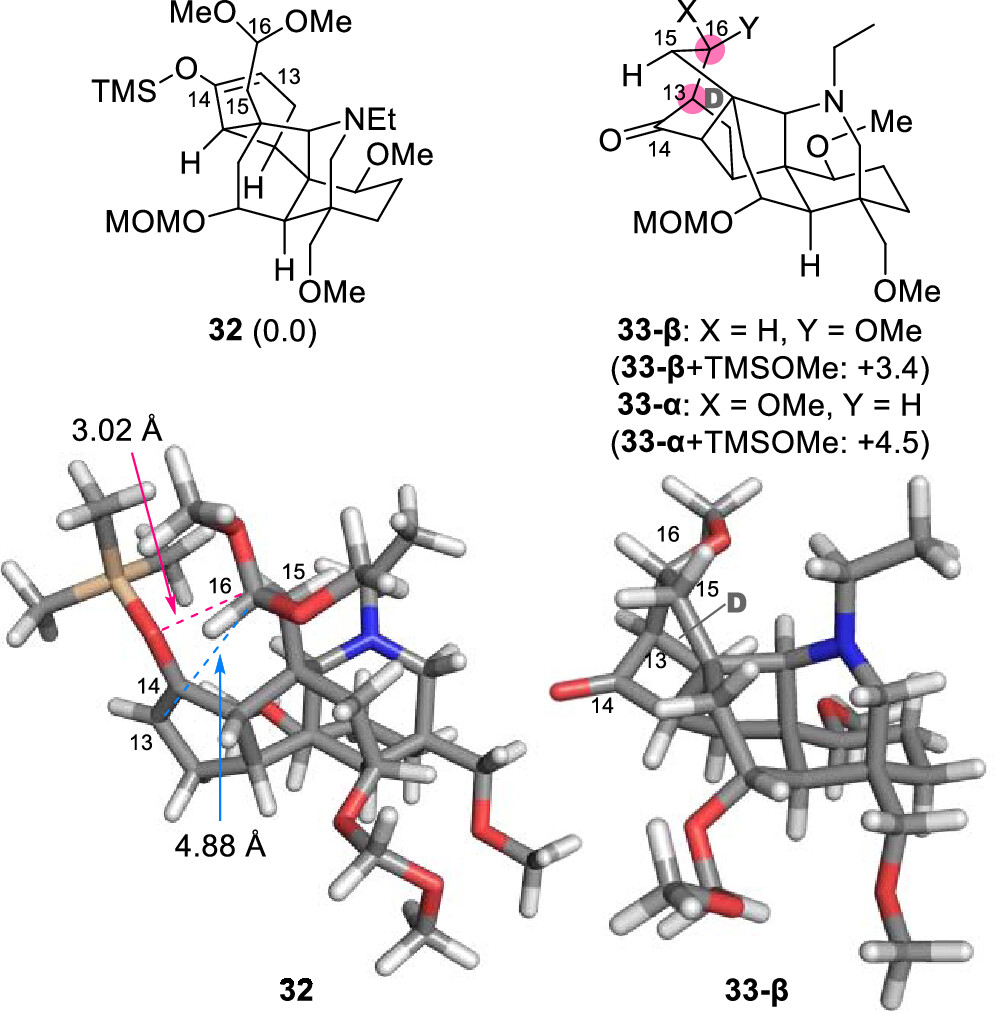
图8. 32和33的结构与吉布斯自由能(图片来源: J. Am. Chem. Soc.)
最后作者通过对该Mukaiyama羟醛反应中路易斯酸、溶剂和反应温度进行了广泛筛选,发现添加等量的SnCl4和ZnCl2,同时加入4 A分子筛,能分别以18%和4.3%的产率得到3-β和差向异构体3-α。该反应成功连接了长空间距离的C13和C16,并建立了正确的C13-立体中心。在构建了整个ABCDEF六环结构后,作者顺利完成了后续含氧官能团的转化,包括C14-酮的立体选择性还原、Pd/C催化苄基醚氢解以及二醇37的双甲基化,得到化合物38-α。最后,利用BF3·OEt2和Me2S脱除MOM保护基并用Dess-Martin试剂将其氧化为酮43,再进行C7-H键的氧化羟基化即可获得最终产物Puberuline C (1),其谱图数据与文献一致。
总结
Masayuki Inoue教授课题组首次完成了C19-二萜生物碱Puberuline C (1)的全合成。该合成路线中的关键步骤在于微波促进的自由基串联反应和SnCl4/ZnCl2 催化Mukaiyama羟醛反应,其中自由基反应的前体化合物5可从2-环己烯酮经历20步获得。此外,这种全新的合成策略将极大地促进其它C18-和C19-二萜生物碱的合成研究,并为相关化合物的药理学研究提供支撑。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn