- 首页
- 资讯
Angew:老试剂新用途:Eschenmoser’s盐用于吲哚嗪的甲酰化
来源:化学加原创 2022-12-14
导读:对C-H键的甲酰化反应是将具有重要作用的甲酰基引入(杂)芳烃中的最直接方法。然而,经典的甲酰化方法的苛刻条件使其官能团兼容性较差,大大限制了它们的应用。近日,西班牙阿利坎特大学Francisco Alonso课题组发现了Eschenmoser’s盐对吲哚嗪(indolizine)的甲酰化反应。该反应直接简便、条件温和,以良好的收率得到甲酰化产物,且具有专一的区域选择性。此外,这些化合物可以很容易地转化为推拉染料,并且在亚硝酸盐的比色检测中具有很高的选择性。
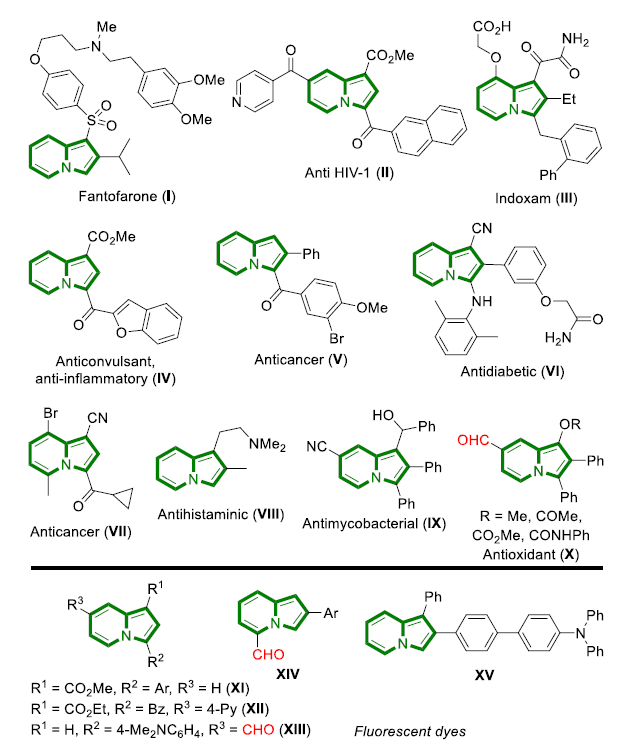
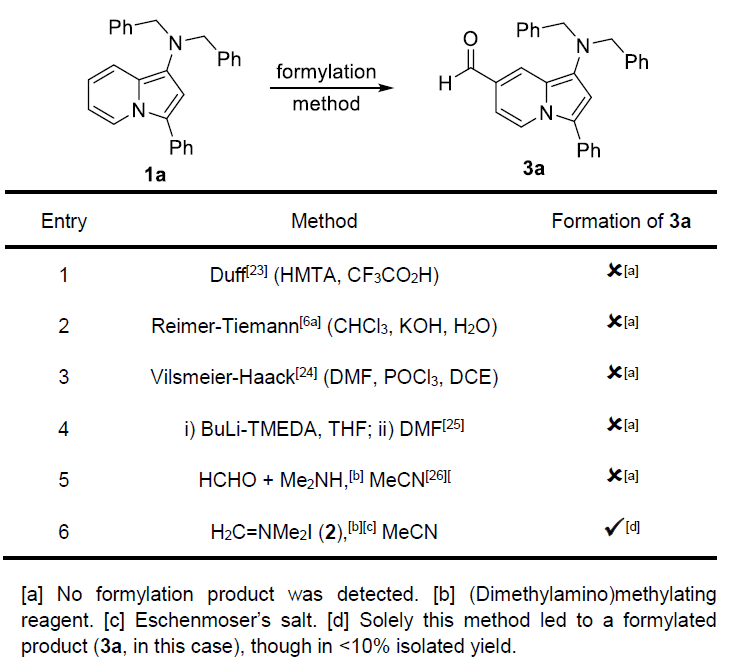
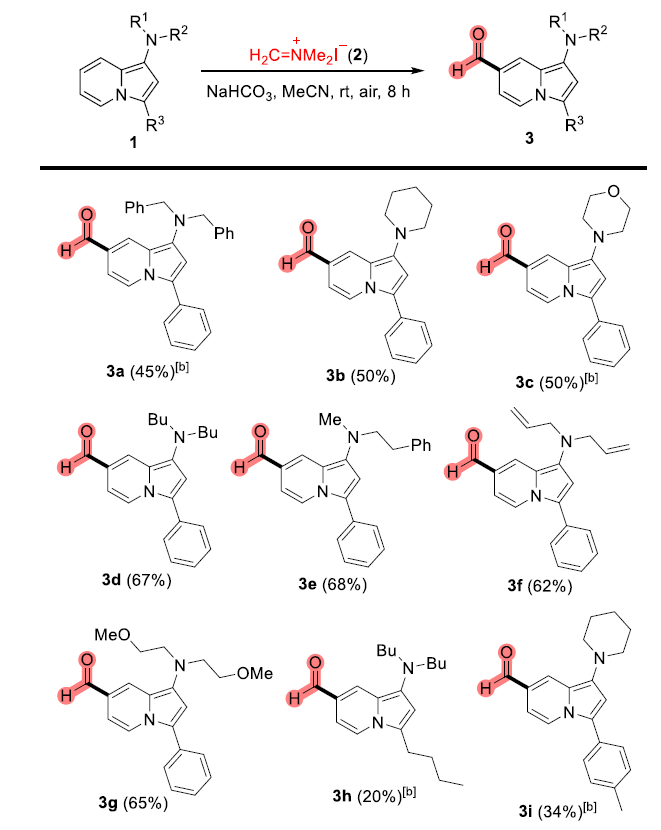
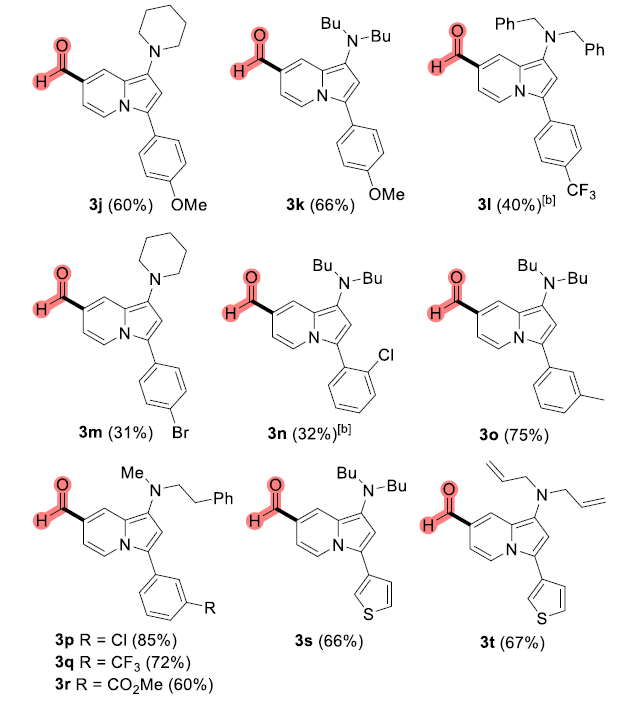
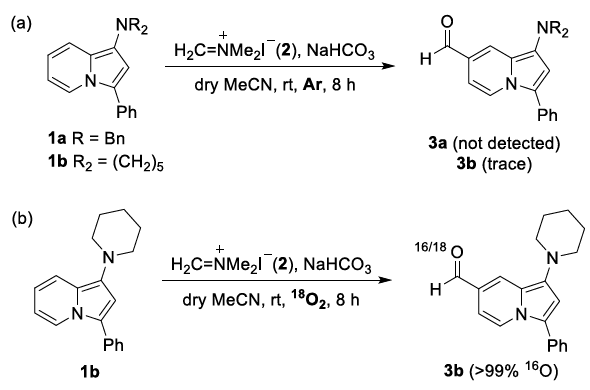
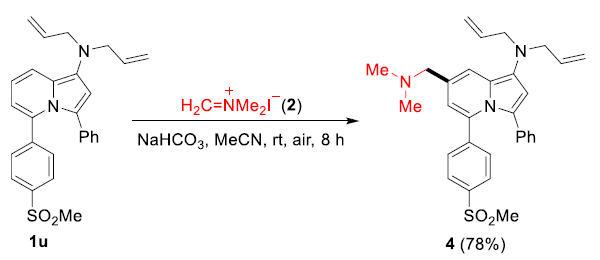
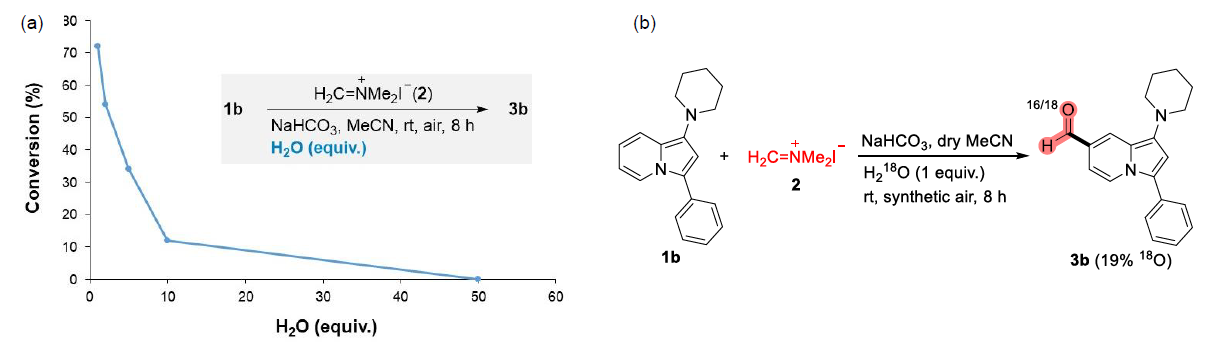
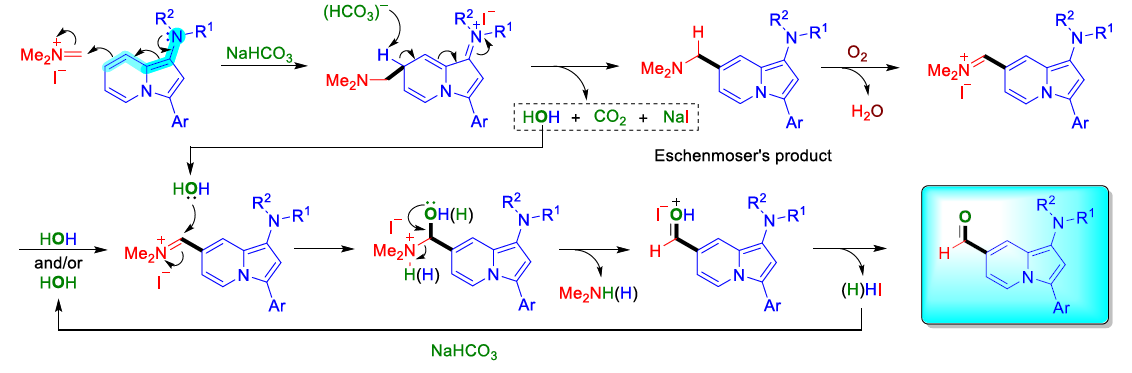
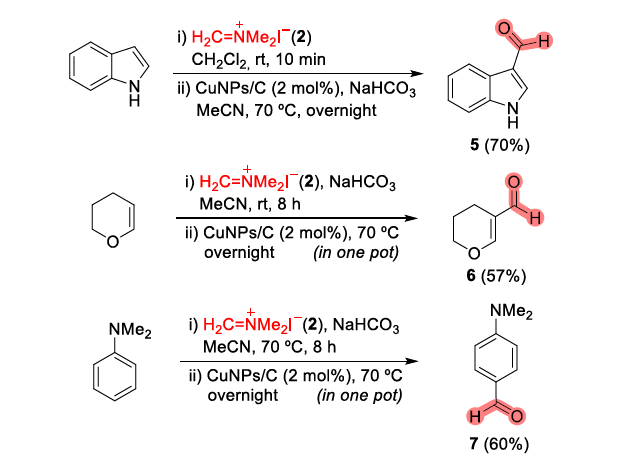
近年来,后期和远端C-H官能团化在药物发现中受到了广泛关注,因为它们高原子经济性地实现了新化学键的连接。甲酰基在合成有机化学中是一种用途广泛的官能团,它与(杂)芳香族化合物的结合通常依赖于Vilsmeier,Reimer-Tiemann和Gatterman反应等经典方法。然而,这些方法所涉及的活泼试剂和苛刻条件往往导致低收率和低选择性(特别是当敏感官能团存在时)。吲哚嗪类化合物是合成杂环化学和药物发现中的特殊分子平台,由于其突出的光物理性质,常常存在于相关的药理活性化合物中,并在材料科学中具有广泛的应用。吲哚嗪-7-醛的合成通常需要在起始原料中预先引入甲酰基或前体官能团的转化。因此,开发高化学选择性与高区域选择性的杂环后期C-H甲酰化方法是很必要的。图1. 研究背景(图片来源:Angew. Chem. Int. Ed.)作者以1a为模型底物进行了条件筛选。首先是对经典的甲酰化方法进行筛选,最后发现Eschenmoser’s盐与1a反应可以得到相应的醛3a,但是收率较低。为了解决这一问题,作者进行了更深入的优化,对溶剂、碱、化学计量比、水的含量、气体氛围和反应时间等进行了大量尝试,最终确定最佳条件为:1a/Eschenmoser’s盐(2)/NaHCO3(1:2:2),MeCN作溶剂,在空气中反应8 h。图2. 条件筛选(图片来源:Angew. Chem. Int. Ed.)随后,作者在最佳条件下进行了底物拓展。一般来说,吲哚嗪的反应性似乎更依赖于3位取代基的电子性质,而不是1-氨基取代基,但二苄基氨基取代的吲哚嗪的反应性相对较低(3a和3l)。3-烷基取代吲哚嗪3h效果最差。当3-芳基邻位和对位具有负电性诱导作用的取代基时也会对反应造成不利影响,加热可以有效提高收率(3l-3n)。相反,苯基(3b-3g)和4-甲氧基苯基取代的(3j和3k)吲哚嗪的产率为中等至良好,后者可能是由于甲氧基的给电子共轭效应。不管取代基的电子性质如何,所有的3-芳基吲哚嗪都以良好的产率(3o-3r)甲酰化;对噻吩基取代吲哚嗪3s和3t也可以发生类似的反应。值得注意的是,在所有例子中,该反应都是区域选择性的,甲酰基全部处在吲哚嗪的7-位。图3. 底物拓展(图片来源:Angew. Chem. Int. Ed.)为了阐明反应机理,作者进行了一系列机理实验。吲哚嗪1u与Eschenmoser’s盐(2)反应得到唯一一个(二甲氨基)甲基化产物而不是甲酰化产物。接下来,作者试图确定甲酰基中氧原子的来源。当加入2的甲酰化反应中水的量增加时,吲哚嗪1b的转化率逐渐显著下降。这种变化可能与水作为副产物形成相一致。因此。在反应介质中加入水不利于取代反应生成所需的产物;但也不能排除是2与水反应失去活性。在干燥空气的气氛与1当量H218O的存在下进行1b的甲酰化反应,产物3b中18O的含量为19%。在干燥的MeCN中进行反应时,1a和1b的甲酰化反应活性急剧下降。在1b (m/z 276)的情况下,GC-MS观察到一个副产物(m/z 274),表明吲哚嗪发生了氧化。但当1b在标准条件和18O2下,并没有观察到明显的18O掺入。因此,上述实验证实(二甲氨基)甲基化吲哚嗪是最可能的中间体,并且空气中的分子氧不是产物氧来源,而是HCO3-。如果考虑到实验中仅有2当量的NaHCO3和1当量的H218O作为O源,则预计反应后18O含量应为14%,与实验测定值(19%)接近。图4. 机理实验(图片来源:Angew. Chem. Int. Ed.)作者提出了如下可能的反应机理: (a) 1与2之间通过1的二烯胺部分发生Friedel-Crafts反应; (b)碱促进的重芳构化得到Eschenmoser产物; (c)其被空气中的氧气氧化生成(二甲基)亚胺离子,同时生成水; (d)亚胺离子与后续的水反应形成氨基醇; (e)二甲胺消除的同时C=O键形成; (f) NaHCO3和Me2NH作用下的最终中和。当使用两个当量的Eschenmoser盐和NaHCO3时,可以更高产率获得甲酰化产物,这可能与前者与原位生成的水反应导致部分失活有关。当吲哚嗪的3-位存在富电子的(杂)芳香取代基时,氧化步骤可能更有利;如果取代基是电中性时情况正好相反。图5. 反应机理(图片来源:Angew. Chem. Int. Ed.)考虑到中间体(二甲氨基)甲基化产物在空气中的氧化可能不像上述化合物那样自发,为体现该方法的应用价值,作者选用了其它杂环进行尝试,分别是吲哚、二氢呋喃和二甲苯胺。这三种底物均可产生(二甲氨基)甲基化产物,但除了二甲苯胺少量(<10%)外没有检测到醛,因此必须额外添加氧化剂。研究发现,铜纳米颗粒在活性炭(CuNPs/C)上的转化是有效的,能以良好的分离收率得到预期的醛5-7(图6)。图6. 反应应用(图片来源:Angew. Chem. Int. Ed.)Francisco Alonso课题组重点介绍了Eschenmoser’s盐在碳酸氢钠存在下作为一种新型甲酰化剂的应用。当其应用于1-氨基吲哚嗪时,可以高区域选择性地在7-位引入甲酰基,产率良好。该反应条件简单且与氨基的存在相容。克服了经典甲酰化方法在这一转化过程中的低效性。机理研究揭示了,甲酰基中的氧原子的来源是HCO3-。作者还证明添加氧化剂或催化剂(如CuNPs/C)可以强制促进(二甲氨基)甲基化中间体的氧化步骤,扩大了应用范围。此外,这些化合物还可以很容易地转化为推-拉染料,在亚硝酸盐的比色检测中具有很高的选择性。
文献详情:
Teresa Antón-Cánovas, Francisco Alonso*. The Eschenmoser’s Salt as a Formylation Agent for the Synthesis of Indolizinecarbaldehydes and Their Use for Colorimetric Nitrite Detection. Angew. Chem. Int. Ed. 2022, https://doi.org/10.1002/anie.202215916
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn