

蛋白质的位点选择性功能化标记在化学生物学中具有广泛的应用。通过化学或酶促反应对蛋白质进行位点选择性修饰对于包括细胞和体内成像、蛋白质组学、药物释放和材料科学在内的各个领域都很重要。天然存在的酶经过工程改造,可以接受N-端、C-端和内部标记具有适当氨基酸识别序列的蛋白质的新底物。这些方法对于特定位点标记蛋白质具有革命性意义,但底物特异性、反应动力学甚至试剂稳定性的差异可能导致标记不完全以及标记和未标记蛋白质不可分离的混合。使用遗传编码的亲和标签纯化复杂混合物(例如裂解物或酶催化标记反应)仅限于从混合物中去除单个蛋白质种类。用小分子亲和手柄标记的蛋白质也可以通过亲和层析选择性纯化。而生物正交化学也已用于将亲和标签共价连接到蛋白质或在树脂上共价捕获蛋白质,这种方法将生物正交基团应用在蛋白质纯化而不是功能分子与蛋白质靶标的结合。广泛的位点选择性蛋白质偶联方法可以受益于小分子、双重用途标签,其中单个官能团既可以促进蛋白质纯化,又可以作为后续快速和定量生物正交标记。
为此,作者开发了具有双重作用的亲和生物正交化学标签(ABC-tags),即促进蛋白质纯化以及作为后续快速和定量生物正交标记的手柄(Fig. 1A)。作者设计了3-甲基-6-(2-吡啶基)四嗪的衍生物,可用于螯合固定化金属离子亲和层析(IMAC)-通常用于蛋白质纯化的树脂(Fig. 1B)。这些小型的两用标签可作为工具,与C-端、N-端或内部残基的位点选择性蛋白偶联方法结合使用。由于四嗪连接的二氢哒嗪产物还保持对亚氨基乙酸镍(Ni-IDA)树脂的亲和力,因此可以在“树脂上”进行蛋白质-蛋白质缀合反应,以提供二聚体和异三聚体蛋白质偶联物,而无需额外的纯化步骤。
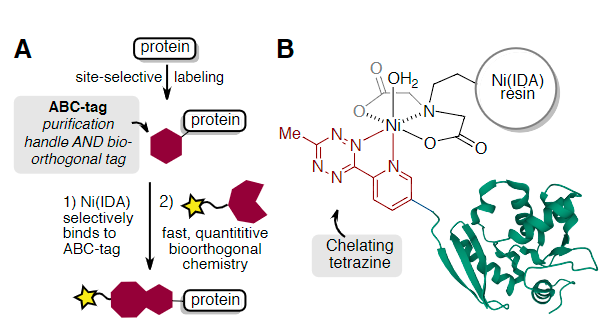
Fig. 1: (A)用于Ni(IDA)纯化标记蛋白和生物正交反应的ABC标记(B)与Ni(IDA)树脂螯合的吡啶基四嗪标记蛋白(PDB_ID 3KZY)(图片来源:Angew. Chem. Int. Ed.)
首先,作者设计并评估了一系列潜在的ABC标标签在连接到模型蛋白时与Ni-IDA琼脂糖树脂结合的能力(Fig. 2)。通过ESI-MS确认绿色荧光蛋白(GFP)用每个标签进行位点特异性标记,并通过紫外-可见光谱测定总结合蛋白(Fig. 2)。初步研究结果表明吡啶基取代基的重要性(Fig. 2)。附加双吡啶基-Tz标签(1g)将结合能力提高到9 mg/mL,相对于1d增加了2.6倍,这表明使用多价吡啶基-Tz附件的方法可用于提高结合能力。
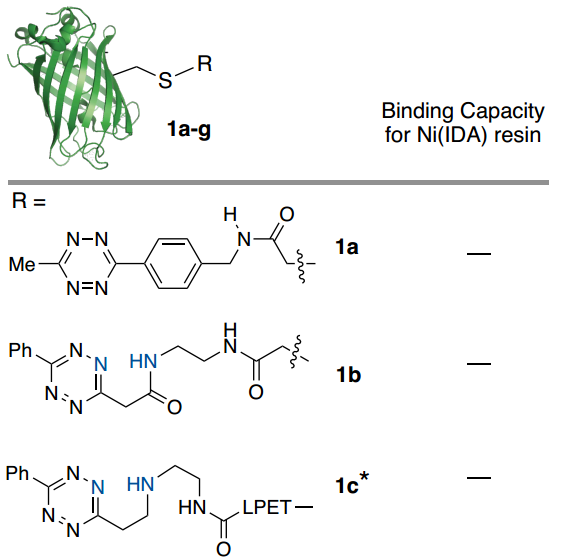
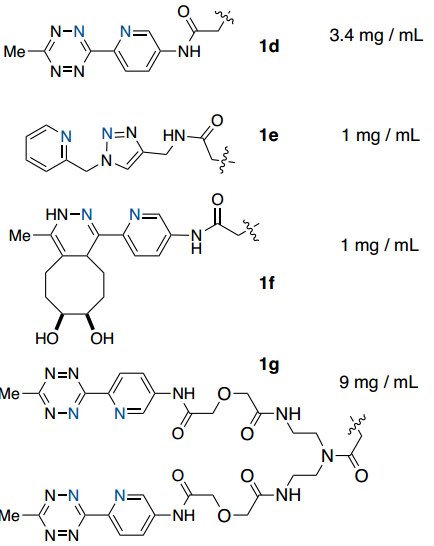
Fig. 2: GFP(PDB_ID 2B3P)用一组四嗪化合物在半胱氨酸处进行了位点特异性修饰并评估了与Ni(IDA)树脂的结合能力(图片来源:Angew. Chem. Int. Ed.)

Fig. 3: 从复杂混合物中纯化:C-末端分选酶连接(图片来源:Angew. Chem. Int. Ed.)
在蛋白质位点特异性标记研究方面,对C-末端标记和纯化酶催化的生物交联已成为一种用于将生物正交手柄与蛋白质进行位点特异性结合有效且简单的方法。与先前关于SrtA7M生物偶联的报道一致,每种蛋白质反应混合物都以良好的收率获得了所需的偶联物(POI-LPET-pyTz);对于除GFP和Her2-affibody之外的所有蛋白质,通过ESI-MS分析,标记蛋白质的百分比大于50%。反应混合物中还存在与蛋白质起始原料(POI-LPETGG)、SrtA7M酶和/或水解蛋白质(POI-LPET)一致的杂质(Fig. 3)。经过洗柱、洗脱,通过UV-Vis确定蛋白质回收率,并通过ESI-MS评估纯度。对于每次洗脱,仅观察到POI-LPET-pyTz偶联物,回收率范围为72-95%(Fig. 3)。此外,还使用GFP、SnapTag、5F7纳米抗体和NanoLuc荧光素酶进行了测试,对于通过FPLC纯化的每种蛋白质,回收率都很高(>85%)。同时,作者也表征了ABC标记策略在N-端直接标记的应用效果。为此,作者合成了ABC标记的CBT配体(3),用于证明N-端直接标记单体链霉亲和素2(mSA2),并通过ESI-MS确定标记蛋白质的百分比(Fig. 4B)。纯化后蛋白的ESI-MS包含一个对应于mSA2-四嗪偶联物的峰和一个由于单次氧化引起的小峰。mSA2-四嗪偶联物的回收率为88%(Fig. 4)。
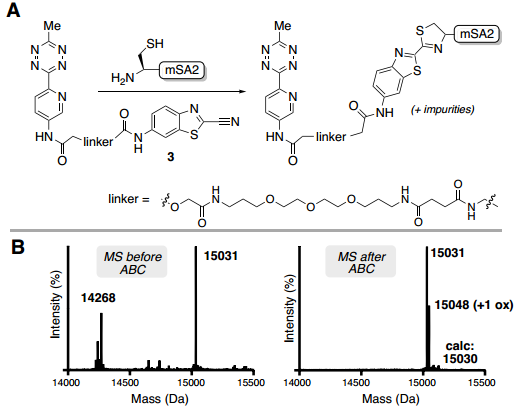
Fig. 4: 使用CBT连接纯化N端修饰的mSA2(图片来源:Angew. Chem. Int. Ed.)
此外,为了验证ABC标签是否能够从复杂混合物中实现目标蛋白质的纯化,作者从未知蛋白质的复杂混合物中测试了ABC纯化能力,将确定量的GFP-pyTz以低丰度掺杂到细菌细胞裂解混合物中(Fig. 5E)。通过Ni-IDA纯化细菌裂解物,并以83%的收率回收纯GFP-pyTz(>90%,凝胶)。
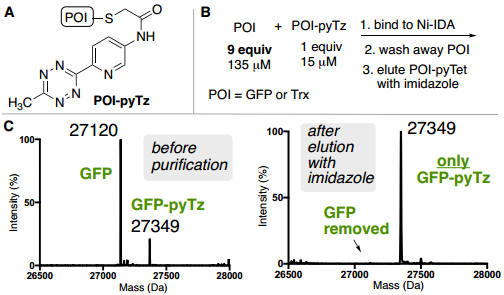
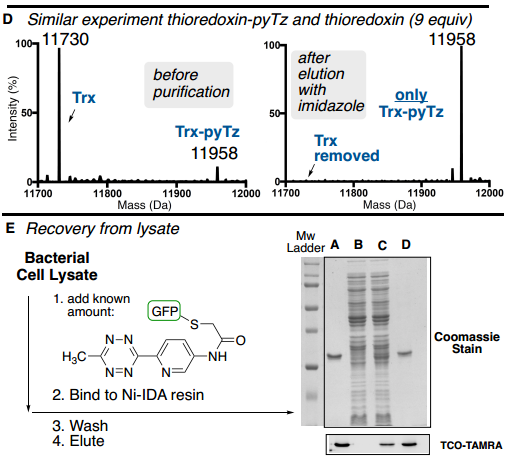
Fig. 5: ABC标签蛋白质混合物中对低丰度目标蛋白的纯化表征(图片来源:Angew. Chem. Int. Ed.)
最后,pyTz蛋白原位结合Ni-IDA树脂用于纯化目的的能力使作者考虑树脂结合蛋白是否可以促进与游离sTCO蛋白对应物的反应以实现有效的蛋白偶联。ABC标记的蛋白质偶联物是在几分钟内形成,通过二氢哒嗪接头保持树脂结合,并将杂质冲走,用于实现高效的蛋白质-蛋白质结合和纯化。作者通过分选酶连接制备带有sTCO(5)或pyTz(6)的C-末端Snap标签的偶联物。成功的C-末端连接的SnapTag偶联物(7)通过二氢哒嗪接头与树脂保持结合,并通过ESI-MS和SDS-PAGE确定其完全洗脱(Fig. 6A)。证实了使用合成接头不仅可以实现蛋白质二聚体偶联,还可以扩大异三聚体的使用范围。同时,使用合成接头不仅可以实现直接蛋白质-蛋白质结合,还可以扩大获得蛋白质异源三聚体的途径(Fig. 6B)。
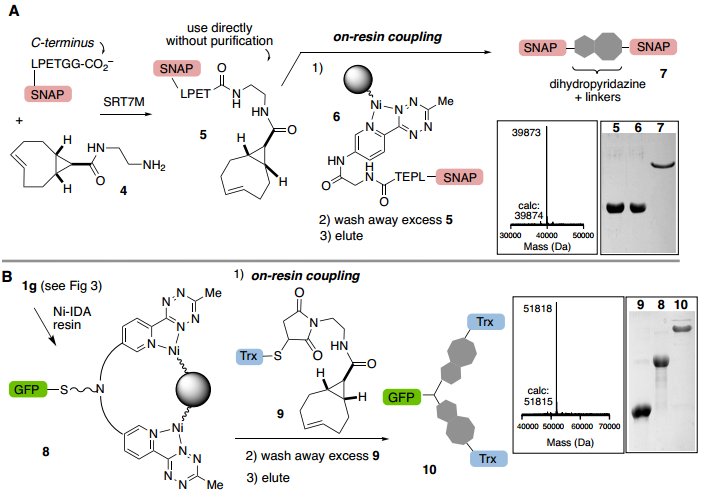
Fig. 6: 树脂上的蛋白质偶联反应(图片来源:Angew. Chem. Int. Ed.)
总结
Samuel L. Scinto和Joseph M. Fox团队开发了具有双重功能的2-吡啶基-四嗪ABC标签,可通过与Ni(IDA)树脂的原位配位实现蛋白质纯化和生物正交化学反应。ABC标记蛋白和互补sTCO标记蛋白之间的树脂上反应通过二氢哒嗪接头保持结合,从而能够在数分钟内以高纯度一步构建具有确定几何形状的二聚体和异源三聚体蛋白偶联物。同时,作者预计ABC标签将普遍用于需要纯生物偶联物和快速体外蛋白质组装。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn