

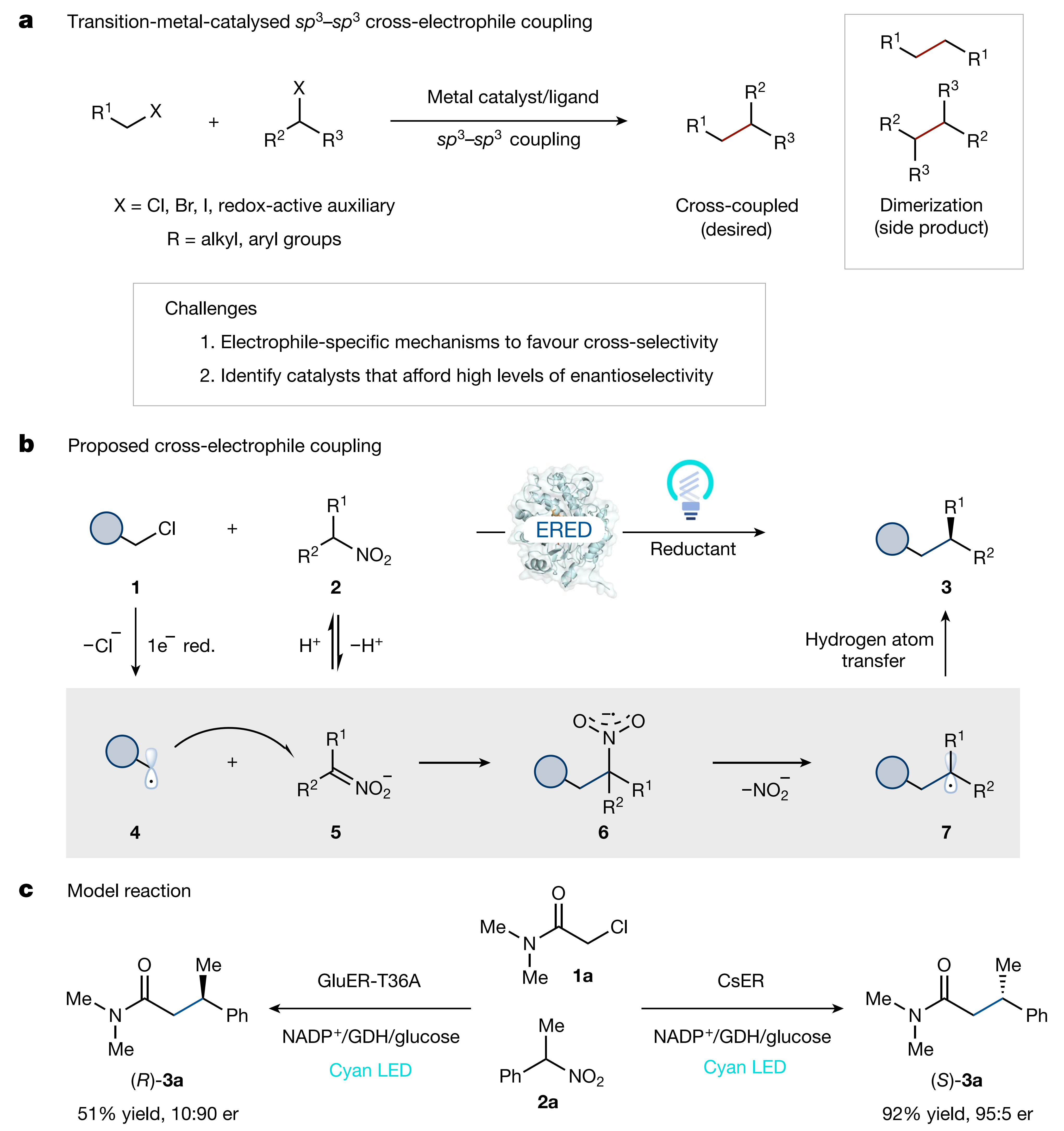
图1. 光酶催化不对称XEC反应(图片来源:Nature)
催化交叉偶联形成Csp2–Csp2键已彻底改变了有机合成,在制药和农化行业都具有广泛应用。随着目标分子结构越来越复杂,特别是结构中含有大量sp3杂化的原子和手性中心时,就需要发展高立体选择性的策略来构筑Csp3–Csp3键。两个完全不同的Csp3-亲电试剂偶联可在一定程度上替代传统的交叉偶联,因为该方法具有更好的官能团容忍性,且不需要使用敏感的有机金属试剂。然而,由于金属催化剂很难区分两个不同的Csp3-亲电试剂,这些反应的选择性并不好,通常得到自偶联产物。在此之前,催化不对称Csp2–Csp3交叉偶联已经取得不错的结果,但不对称Csp3–Csp3交叉亲电偶联却尚未突破(图1a)。
利用生物催化反应具有高选择性这一特点,作者考虑是否存在一种酶可以催化不对称Csp3–Csp3交叉偶联,探索以前不被重视的机理和催化策略。作者根据硝基烷烃的反应性,设想了一种机理:首先卤代烷烃被还原形成烷基自由基4,它可以与原位生成的中间体5反应形成新的C–C键和硝基自由基负离子6。随后酶介导的C–N键裂解产生亚硝酸盐和一个烷基自由基7,最后通过氢原子转移(HAT)终止,得到交叉偶联产物3(图1b)。
上述设想最大的挑战在于如何精确控制电子转移过程的化学选择性。最近,包括本文作者在内的多个课题组证明了黄素依赖‘烯’还原酶(EREDs)可以利用蛋白质模板电荷转移(CT)配合物还原卤代烷。如果蛋白质只与卤代烷形成CT络合物,则会在硝基烷烃上选择性还原。最后,EREDs可以精确控制自由基终止步骤HAT的立体化学,使产物具有优异的对映选择性。
首先,作者使用α-氯代酰胺1a及1-硝基乙基苯2a作为模板底物,在青色光(λmax = 497 nm)的激发下,很多‘烯’还原酶都可以顺利催化该反应,得到亲电交叉偶联产物3a。如图1c所示,来源于惰性柄杆菌的‘烯’还原酶CsER展现出优异的立体选择性控制,以28%的收率和95:5 er得到产物(S)-3a,继续调节反应体系的pH,反应收率可提高到92%,对映选择性保持不变。有趣的是,源自于氧化葡糖杆菌的还原酶变体GluER-T36A有利于得到对映体(R)-3a(51%收率,10:90 er)。控制实验表明,ERED、青色光和NADPH(还原型辅酶Ⅱ)的循环再生(GDH/NADP+/glucose)均是实现优异反应性的关键。值得注意的是,使用其他的光氧化还原催化剂时并不能得到产物3a,当Ir(ppy)3作为催化剂时,只检测到硝基烷烃2a被还原成肟,该结果也证明了生物催化独特的反应性。
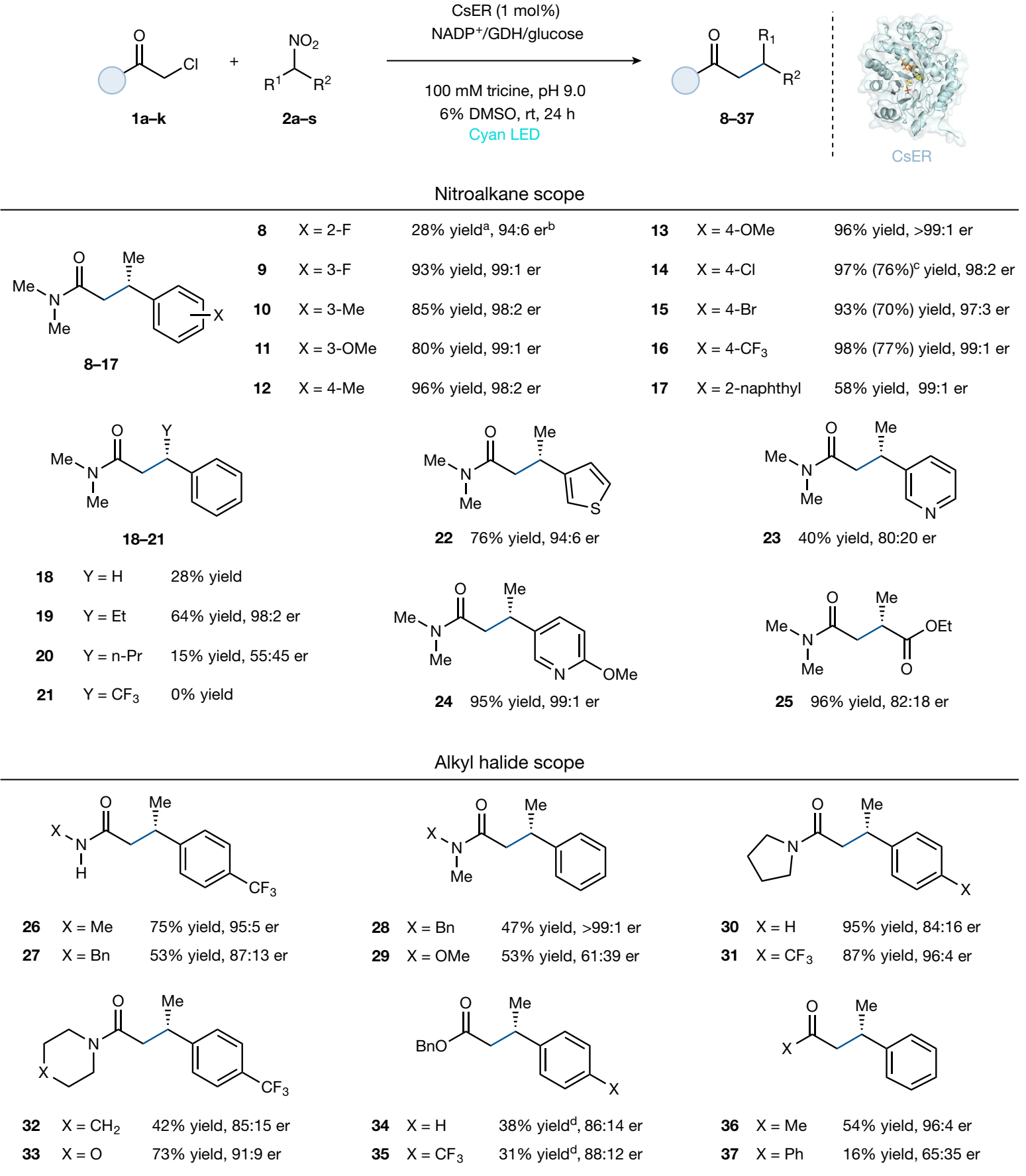
图2. 底物适用范围(图片来源:Nature)
基于上述最优反应条件,作者对该体系的底物适用范围进行了考察(图2)。对于α-芳基硝基乙烷,芳基间位或对位含有供/吸电子基团都能以优异的结果转化为目标产物9-16。芳基邻位有取代基时反应结果较差(8),位阻较大的α-萘基硝基乙烷也可在体系中兼容(17)。然而,这种酶局限于α-位上相对较小的烷基取代基,只有α-位为甲基或乙基时才能取得不错的结果(18-21)。另外,这种酶催化体系可以兼容含有各种杂环的硝基烷烃类底物(22-24),以及α-硝基丙酸乙酯(25)。
对于α-卤代乙酰胺底物而言,氮原子上取代基的结构对反应的结果影响很大,含有甲基或苄基的二级酰胺底物以不错的对映选择性得到产物26和27。含有四氢吡咯、哌啶或吗啉等骨架的三级酰胺,以及线性Weinreb酰胺以中等到优异的收率和对映选择性得到目标产物(28-33)。另外,该体系对α-卤代酯和α-卤代酮也能不错的兼容(34-37)。
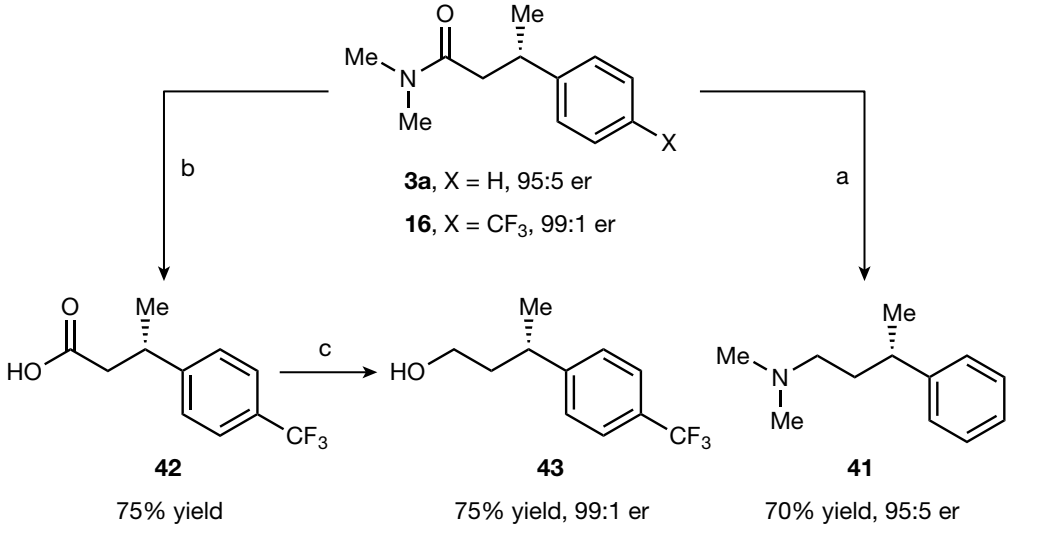
图3. 产物衍生化(图片来源:Nature)
作者也尝试对XEC产物进行衍生转化,如图3所示,β-手性酰胺3a可以顺利地还原成三级胺41,产物16也能顺利地水解成酸(42)并进一步还原成醇(43),对映选择性均可以保持。
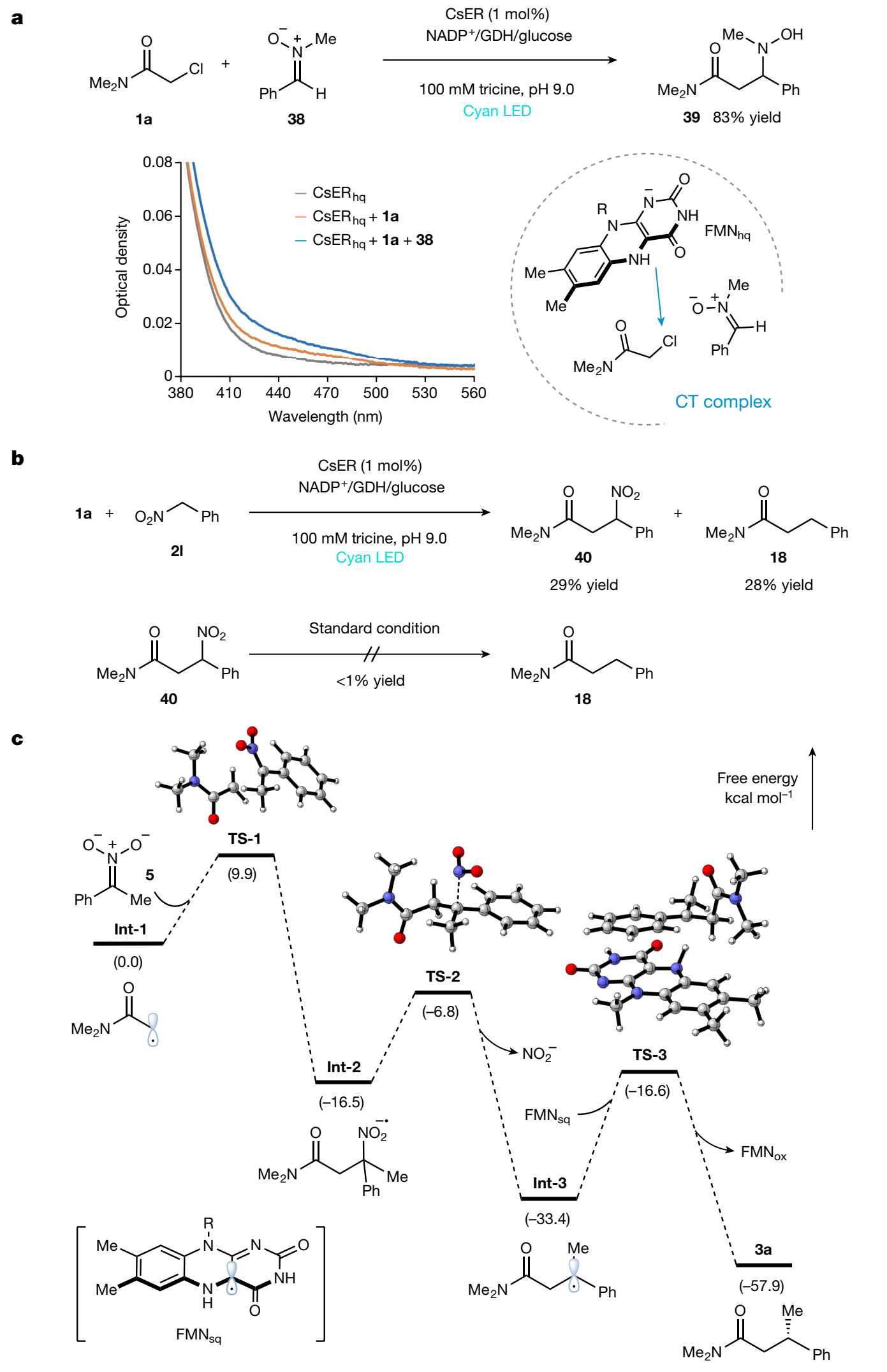
图4. 反应机理研究(图片来源:Nature)
最后,作者对反应机理进行详细的研究,包括UV-Vis光谱实验,控制实验和DFT计算(图4)。首先,UV-Vis光谱实验表明α-氯代酰胺1a与FMNhq之间形成CT复合物,而在可见光照射下硝基烷烃2a与CsER和辅助因子的实验结果表明初始阶段硝基烷基还原是可以发生的。如图4a所示,将硝基中间体5的类似物硝酮38加入到1a和还原的CsER体系时,UV-Vis光谱表明CT复合物的信号进一步增强,表明反应过程中形成了四元CT复合物,能够有效促进自由基的形成和自由基间的加成。在标准条件下,当α-硝基甲苯2l与1a反应时,可以得到交叉偶联的目标产物18(28%)和硝基化合物40(29%),然而将产物40再次置于标准条件下,并没有检测到产物18,由此可推断化合物40不是偶联产物18的中间体(图4b),进一步研究发现该反应条件下脱硝过程和电子转移到FMNsq之间存在竞争。作者也对标准反应进行了DFT计算,图4c结果表明初始的α-酰胺自由基int-1与中间体5快速加成形成自由基负离子中间体int-2,随后它经历一个不可逆的脱硝基过程得到中间体Int-3,最后通过HAT过程被FMNsq淬灭得到产物3a,这一过程也被氘代实验证实。另外,硝基甲苯2l的DFT计算研究表明,与2a参与的模型反应相比,初始加成和脱硝基过程的能垒均高于模型反应,此结果也说明脱硝基过程较慢,并且自由基负离子Int-2'可以被FMNsq氧化终止,最终得到产物40。
总结
Todd K. Hyster教授课题组报道了一种前所未有的光酶催化的对映选择性sp3-sp3交叉亲电偶联反应。这种新的不对称Csp3-Csp3键形成反应由‘烯’还原酶催化,突出了生物催化剂在区分Csp3亲电底物和控制立体选择性方面的巨大优势。通过使用非传统的偶联底物和机理,解决了过渡金属催化交叉亲电偶联长期存在的立体选择性问题。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn