

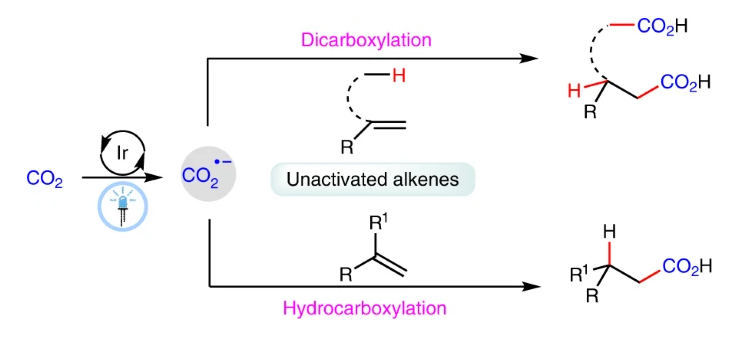
(图片来源:Nature Catalysis)
光合作用是利用光能使二氧化碳(CO2)和水转化为有机化合物和氧气的重要过程。一个多世纪以来,化学家们一直在效仿大自然,利用光催化来实现其它策略难以实现的化学转化。除了紫外光驱动的反应过程外,可见光催化由于具有条件温和、官能团兼容性好等特点,是实现惰性键活化的有力工具。
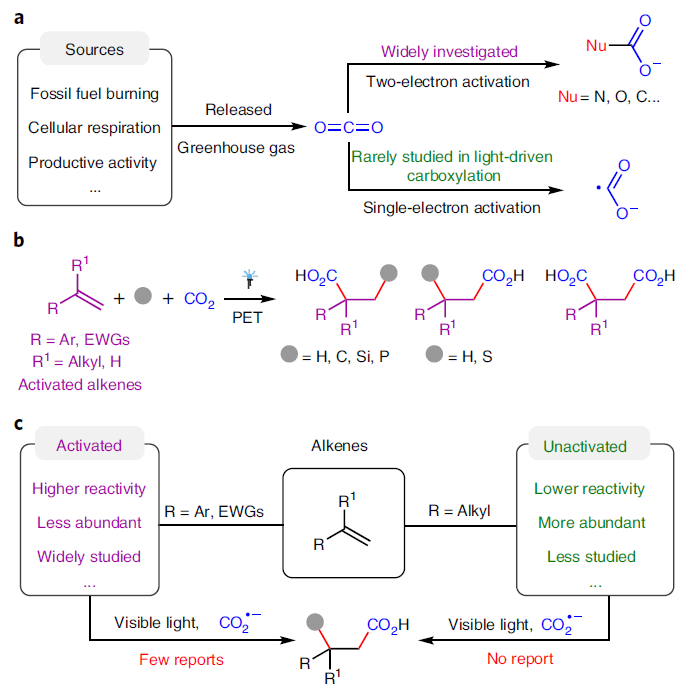
由于CO2具有含量丰富、简单易得、毒性低等特点,目前已经成为化学合成中理想的碳源。近些年,利用可见光催化实现二氧化碳的合成转化引起了化学家们的广泛关注。除了利用燃料分子和大宗化学品的还原之外,使用可见光催化二氧化碳参与的羧基化反应(双电子活化模式)是合成具有较高实用价值的羧酸及其衍生物的有效手段,并在制药和高分子工业中具有广泛的应用。虽然通过CO2的直接单电子还原生成的CO2自由基阴离子(CO2•−)可以为多样的化学选择性和区域选择性转化提供新的策略,但由于CO2具有较高的还原电位以及CO2•−的不稳定性,使得其很少应用在在光催化的羧基化反应中(Fig. 1a)。
由于烯烃可以从大宗化学品中获得且碳碳双键为有机化合物中最常见的官能团,因此烯烃是在可见光催化CO2参与的羧基化反应中研究最多的分子。目前,化学家已经发展了多种光催化体系,以不同化学选择性和区域选择性实现了从烯烃到多样羧酸的制备。然而,这些反应大多仅限于活化烯烃,如苯乙烯和丙烯酸酯等(Fig. 1b,1c)。相反,烷基烯烃(非活化烯烃)由于具有低活性和难以控制选择性等问题则很少应用在可见光催化的CO2参与的羧基化反应中。
最近,四川大学余达刚课题组实现了可见光催化CO₂与非活化烯烃的双羧基化和氢-羧基化反应。在温和的反应条件下,多种非活化烯烃可以经历此选择性羧基化过程,以中等至良好的产率实现相应的羧酸、二羧酸以及非天然α-氨基酸衍生物的合成。反应机理涉及CO2通过连续光诱导的电子转移过程被还原为CO2•−,随后此物种进攻非活化烯烃以及后续的氢原子转移等相关过程得到相应的产物(Fig. 1e)。此外,DFT计算表明,无论是从热力学还是动力学上来看,CO2•−与活化烯烃的自由基加成比与非活化烯烃自由基加成无论在热力学还是动力学上均更有利,因此证明此过程具有一定的挑战性(Fig. 1d)。
(图片来源:Nature Catalysis)
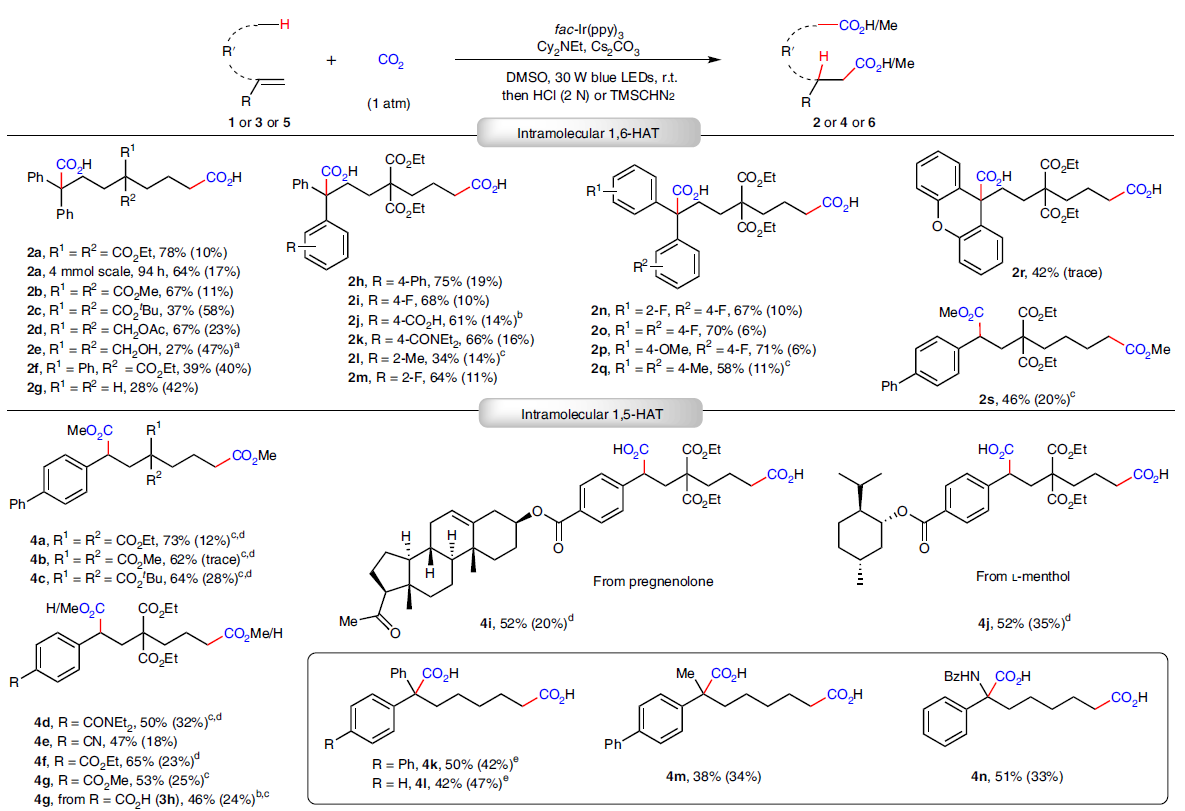
首先,作者以非活化烯烃1a作为模板底物进行条件筛选。发现当使用fac-Ir(ppy)3(1 mol%)作为光催化剂,Cs2CO3(4.5 equiv)作碱,Cy2NEt(2.5 equiv)作为电子给体,DMSO(0.1M)作溶剂,在1 atm CO2存在下,蓝光引发,室温反应48小时可以以78%的产率得到目标1,7-双羧基化产物2a。且控制实验表明,体系中的可见光、光催化剂、Cy2NEt、Cs2CO3以及CO2均为高产率实现产物合成的重要因素。
在得到了最优条件后,作者对此1,7-双羧基化反应中非活化烯烃1的底物范围进行了探索(Fig. 2)。实验结果表明,一系列烷基链上的不同取代均可兼容,且具有偕二乙氧基羰基的产物(2a)产率最佳(78%)。并且当反应放大至4.0 mmol规模时仍可以以64%的产率得到产物。芳环上具有不同吸电子基和给电子基的底物(1h-1q)也均可兼容此体系,以中等至良好的产率得到相应的产物。值得注意的是,一些具有重要应用价值的官能团,如C-F键(1i, 1m-1p)、羧酸(1j)、酰胺(1k)等均可兼容,这为产物的进一步转化提供了机会。遗憾的是,可能是由于立体位阻的影响,芳环上含有邻位取代基时产物的产率较低(1l, 1m, 1n)。除此之外,含有氧杂蒽骨架的原料1r也可以顺利实现转化,以42%的产率得到产物。
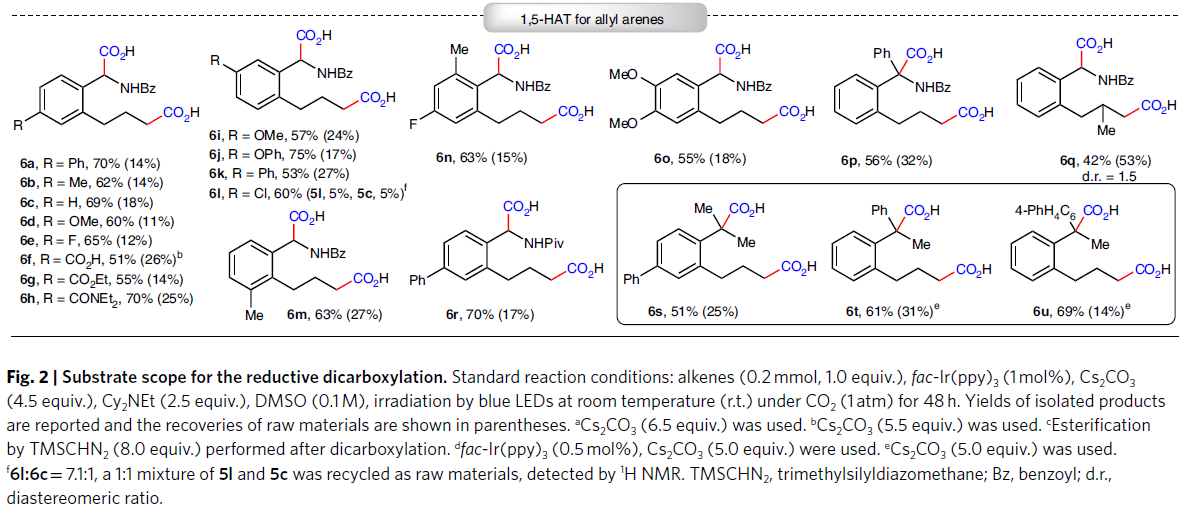
随后,作者利用含有苄位C-H的非活化烯烃3,通过分子内1,5-HAT过程可以顺利实现1,6-双羧基化产物的合成。并且此双羧基化过程并不受烷基链取代的影响(3a-3c)。此外,芳基上的不同官能团,如酰胺(3d)、腈(3e)、酯(3f, 3g, 3i, 3j)以及羧酸(3h)均可兼容。值得注意的是,具有复杂天然产物骨架的底物,如pregnenolone (3i)和L-menthol (3j)也可以分别以52%的产率得到相应的产物。接下来,基于非天然α-氨基酸衍生物的重要性,作者还实现了邻位烯丙基取代的苄胺衍生物(5a-5r)的双羧基化反应。且此过程可以同样具有良好的官能团兼容性,如甲氧基(5d, 5i, 5o)、羧酸(5f)、酯(5g)、酰胺(5h)、苯氧基(5j)、C-F键(5e, 5n)等均可兼容此反应。值得注意的是,此转化不受芳环邻位取代基的限制(5m, 5n)。除了α-氨基酸衍生物外,利用此方法还可以以中等至良好的产率实现含有季碳中心羧酸(6s-6u)的合成,并且此类化合物用其它方法较难获得(Fig. 2)。
(图片来源:Nature Catalysis)
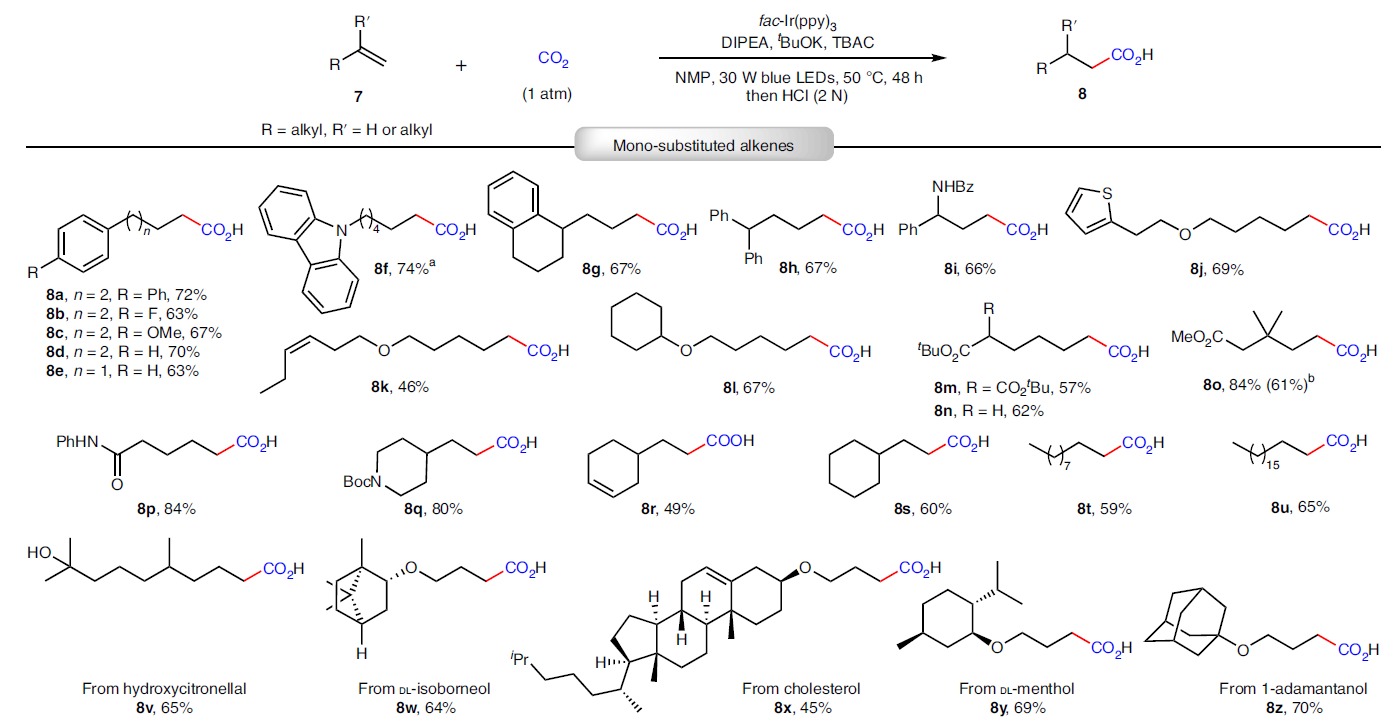
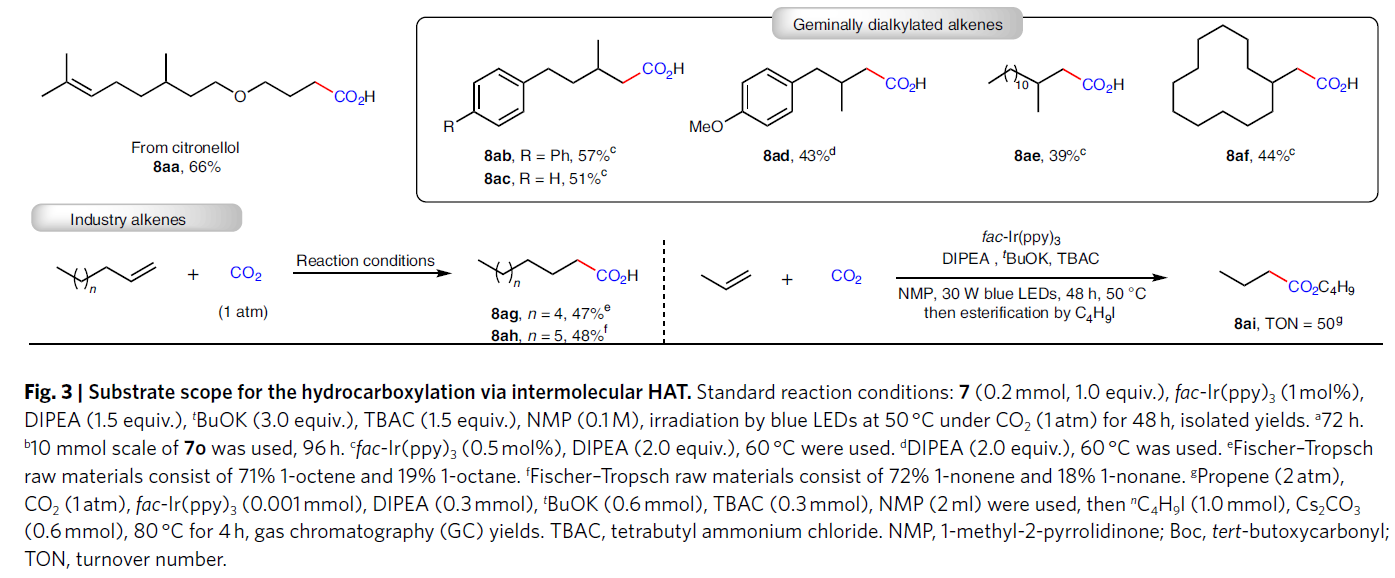
除了利用分子内的HAT过程实现双羧基化以外,作者还进一步探索了非活化烯烃的氢-羧基化反应(Fig. 3)。高兴的是,稍微改变一下反应条件,作者可以顺利实现可见光催化非活化烯烃与CO2的氢-羧基化过程,以中等至良好的产率得到相应的反马氏规则(anti-Markovnikov)产物。反应可以兼容不同链长和取代的非活化烯烃。此外,一些具有较大应用价值的官能团,如酰胺(7i, 7p, 7q)、酯(7m-7o)、羟基(7v)以及杂环(7f, 7j, 7q)等均可兼容。值得注意的是,此反应可以高选择性的实现端烯的转化,而分子内存在的内烯部分则可以在此还原体系内兼容(7r, 7x, 7aa)。此外,此反应策略还可以实现药物衍生物的后期修饰,得到产物8v-8aa。除了单取代烯烃之外,偕二烷基烯烃也可以作为合适的底物实现此转化,以中等产率得到相应的羧酸(8ab-8af)。为了进一步证明此方法的通用性,作者利用工业上得到的混合烯烃和烷烃参与反应,其可以选择性的实现端烯的转化得到产物8ag和8ah。对于广泛应用的大宗化学品丙烯也可以利用此方法实现重要的丁酸衍生物8ai的合成。此外,对于7o,当将反应放大至10.0 mmol规模时,仍可以以61%的产率得到8o。
(图片来源:Nature Catalysis)
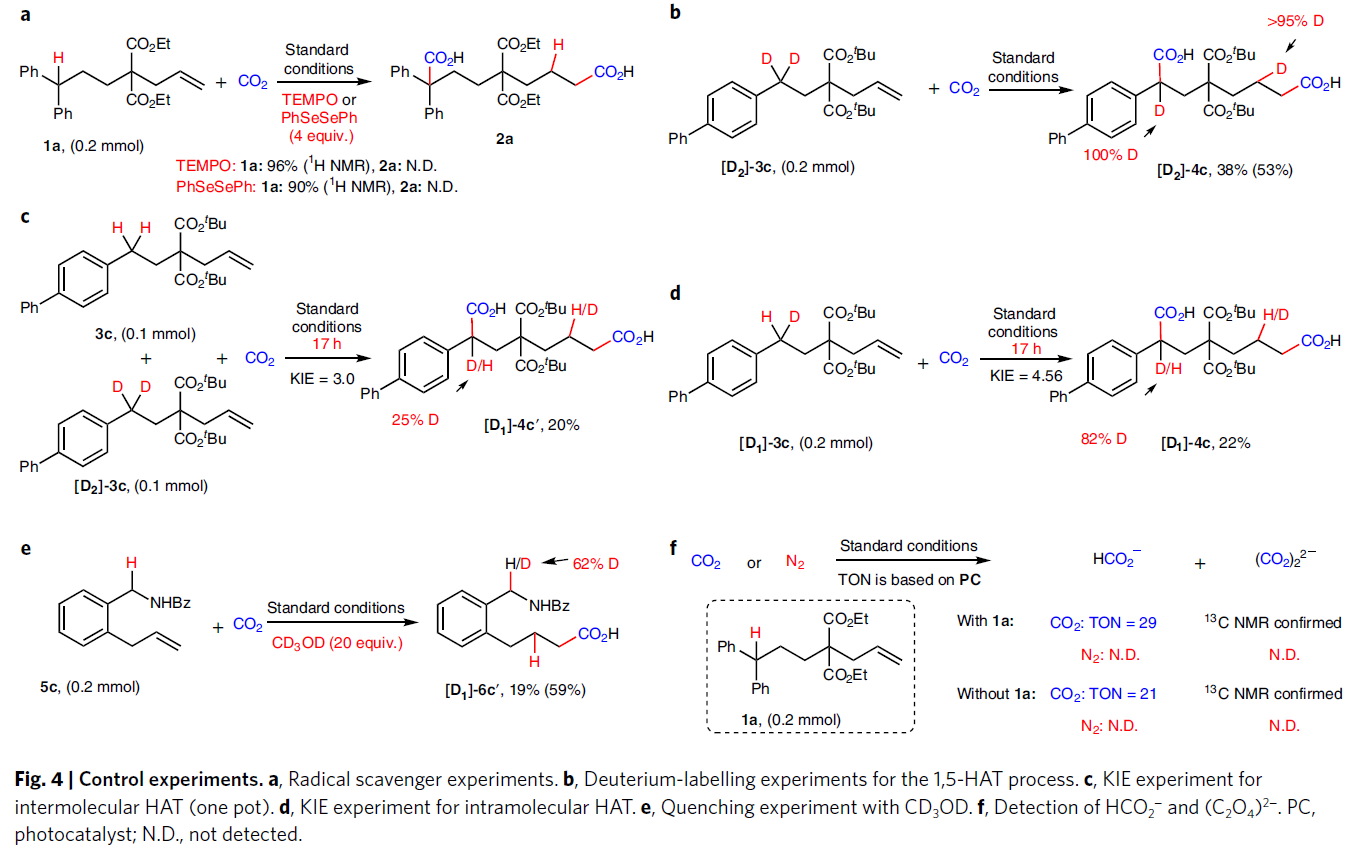
为了深入理解反应机理,作者进行了一系列控制实验(Fig. 4)。首先,在自由基捕获剂TEMPO或PhSeSePh存在下,作者并未观察到目标产物的生成并几乎全部回收起始原料1a,表明反应中可能涉及自由基中间体(Fig. 4a)。随后,作者利用[D2]-3c参与反应,可以发生全部的氘原子转移,得到相应的产物[D2]-4c。这表明反应中涉及分子内的HAT过程(Fig. 4b)。接下来, 分子间(KIE = 3.0)和分子内(KIE = 4.56)KIE(kinetic isotope effect)实验表明分子内的HAT可能为反应的决速步骤(Fig. 4c, 4d)。当在标准条件下加入氘代甲醇时可以观察到苄位的氢被部分氘代,表明反应中可能涉及苄位碳负离子中间体(Fig. 4e)。此外,作者通过在存在或不存在烯烃1a的条件下分别监测HCO2−与(C2O4)2−的形成,得出CO2可能会在还原条件下被还原,由此也进一步证明了CO2•−的形成(Fig. 4f)。
(图片来源:Nature Catalysis)
总结
四川大学余达刚课题组实现了可见光催化CO₂与非活化烯烃的双羧基化和氢-羧基化反应。在温和的反应条件下,多种非活化烯烃可以经历此选择性羧基化过程,以中等至良好的产率实现相应的羧酸、二羧酸以及非天然α-氨基酸衍生物的合成。反应具有良好的底物适用性和官能团兼容性并且能够兼容一系列复杂药物和天然产物分子骨架。反应机理涉及CO2通过连续光诱导的电子转移过程被还原为CO2•−,随后进攻非活化烯烃以及后续的氢原子转移等相关过程从而得到相应的产物。此策略的发展为二氧化碳在羧基化反应中的利用开辟了新的方向。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn