

图片来源:J. Am. Chem. Soc.
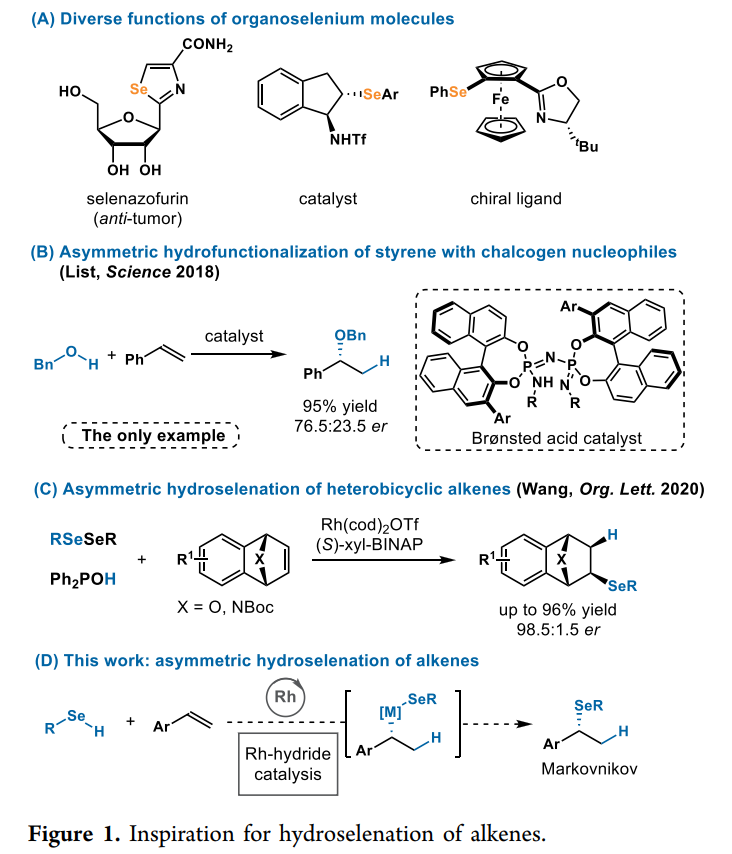
自1818年Berzelius发现硒以来,硒在药物、催化剂和材料等方面均有广泛的应用(Fig. 1A)。尽管硒是人类健康的基本元素,但与硫族元素氧和硫相比,对于硒的化学反应研究仍然很少。此外,虽然硫族亲核试剂加氢官能化反应是一种原子经济性高的策略,比如从容易获得的烯烃(例如二烯烃、简单烯烃和苯乙烯)构建各种结构单元,但对其研究并不广泛。2018年,通过使用有机催化,List课题组实现了醇不对称加成烯烃,然而,其仅报道了一个利用苯乙烯反应生成手性芳基醚的例子(Fig. 1B)。而加州大学尔湾分校Vy M. Dong课题组与北京理工大学杨小会课题组报道了首例使用 Rh-H催化实现硒醇与苯乙烯的对映选择性偶联。
在此之前,作者已经开发了1,3-二烯的氢硫醇化,其中Rh催化剂与硫醇发生氧化加成形成Rh-氢化物。与硫醇相比,硒醇的pKa较低(苯硒醇和苯硫酚的pKa 分别为5.9和6.6)和较弱的X−H键(分别为 67−74和78 kcal/mol)。众所周知,硒醇很容易添加到迈克尔受体中,包括 α,β-不饱和酮、乙烯基磺酰胺、硝基烯烃和N-乙烯基内酰胺。虽然之前烯烃也出现了双官能团化以形成硒化物,但并未考察对映选择性的情况。2020年,汪君课题组首次考察了杂双环烯烃的硒化反应,其反应主要通过Rh-催化下不对称结合二硒化物和氧化膦进行(Fig. 1C)。由此,本文作者提出了Rh催化剂对硒氢键进行氧化加成,产生具有硒化物配体的高反应性Rh-氢化物,随后将烯烃插入Rh-氢化物中,然后经过还原消除,从相对简单的烯烃转变为结构新颖的有机硒化物(Fig. 1D)。
图片来源:J. Am. Chem. Soc.
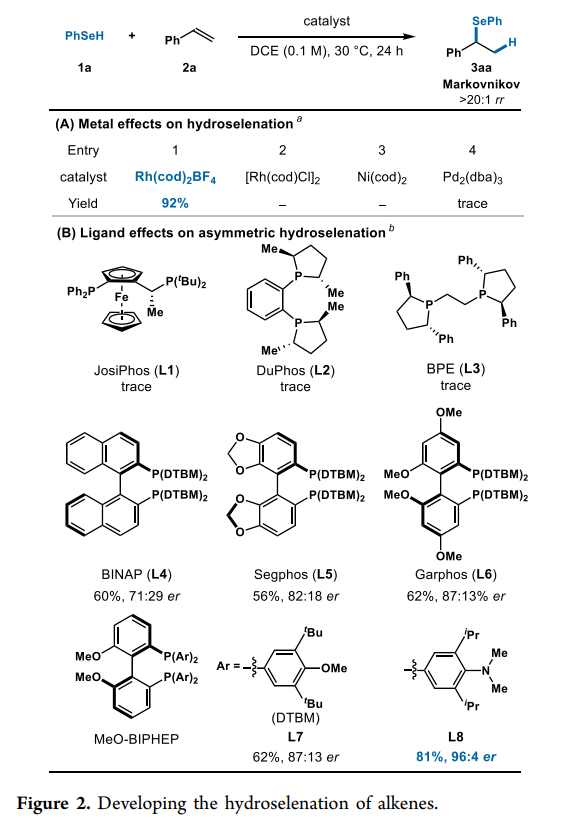
作者基于这种机制,着手确定一种有利于形成手性支链异构体(Markovnikov产物)的催化剂。为了开展研究,作者首先选择了苯硒醇(1a)和苯乙烯(2a)作为模型底物,在作者的氢硫醇化研究中,发现Rh中心相关的平衡离子的选择在区域选择性中发挥了重要作用。在此基础上,作者评估了中性[Rh(cod)Cl]2和阳离子 Rh(cod)2BF4(Fig. 2A)。作者发现Rh(cod)2BF4催化硒醇烯以92%的收率生成所需的Markovnikov异构体,且 rr >20:1(Entry 1)。相比之下,[Rh(cod)Cl]2催化的反应却未见产物(Entry 2)。作者还考察了其它金属催化剂,如Ni(cod)2和Pd2(dba)3,也没有显示出反应性(Entry 3,4)。作者最终选择使用Rh(cod)2BF4作为预催化剂,同时进一步研究了苯硒醇(1a)和苯乙烯(2a)与各种手性双齿膦配体的反应(Fig. 2B)。使用JosiPhos (L1)、DuPhos (L2)和BPE (L3)配体,其3aa产率均为痕量。而使用具有空间位阻庞大的阻转异构双膦配体L4-L7,以中等产率(56-62%)和对映选择性(71:29-87:13 er)生成支链硒化物产物。最终,作者发现带有富电子膦基的MeO-BIPHEP配体L8以81%的产率生成3aa,具有96:4 er和>20:1 rr。
图片来源:J. Am. Chem. Soc.
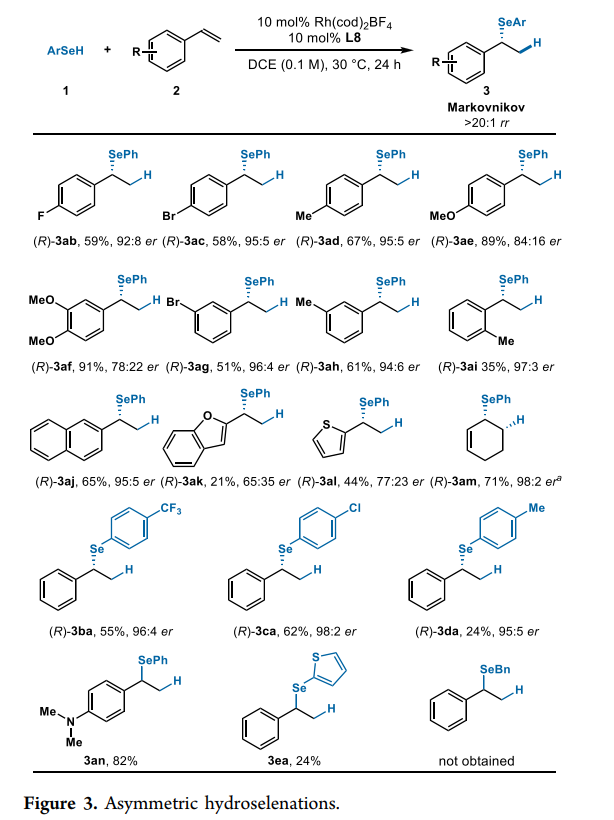
接下来,作者对底物的普适性进行了考察。研究发现烯烃取代基的电性对反应性和对映选择性有很大影响(Fig. 3)。与富电子烯烃(2d-2f)相比,具有缺电子取代的烯烃(2b, 2c, 2g)表现出更高的对映选择性但反应性较低。由于空间效应,硒醇与邻位取代的苯乙烯(2i)的偶联会使产率(35%)降低,但对映选择性良好(97:3 er)。杂环苯乙烯也可以进行该反应,但是产率和对映选择性均有下降((R)-3ak,(R)-3al)。此外,环己二烯的反应可以以高产率(71%)得到手性烯丙基硒化物((R)-3am),并具有良好的对映选择性(98:2 er)。3aa和3am的绝对构型是根据文献中报道的旋光度推定的。作者还研究了几种其它硒醇与苯乙烯2a的反应,结果为硒醇苯环上的取代基对对映选择性和区域选择性的影响可以忽略不计。在所有例子中,作者均观察到具有高对映选择性(95:5 er-98:2 er)的Markovnikov产物。不仅如此,与具有给电子基团的硒醇(1d)相比,苯环上具有吸电子基团的硒醇(1b, 1c)显示出更高的反应性。尽管苯胺取代的烯烃2n表现出较高的反应性,以82%的收率得到3an,但没有观察到催化剂的不对称诱导。同样,杂环硒醇也在手性条件下起作用,并以>20:1 rr 的24%产率得到外消旋产物3ea。而烷基硒醇在相同条件下没有表现出反应性。总的来说,突出显示的示例代表了苯乙烯的首次不对称氢化硒化。
图片来源:J. Am. Chem. Soc.
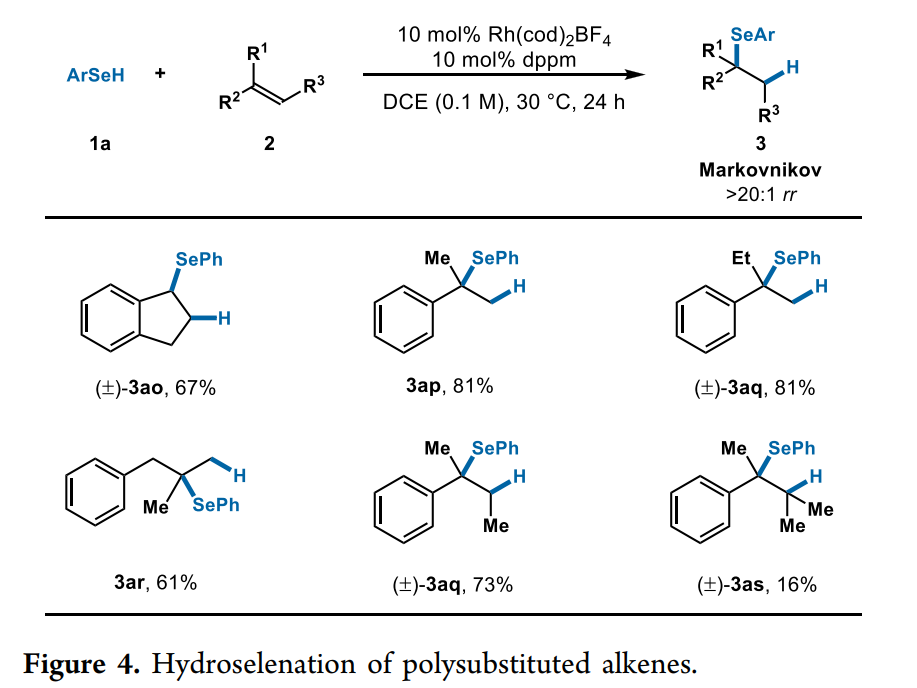
对于一些其它多取代烯烃,作者也进行了考察。如茚、α-甲基和乙基苯乙烯以及 2-甲基-3-苯基-1-丙烯,带有手性配体L1-L8的Rh催化剂没有显示出反应性, 然而,使用双二苯基膦甲烷配体,则具有一定的反应性(Fig. 4)。苯硒醇(1a)与茚(2o) 的偶联得到硒化物(3ao),产率为 67%。1,1-二取代烯烃的氢化硒化以中等至高产率(61-81%产率)和优异的区域选择性(>20:1 rr)得到相应的叔硒化物(3ap-3ar)。三取代和四取代烯烃以73%和16%的产率进行硒化反应生成相应的硒化物产物(3aq和3as)。用这种非手性配体观察到的反应性对于该反应未来的发展是也是令人鼓舞的。
图片来源:J. Am. Chem. Soc.
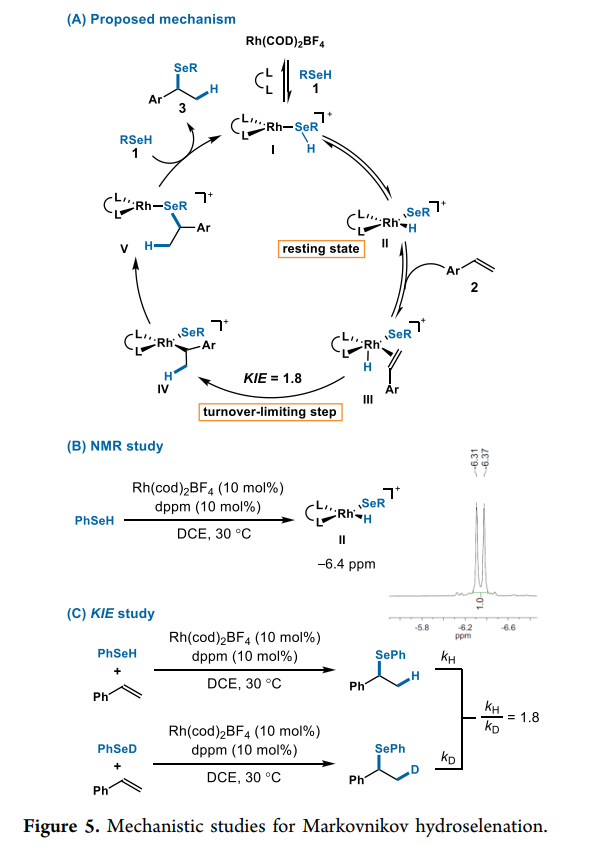
作者还提出了该反应可能的机理(Fig. 5A)。在作者之前关于氢硫醇化的研究中,其观察到Rh(I)催化剂可以对S-H键进行氧化加成以生成Rh-氢化物。在本研究中,作者观察到硒醇1与Rh-配合物I的氧化加成得到Rh-H II,NMR研究进一步证实了该催化循环。在室温条件下,混合的苯硒醇 (1a)、Rh(cod)2BF4 (10 mol %)和双二苯基膦甲烷(10 mol %)在DCE-d4中不到10分钟, NMR谱中出现-6.4 ppm(d, J = 34 Hz)(Fig. 5B),推测形成中间体II,作者假设中间体II的烯烃配位形成III,然后将烯烃迁移插入Rh-H键形成中间体IV。基于文献,因为过渡态的空间相互作用,Rh-H插入很可能决定了分支选择性。通过两个平行的初始速率研究,作者确定了一个初步KIE (kH/kD= 1.8,Fig. 5C),这与Rh-H插入是限速步骤的结论是一致的。由于观察到氢化物(II)的稳定状态,作者排除了氧化加成作为限速步骤的可能性。当使用氘代硒醇时,作者并没有观察到在苯乙烯中掺入氘,这进一步支持了烯烃迁移插入Rh-H是限速步骤。最后,作者推测中间体IV 经还原消除得到中间体V,然后分解产物3和再生Rh催化剂I, 完成循环。
总结 加州大学尔湾分校Vy M. Dong课题组与北京理工大学杨小会课题组提供了一种将烯烃转化为有机硒化合物的合成方法。通过使用Rh-催化,首次实现了苯乙烯与硒醇的对映选择性氢化。这项研究为未来使用硫族亲核试剂对烯烃进行功能化提供了指导。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn