

(图片来源:Angew. Chem. Int. Ed.)
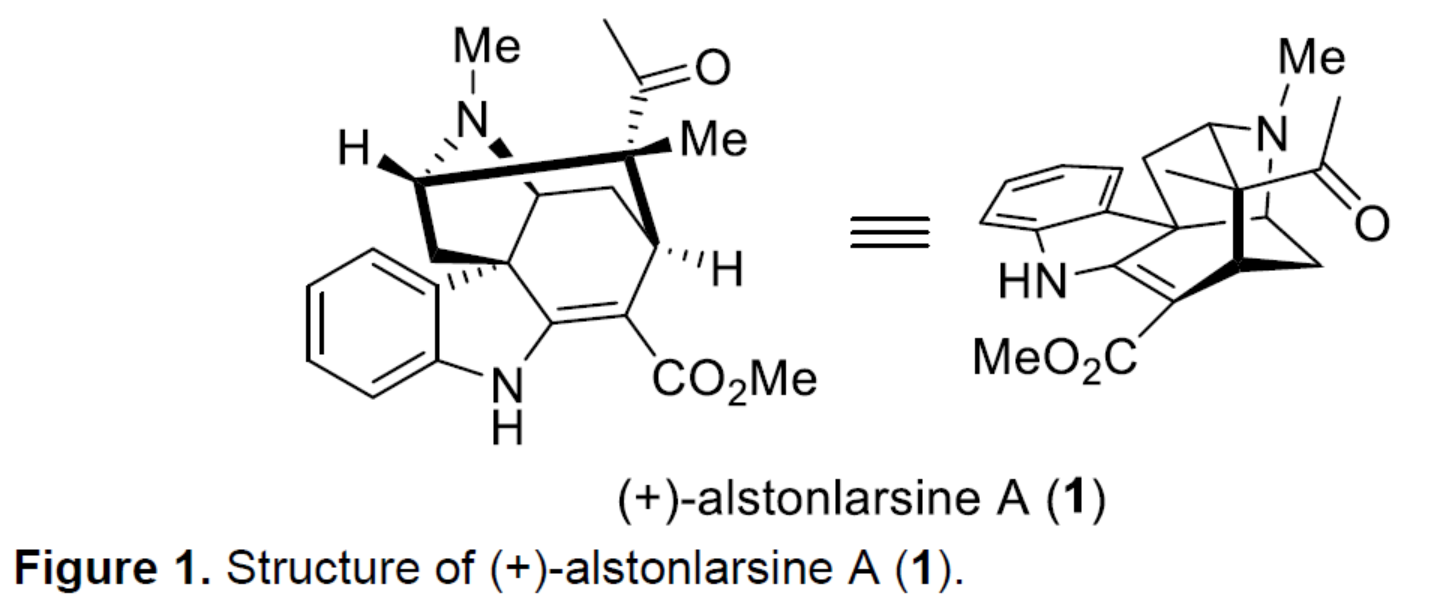
Drak2(DAP激酶相关的凋亡诱导蛋白激酶2)是一种参与调节不适当T细胞活化的信号分子。它的抑制作用可促进小鼠对自身免疫的抵抗力,同时不会削弱它们对病毒和细菌感染的免疫反应。由于Drak2在肿瘤发生中没有作用,它可能是一种选择性和有前途的药物靶点,可对抗自身免疫性疾病,且不会增加病毒/细菌感染或肿瘤发展的风险。然而,小分子Drak2抑制剂仍非常稀缺。2019年,化学家们从Alstonia Scholaris中分离出一种新型单萜吲哚生物碱alstonlarsine A(1),并在微摩尔范围内具有Drak2抑制活性(Figure 1)。其中,alstonlarsine A(1)具有9-氮杂三环[4.3.1.0]癸烷骨架以及五个手性中心(其中两个是季碳手性中心)。近日,贝尔格莱德大学Zorana Ferjancic与Filip Bihelovic团队报道了(+)-alstonlarsine A(1)的对映选择性全合成。
(图片来源:Angew. Chem. Int. Ed.)
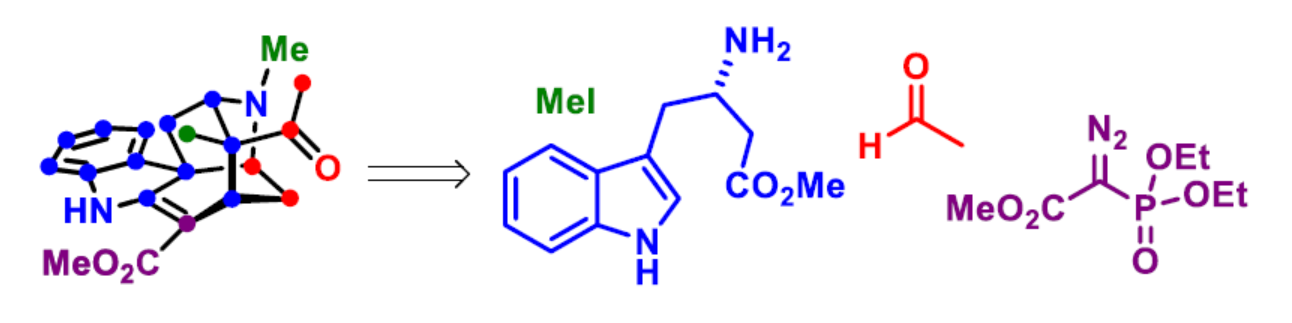
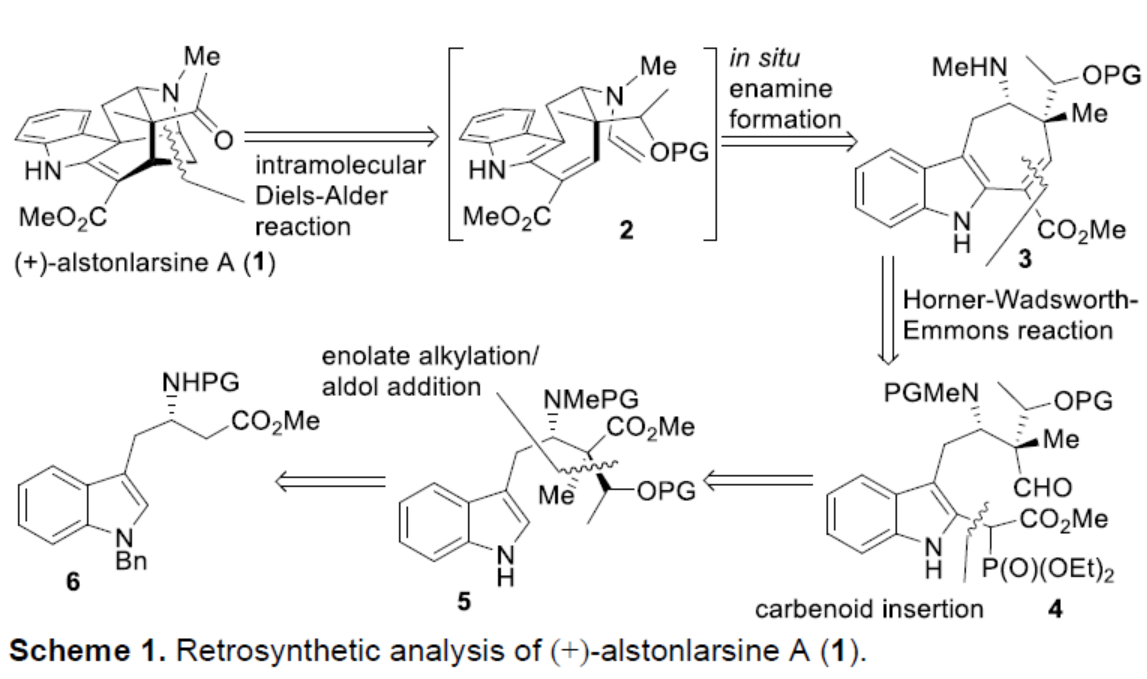
首先,作者对(+)-alstonlarsine A(1)进行了逆合成分析(Scheme 1)。(+)-alstonlarsine A(1)可通过烯胺衍生物2经分子内的Diels-Alder环加成反应生成。同时,三环仲胺3与乙醛的缩合可原位生成烯胺衍生物2,从而引发分子内反电子需求(inverse-electron-demand)的去芳构化Diels-Alder环加成反应。作者认为,通过多米诺串联反应可一步构建(+)-alstonlarsine A(1)中的两个新环、一个C-N键、两个C-C键和三个新的手性中心。三环仲胺3中的环庚烯单元,可通过吲哚衍生物5的C(2)-H键官能团化以及随后分子内 Horner-Wadsworth-Emmons(HWE)反应合成。具有季碳手性中心的吲哚衍生物5,可通过光学纯的β-高色氨酸(β-homotryptophan)衍生物6经非对映选择性烷基化/aldol加成反应获得。
(图片来源:Angew. Chem. Int. Ed.)
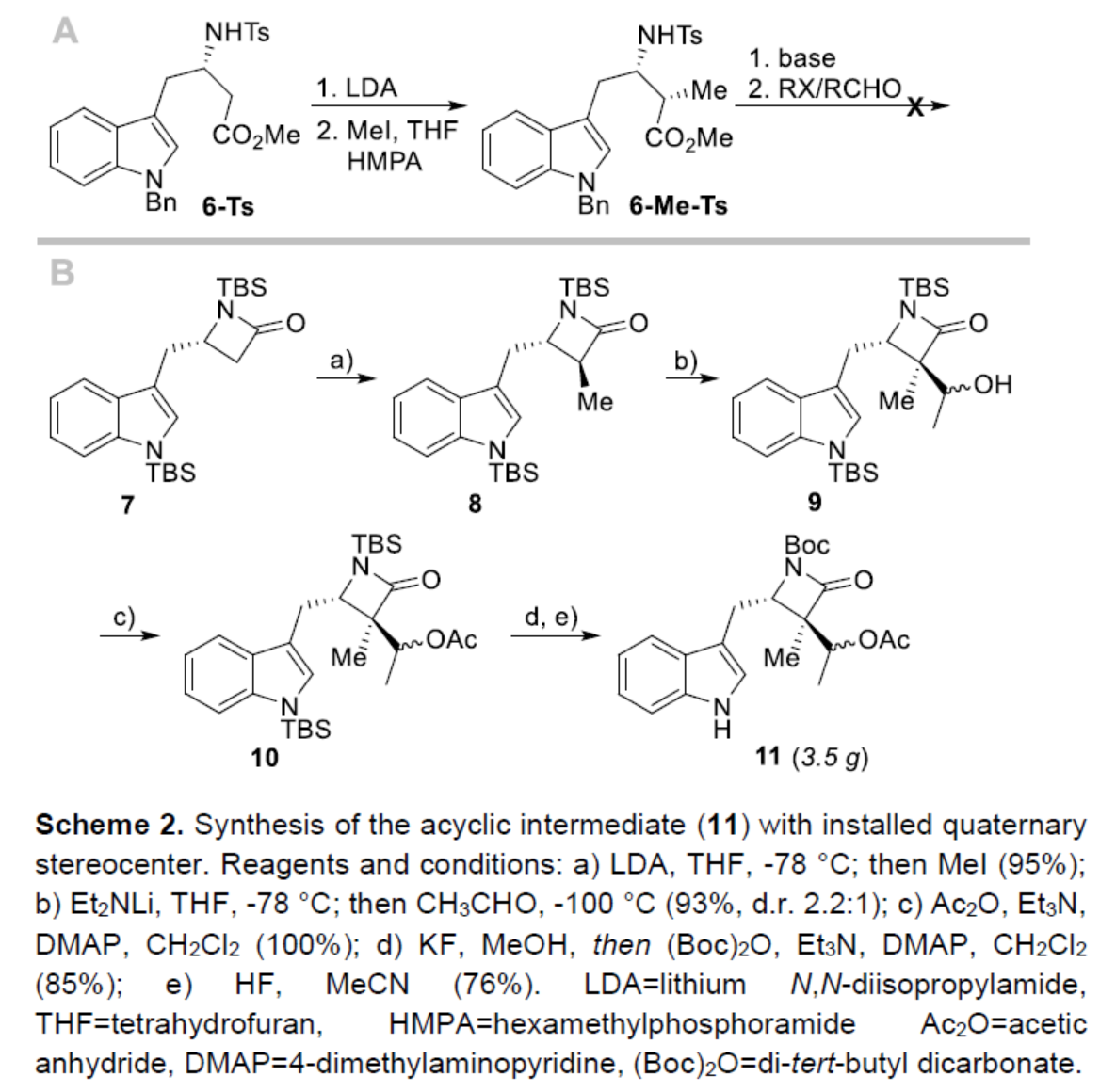
根据β-氨基酸衍生物进行非对映选择性α-烷基化的相关研究,作者认为N-Tosyl-β-高色氨酸甲酯(6-Ts)是α-烷基化/aldol加成串联过程的有效底物。虽然,6-Ts可在苟刻条件下(LDA、HMPA、MeI)顺利进行α-甲基化反应,但随后6-Me-Ts与乙醛进行aldol反应时,反应失败(Scheme 2, part A)。经过大量的研究后发现,此类反应需使用一些不易进行β-消除且空间要求较低的底物,如高色氨酸β-内酰胺衍生物7(Scheme 2, part B)。底物7可在较温和的条件下顺利进行甲基化反应,以几乎定量的收率获得甲基化中间体8。中间体8可与乙醛进行aldol反应,生成具有季碳手性中心的中间体9,且具有出色的非对映选择性。随后,中间体9中的羟基保护以及N-保护基的交换后,可获得克级中间体11。
(图片来源:Angew. Chem. Int. Ed.)
接下来,作者开始对吲哚环的官能团化反应进行了研究(Scheme 3)。作者认为,在吲哚衍生物C-2位引入膦酰基乙酸酯(phosphonoacetate)单元,再通过分子内Horner-Wadsworth-Emmons反应,可实现七元环的构建。鉴于从重氮丙二酸二甲酯衍生的铜-卡宾类化合物形式插入C-H键的相关报道,作者认为重氮膦酰基乙酸酯应可进行相似的转化。研究表明,Cu(acac)2催化3-取代吲哚12与重氮膦酰基乙酸酯13反应时,可获得预期的C-2官能团化化合物14。同时,作者发现,(1)游离吲哚氮底物比N-烷基化底物反应更快,并以良好的收率形成相应的产物(14a、14d、14f、14g);(2)缺电子的N-Boc吲哚衍生物未发生反应;(3)吲哚环的C-3位含有空间位阻较大的取代基,可防止C(2)-H键的插入,仅获得N-H键插入的化合物15c。此外,在对分子内Horner-Wadsworth-Emmons反应研究后发现,在LiBr/Et3N条件下,14d-14g衍生的醛,均可顺利进行环化反应,从而有效地构建了六-八环中间体16d-16g。值得注意的是,该策略是首次将HWE反应用于环庚烯并[b]吲哚骨架的构建。
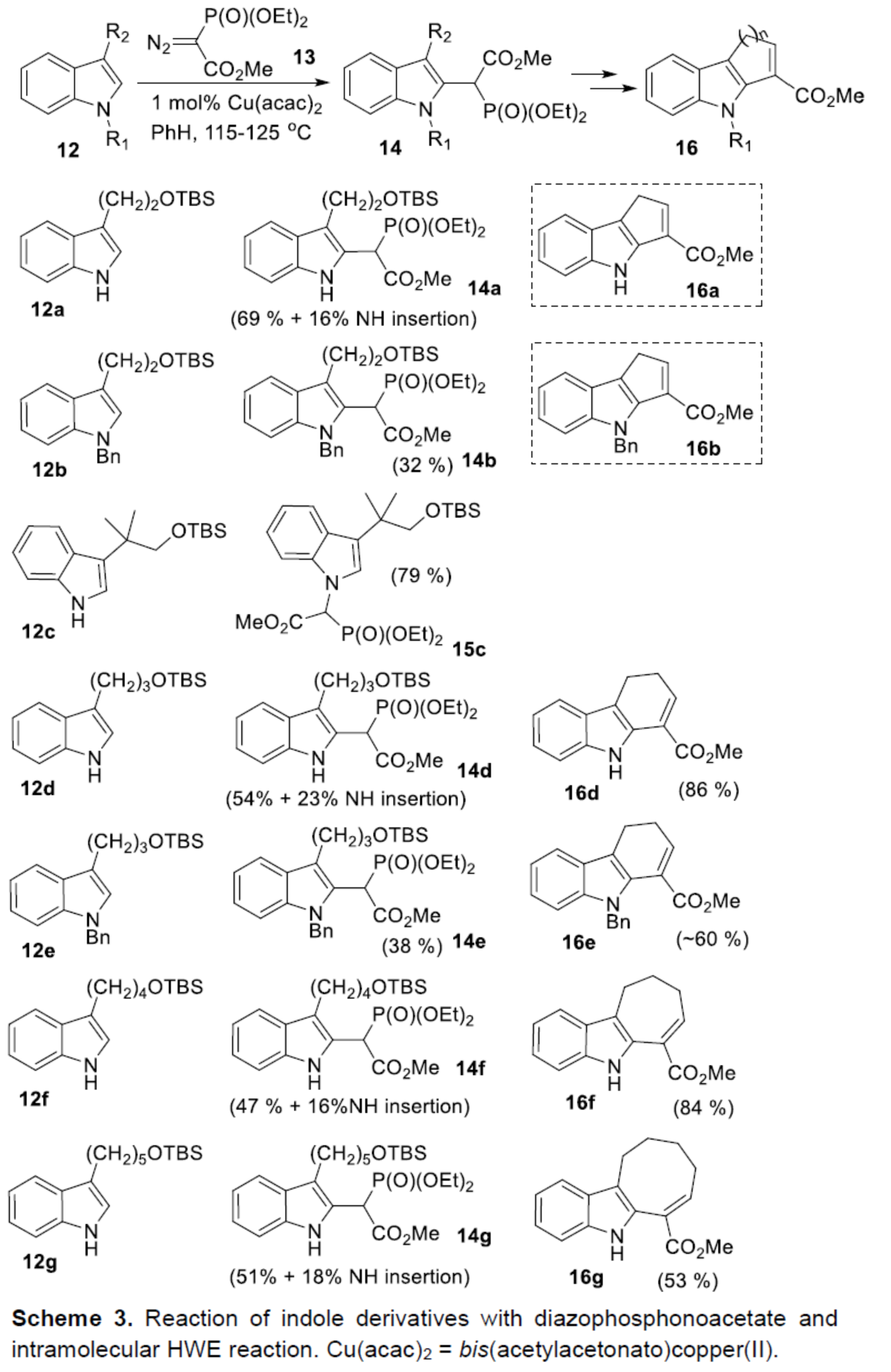
(图片来源:Angew. Chem. Int. Ed.)
因此,吲哚衍生物11在铜-卡宾插入条件下,可区域选择性获得膦酸酯中间体17(4.5 g,83%的收率)。中间体17中的β-内酰胺单元经还原断裂可生成一级醇中间体18,经IBX氧化,可获得醛中间体19。中间体19经分子内 Horner-Wadsworth-Emmons反应,可获得关键的三环中间体20(大于2 g)。中间体20中经吲哚单元N-H键的保护以及N-甲基化后,可获得中间体21。
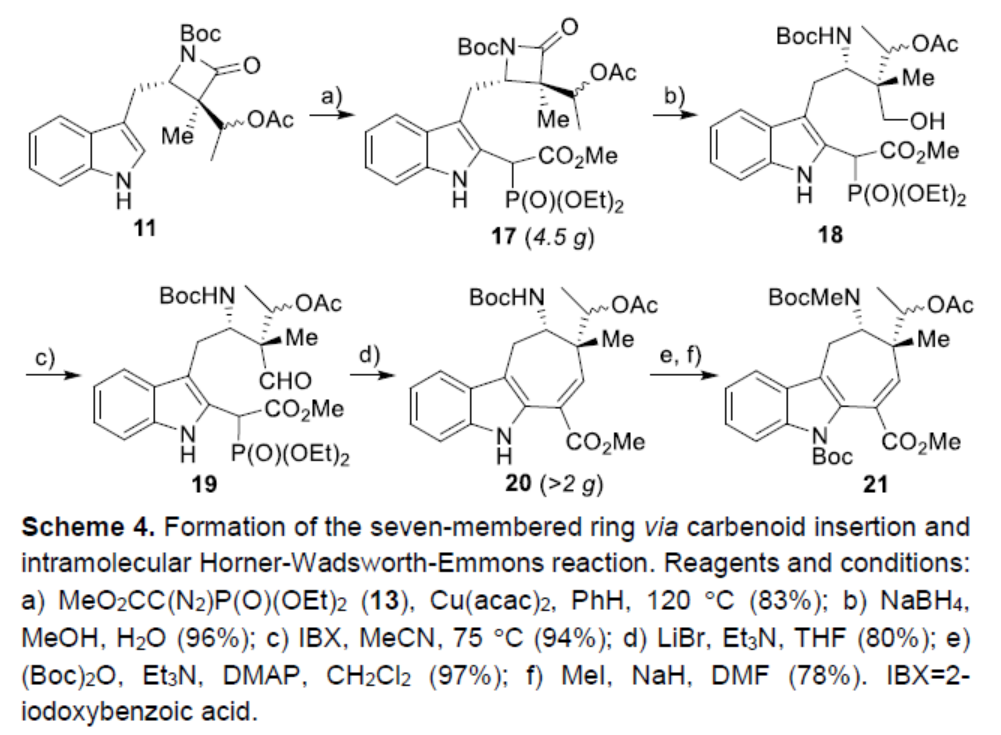
(图片来源:Angew. Chem. Int. Ed.)
在酸性条件下,中间体21中的两个Boc基团脱保护后,可获得胺中间体22,从而为关键的多米诺串联反应奠定了基础(Scheme 5)。中间体22与乙醛反应,可原位生成烯胺中间体23。中间体23可顺利进行(形式)分子内去芳构化Diels-Alder环加成,获得五环中间体24。值得注意的是,通过该多米诺串联反应,可在一步过程中实现一个C-N键、两个C-C键、三个手性中心以及五环骨架的两个环的构建。最后,通过大量条件的优化后发现,中间体24使用LiAlH4还原时,在NaH存在下,可选择性去除乙酸酯基团,获得一级醇中间体25。中间体25在Corey-Kim条件下进行氧化,从而完成了(+)-alstonlarsine A(1)的不对称全合成。合成产物(160 mg)的所有谱图数据与分离的(+)-alstonlarsine A(1)的谱图数据一致。
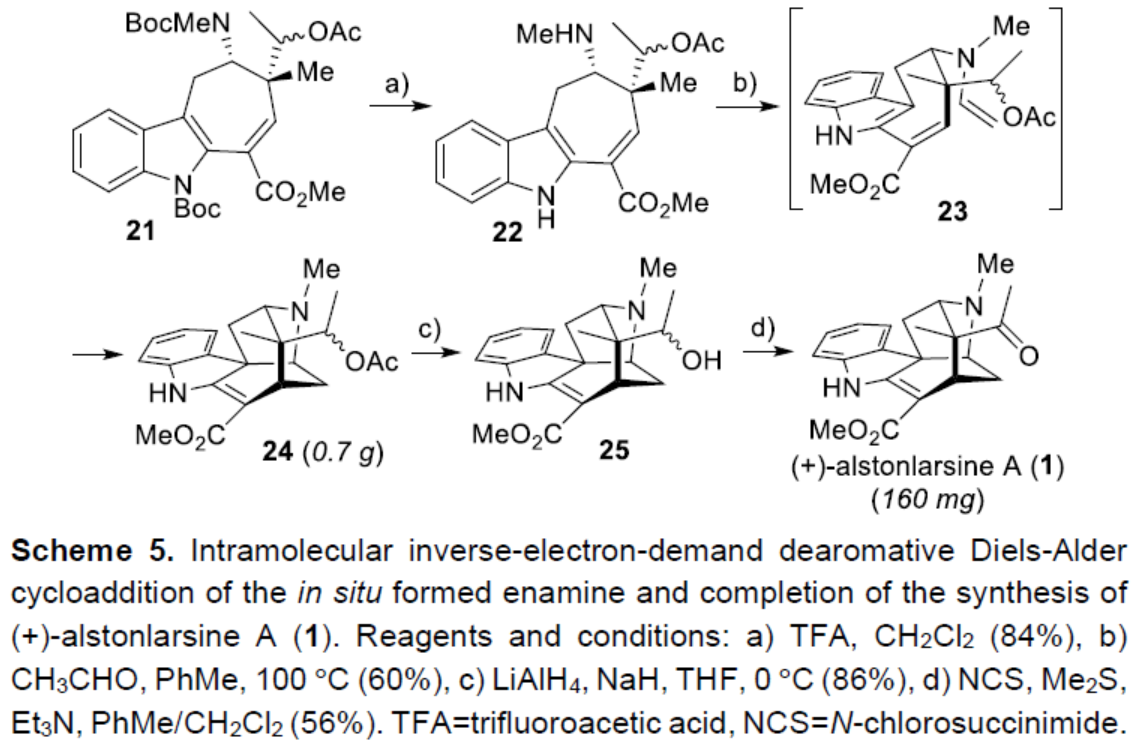
(图片来源:Angew. Chem. Int. Ed.)
总结:
贝尔格莱德大学Zorana Ferjancic与Filip Bihelovic团队报道了(+)-alstonlarsine A(1)的对映选择性全合成,涉及关键的多米诺串联过程(原位形成烯胺/Diels-Alder反应),可在一步过程中实现一个C-N键、两个C-C键、三个手性中心以及五环骨架的两个环的构建。此外,通过将吲哚衍生物C(2)-H键的官能团化与分子内Horner-Wadsworth-Emmons反应相结合,从而实现了环庚烯并[b]吲哚骨架的构建,并可用于其它吲哚并六-八元环的稠合三环骨架的构建。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn