

正文
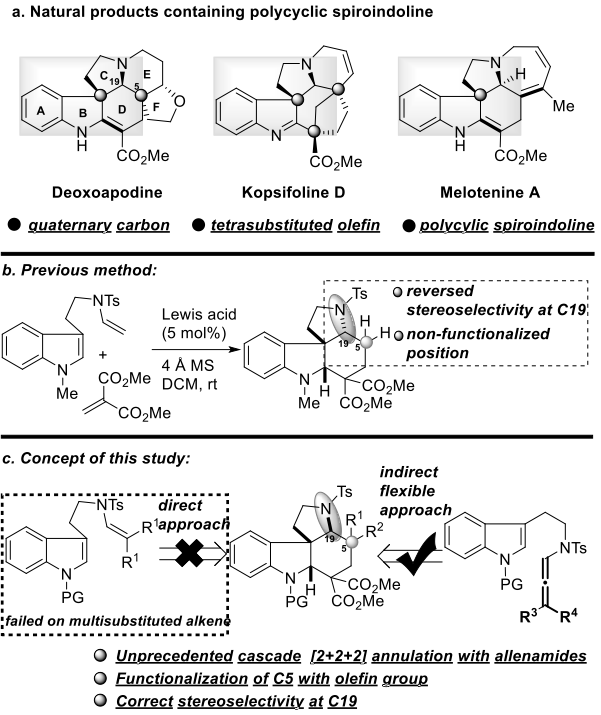
图1. 多环螺吲哚啉的构建(图片来源:Angew. Chem. Int. Ed.)
多环吲哚骨架广泛存在于具有重要生物活性的天然产物中,在过去的几十年中引起了科学界的极大关注。在天然产物中,共有250多种天然生物碱具有共同的五环aspidosperma母核。如deoxoapodine、kopsifoline D和melotenine A,含有多个季碳中心和四取代烯烃片段,由于其独特的多环骨架结构的合成挑战以及潜在的成药性,引起了合成化学家和药物化学家的极大兴趣(图1a)。2016年,唐勇院士团队开发了色胺衍生的乙烯基磺酰胺与亚甲基丙二酸酯的串联环化反应,可快速构建四环螺二氢吲哚骨架(图1b)。虽然环化具有易于放大、高选择性和高收率等优点,但仅限于应用于上述天然产物的全合成:1)C19的立体构型与天然产物C19的立体构型不一致;2) C5位点没有取代基,这通常需要高度官能团化才能进一步用于合成。为了解决这些问题,作者尝试了直接增加烯烃底物取代基的试验,但没有成功,这可能是由于空间位阻烯烃中结构刚性的增加使得分子内关环变得非常困难。在本文中,作者开发了一种新的有效方法,通过基于联烯酰胺的串联环化构建此类天然产物的核心骨架,从而实现了三种重要天然产物(-)-deoxoapodine、(-)-kopsifoline D和(±)-melotenine A的发散全合成(图1c)。
长期以来,联烯酰胺一直是有机合成中功能强大且用途广泛的合成砌块,作者设想将联烯酰胺片段引入色胺衍生物中,利用联烯酰胺结构单元较小的空间位阻和丰富的官能团来解决上述问题。与假设一致,当色胺衍生的联烯酰胺(1a)与亚甲基丙二酸二甲酯(2a)反应时,在四氢呋喃中使用Cu(OTf)2作为催化剂,最初以38%的收率得到所需的[2+2+2]环化产物,同时伴随着22%的副产物4a。最后发现In(OTf)3为最佳催化剂,反应1小时后,以87%的分离收率和>99:1 dr非常快地提供[2+2+2]环化产物,同时具有>99:1 Z/E选择性。3a和3a'的相对构型由单晶X-射线衍射实验确定(图2)。
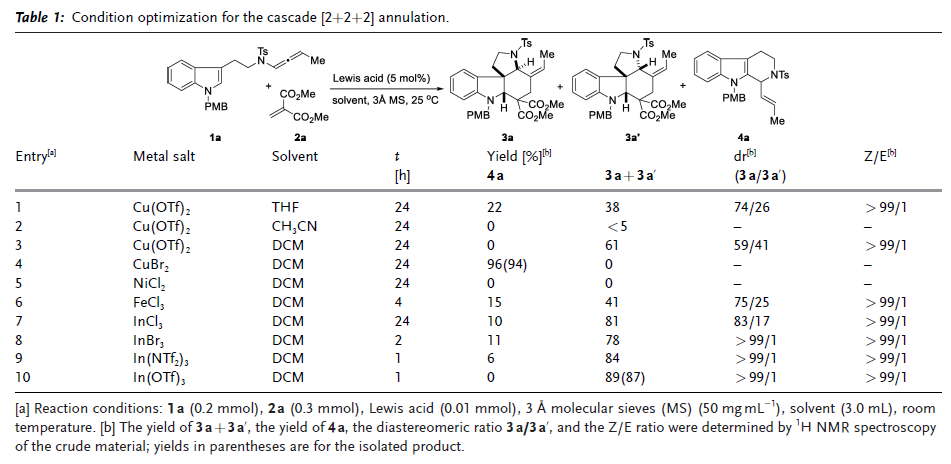
图2. 反应条件优化(图片来源:Angew. Chem. Int. Ed.)
有了最佳反应条件,作者考察了该方法对多种吲哚衍生物的通用性和实用性(图3)。2a与一系列带有卤素取代基的吲哚联烯酰胺(如吲哚不同位置的氟、氯和溴)反应顺利进行,得到相应的产物3b-3l,收率71-90%,立体选择性优异(>99:1dr和>99:1 Z/E)。5-位和7-位上的给电子取代基(如甲基和甲氧基)也是可以兼容的,相应产物3m-3p的产率为76-87%,具有>99:1 dr和>99:1 Z/E选择性。用N-Bn基团代替N-PMB基团,反应的产率和立体选择性均保持。接下来,作者考察了联烯酰胺的范围。多种官能团如烷基、芳基、碳环和杂环基团具有良好的耐受性。用H原子改变联烯酰胺的Me取代基,反应进行得比Me-联烯酰胺底物稍慢,5 h后以82%的收率得到所需产物3r,且不影响反应的非对映选择性。联烯酰胺上带有单取代基如环丙基和苯基的底物,分别以90%的收率和61%的收率顺利得到所需的产物3s和3t,并具有出色的立体选择性(>99:1 dr 和>99:1 Z/E)。二取代的联烯酰胺,如二甲基和环戊烷基底物,均能以>99:1 dr的良好收率有效地提供所需的产物3u和3v。增加环尺寸,以及在对位安装杂原子,以67-79%的收率得到产物3w-3y,并具有出色的非对映选择性(>99:1 dr)。此外,产物3a (12.9 g)、3q (5.2 g)和3r (5.1 g)的放大实验进一步证明了其合成效用。
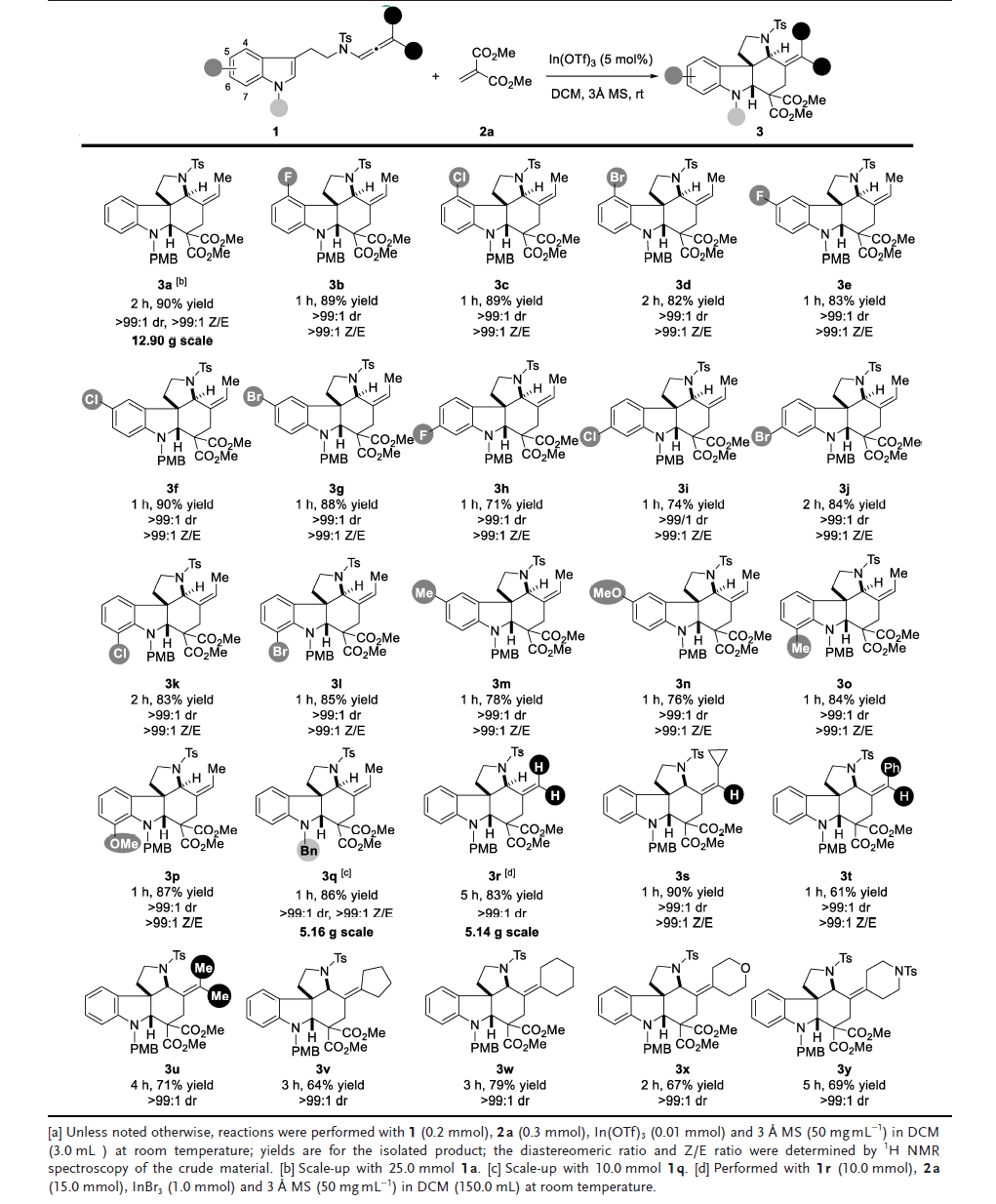
图3. 底物范围(图片来源:Angew. Chem. Int. Ed.)
借助该实用性方法,作者接着探索了deoxoapodine和kopsifoline D的全合成(图4)。由市售色胺衍生两步(92%产率)的化合物5很容易以94%的产率转化为具有OTBS官能团的相应炔丙基磺酰胺7。接下来,通过一锅法原位生成联烯酰胺、然后进行串联[2+2+2]环化序列,以72%的收率(8.2 g)提供具有优异立体选择性的四环二氢吲哚3z。然后用LiCl/DMSO将其中一个酯基团脱羧,再将羟基脱保护,两步得到8,产率为90%。8用DDQ氧化形成Claisen重排的前体9。以原乙酸三甲酯为溶剂,对苯二酚为催化剂,在200 oC下进行Claisen重排反应生成产物10,产率88%,为单一非对映异构体,高效实现了关键的季碳中心的构建。然后脱除N-Ts基团,再对得到的11进行N-烯丙基化,随后在Hoveyda-Grubbs II催化剂存在下进行关环复分解(RCM)反应得到deoxoapodine和kopsifoline D (12)的关键骨架,产率为81%,并可克级(1.4 g)规模制备。通过制备型高效液相色谱法(HPLC)对12进行对映体拆分,分别得到(-)-12和(+)-12,DIBAL-H选择性还原酯基得到中间体(-)-13和(+)-13。最后,从市售色胺出发,总共经14步完成了(-)-deoxoapodine的全合成,总产率为10.3%。而天然产物的对映异构体[(+)-deoxoapodine]也是经14步完成全合成,总产率为10.6%,两者均通过金(I)催化烯烃与醇的加成关上了四氢呋喃环。同时,从市售色胺出发,经14步也实现了(-)-kopsifoline D的全合成,总产率为6.6%,其对映异构体也是经14步完成,总产率为5.7%,最后一步都是在KOtBu 和TsCl存在下通过亲核取代构建了七元环。
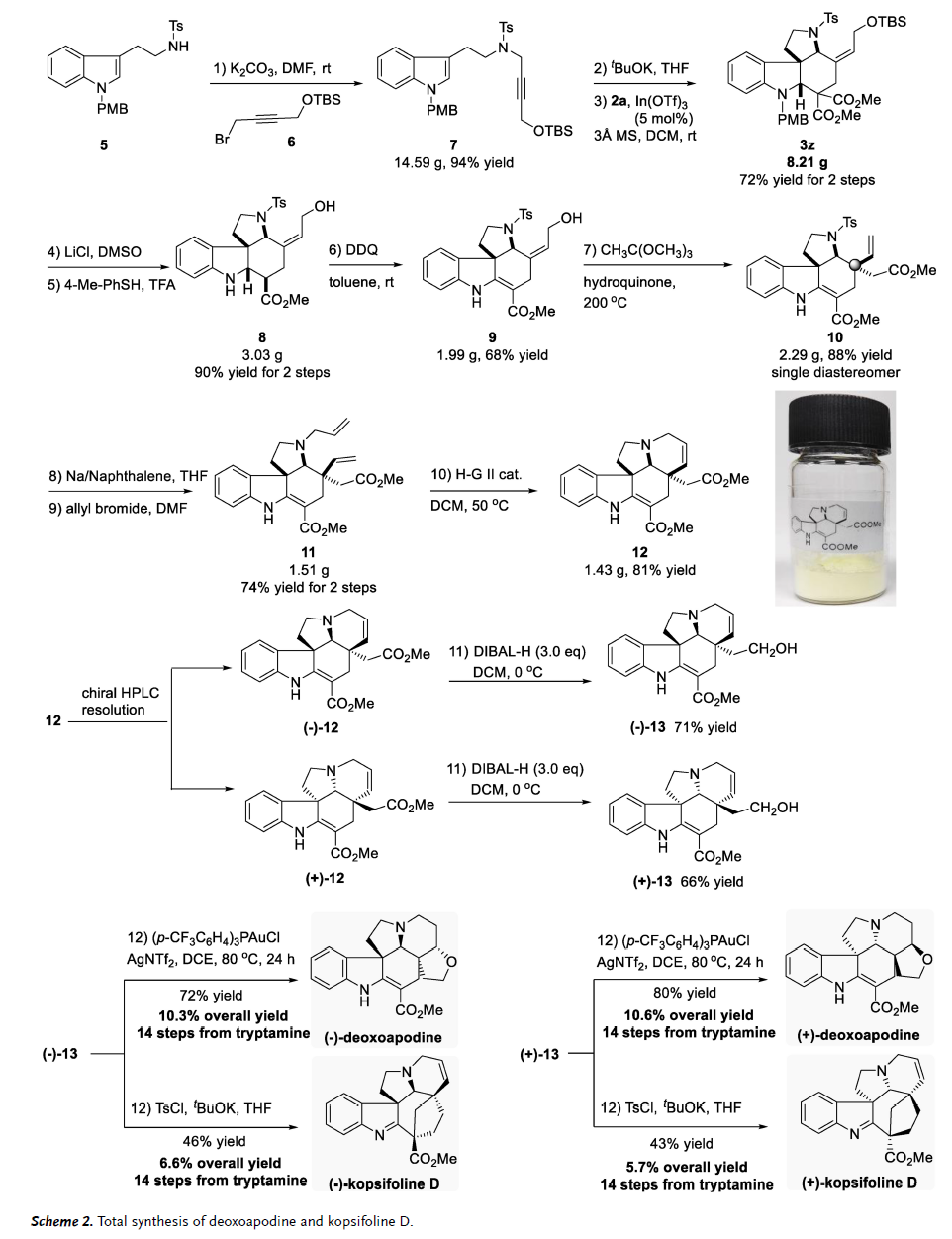
图4. deoxoapodine和kopsifoline D的全合成(图片来源:Angew. Chem. Int. Ed.)
Melotenine A是从Melodinus tenuicaudatus中分离得到的吲哚类生物碱。其抑制人类癌细胞系的有效生物活性以及极具挑战性的6/5/5/6/7五环系统的独特骨架,吸引了作者将串联[2+2+2]环化反应应用于该分子的全合成(图5)。首先,作者设计了一种新的底物,二取代联烯酰胺1aa,在In(NTf2)3存在下,以85%的收率(7.8 g)提供了相应的[2+2+2]环化产物3aa,具有> 99:1 dr 和2.3:1 Z/E选择性。Z/E选择性的显著降低可能归因于在亚甲基丙二酸酯共轭加成过程中两个联烯酰胺取代基的区分能力差。目前的方法为在高度拥挤的多环体系中构建四取代烯烃提供了一种有效的方法,通过脱羧将3aa转化为15,然后通过 Pd/C加氢去除PMB基团,并用DDQ氧化构建C-C双键,以2步58%的收率得到16。通过用TBAF除去TBDPS基团得到18,其单晶实验证实了16的结构。在一锅法中,16用Na/Naphthalene体系处理以去除Ts基团,然后不需纯化进行N-烯丙基化,再原位添加TBAF得到化合物17。17经Appel反应得到相应的高烯丙基溴化物,在碱性条件下消除,顺利得到RCM前体。在没有纯化的情况下,在Hoveyda-Grubbs II催化剂的存在下获得了独特的二氢氮杂环,最终通过12步完成了(±)-melotenine A的全合成,从市售色胺出发总产率为7.3%。
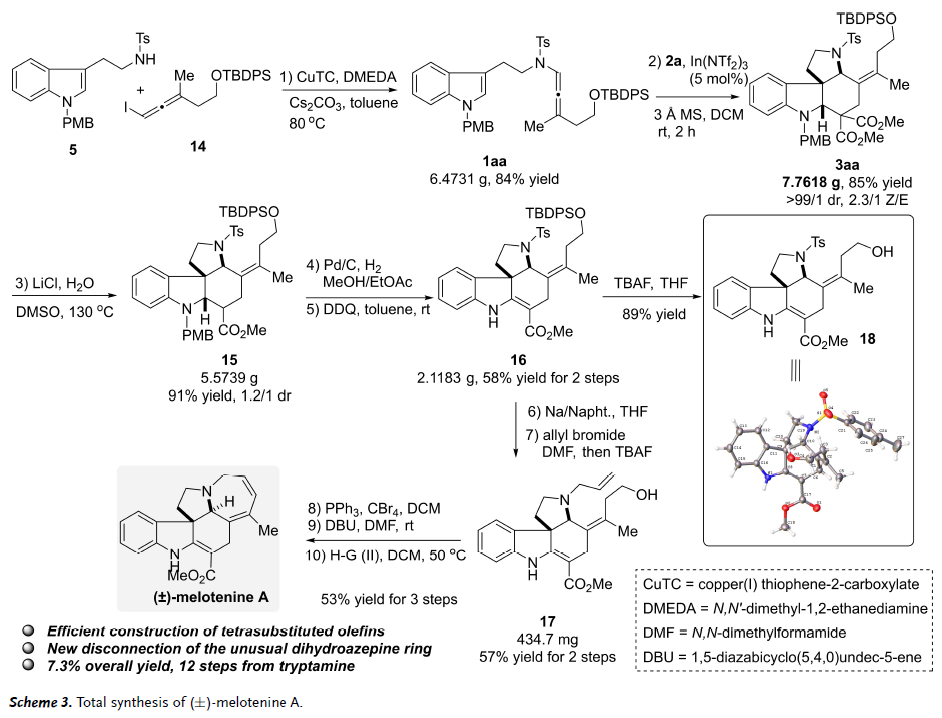
图5. (±)-melotenine A的全合成(图片来源:Angew. Chem. Int. Ed.)
总结
唐勇院士团队开发了一种简洁高效的方法来构建具有3个连续手性中心的六氢咔唑骨架。在铟(III)催化剂存在下,色胺衍生的联烯酰胺与亚甲基丙二酸二甲酯的串联[2+2+2]环化反应在温和条件下顺利进行,以良好至优异的产率提供了各种带有螺季碳手性中心的四环二氢吲哚(27个实例)(61-90%),具有出色的立体选择性 (>99:1 dr, >99:1 Z/E)。该反应提供了一种有效的一步合成具有功能化C5位点的四环aspidosperma母核,并可进行各种合成转化,还可以以克级规模进行,这使得从色胺出发,12-14步内就能实现(-)-deoxoapodine、(+)-deoxoapodine、(-)-kopsifoline D、(+)-kopsifoline D和(±)-melotenine A的发散全合成。
文献详情:

声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn