

近些年发现的CRISPR/Cas12a分子检测技术与RPA扩增表现出了良好的互补性:RPA扩增可显著提高CRISPR/Cas12a的检测灵敏度,CRISPR/Cas12a技术能够消除RPA非特异性扩增产生的假阳性信号[1]。但是,RPA扩增和CRISPR/Cas12a反应的简单混合通常会导致灵敏度的急剧下降或检测时间的延长,其主要原因是模板DNA和扩增子激活Cas12a酶的切割活性后,会被顺式切割导致模板失效;与此同时激活后的Cas12a核酸酶还会反式切割单链引物,造成RPA扩增效率急剧下降[2]。为避免扩增子转移造成的气溶胶污染,目前大多数的RPA扩增和CRISPR技术结合的研究都是在密封体系内将RPA扩增和CRISPR检测物理分隔。如:王永明将CRISPR体系加至PCR管盖上,扩增完成后经过离心步骤混合进行后续的CRISPR反应[3];刘长春团队利用蔗糖的浓度梯度分隔RPA扩增和CRISPR反应[4]。这些方法虽然实现了“闭管”检测,但对操作要求较高,与即时诊断(Point of Care Test, POCT)策略相背。因此,开发出易于推广的、可实现自动化的RPA-CRISPR“闭管”检测新方法对于RPA恒温扩增技术的商业化应用具有重要的意义。
2022年6月28日,深圳大学化学与环境工程学院刘翼振副教授在Analytical Chemistry上发表了题为“Photoactivatable CRISPR/Cas12a strategy for One-pot DETECTR Molecular Diagnosis”的研究。该研究利用光控技术精确控制CRISPR/Cas12a反应的开启,避免了RPA扩增初期Cas12a核酸酶对模板、扩增子以及引物的消耗,解决了RPA-CRISPR反应简单混合导致的灵敏度急剧下降和检测时间延长等问题,实现了“闭管”的、无需扩增子转移的、高灵敏的分子诊断。

在基因编辑领域,“光激活”作为一种无创、快速、高分辨率的生化反应开关常常被用于Cas9技术在体内基因编辑的控制器[5,6]。受此启发,作者提出光控的RPA-CRISPR/Cas12a分子检测新技术:设计能够与crRNA完全互补的、中间穿插有光解基团的PC-DNA,二者杂交后能够阻止crRNA形成“发卡”结构与Cas12a核酸酶结合,从而阻断CRISPR/Cas12a反应(图1a)。所以,在检测的前15 min,RPA扩增可以在无干扰的情况下迅速生成大量扩增子。然后使用365 nm紫外光照射3 min使光解基团PC-DNA断裂并从crRNA上解离,释放出的crRNA与Cas12a结合并被扩增子激活。因此,在检测的后20 min,CRISPR/Cas开启反式切割迅速切断荧光报告链产生荧光信号(图1b)。
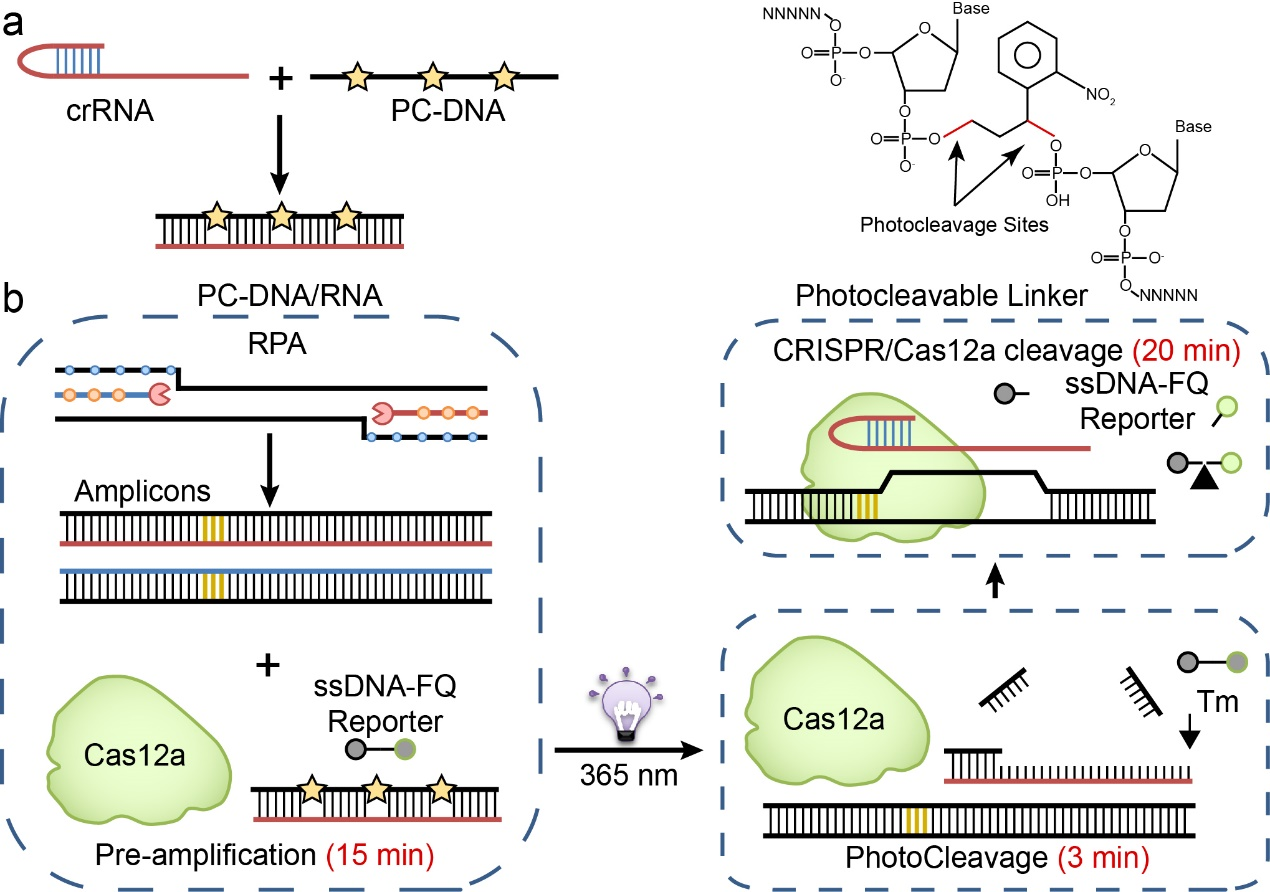
图1 光控的RPA-CRISPR/Cas“闭管”检测(图源:Chen Y, et al., Anal Chem, 2022)
基于此,作者设计了W-PC-DNA、F-PC-DNA和R-PC-DNA三种PC-DNA分别与crRNA的全长序列、发卡序列和识别序列互补,用以测试其保护效果。结果表明只有完全封闭crRNA的全长序列时,检测体系才能够达到预期的效果,并且PC-DNA的最优加入量为crRNA的2倍(图2a)。为了缩短整体检测时间,作者进一步证实了在低浓度模板(25 copies)下,RPA预扩增和光激活CRISPR所需的最短时间分别为15 min和3 min,因此整个的检测过程为38 min(图2b)。
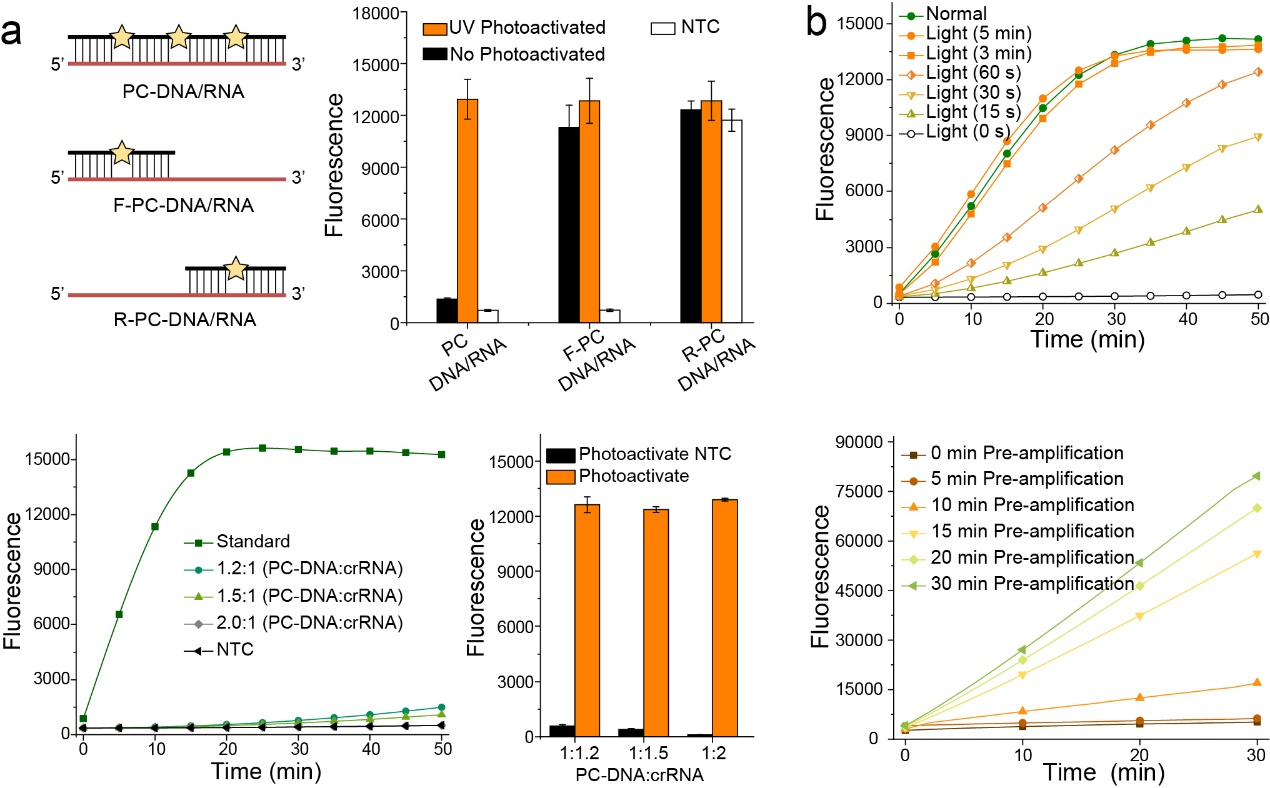
图2 光控的RPA-CRISPR/Cas检测条件优化(图源:Chen Y, et al., Anal Chem, 2022)
最后,作者利用这一技术实现了对非洲猪瘟(African Swine Fever Virus, ASFV)的快速检测。进一步的,作者以猪圆环病毒2型(Porcinecircovirus Type 2, PCV2)、猪伪狂犬病毒(Pseudorabies Virus, PRV)作为对比验证了其特异性,并且证实了该检测体系的检测灵敏度达到了2.5 copies/reaction(图3a)。与常规的先RPA扩增后CRISPR/Cas加入的分步式检测方法相比,光控的RPA-CRISPR“闭管”检测方法在灵敏度一致的前提下,极大地简化了操作流程(图3b)。

图3 光控的RPA-CRISPR/Cas检测与分步检测对比(图源:Chen Y, et al., Anal Chem, 2022)
综上所述,本研究建立了一种光激活、“闭管”的RPA-CRISPR/Cas分子诊断新方法,并将其用于非洲猪瘟病毒的快速检测。该研究利用互补的、含有光解基团的PC-DNA与crRNA杂交从而阻断CRISPR/Cas12a反应,然后扩增完成后通过365 nm紫外光照释放crRNA恢复CRISPR/Cas12a的活性进行核酸检测。该方法在“闭管”系统中实现了RPA扩增-光激活CRISPR/Cas12a检测的精确控制,解决了传统RPA-Cas12a集成检测中由于竞争反应导致灵敏度降低和检测时间延迟的问题。整个检测时间仅为40 min,检测灵敏度为2.5 copies。与目前的分离RPA-CRISPR/Cas检测相比,该方法操作简单、控制精准、避免了扩增子转移带来的气溶胶污染问题。这种光激活的RPA-CRISPR/Cas12a“闭管”检测方法在POCT核酸检测中将发挥重要作用,具有较高的应用价值。
深圳大学化学与环境工程学院副研究员陈勇为研究论文的第一作者,刘翼振副教授为通讯作者。该研究获得了国家自然科学基金委员会、广东省自然科学基金、深圳市科技创新委员会、深圳大学的大力支持。
通讯作者课题组简介:
刘翼振团队成员长期从事DNA等温信号放大技术、DNA级联电路、核酸等温扩增及CRISPR分子诊断技术的研究工作。研究内容主要围绕生物传感技术与分子诊断技术,结合分析化学、分子生物学及生物医学工程开展新型分子诊断技术的交叉研究。近五年在ACS Nano、Advanced Science、Chemical Science、Analytical Chemistry、Journal of Materials Chemistry A、Chemical Communications、Topics in Current Chemistry、Analytica Chimica Acta、Talanta 等期刊发表多篇研究论文。长期担任ACS Nano、Advanced Materials、Advanced Functional Materials、Chemical Communications和Nanoscale 等期刊的审稿人。团队隶属于深圳市纳米生物传感技术重点实验室、深圳大学纳米传感与分子诊疗研究中心。
原文链接:https://doi.org/10.1021/acs.analchem.2c01193
1. Chen, Y.; Mei, Y. X.; Zhao, X. H.; Jiang, X. Y., Reagents-Loaded, Automated Assay that Integrates Recombinase-Aided Amplification and Cas12a Nucleic Acid Detection for a Point-of-Care Test. Anal. Chem. 2020, 92, 14846-14852.
2. Chen, Y.; Zong, N.; Ye, F. D.; Mei, Y. X.; Qu, J. X.; Jiang, X. Y., Dual-CRISPR/Cas12a-Assisted RT-RAA for Ultrasensitive SARS-CoV-2 Detection on Automated Centrifugal Microfluidics. Anal. Chem. 2022, 94, 9603-9606.
3. Wang, B.; Wang, R.; Wang, D. Q.; Wu, J.; Li, J. X.; Wang, J.; Liu, H. H.; Wang, Y. M., Cas12aVDet: A CRISPR/Cas12a-Based Platform for Rapid and Visual Nucleic Acid Detection. Anal. Chem. 2019, 91, 12156-12161.
4. Yin, K.; Ding, X.; Li, Z. Y.; Zhao, H.; Cooper, K.; Liu, C. C., Dynamic Aqueous Multiphase Reaction System for One-Pot CRISPR-Cas12a-Based Ultrasensitive and Quantitative Molecular Diagnosis. Anal. Chem. 2020, 92, 8561-8568.
5. Jain, P. K.; Ramanan, V.; Schepers, A. G.; Dalvie, N. S.; Panda, A.; Fleming, H. E.; Bhatia, S. N., Development of Light-Activated CRISPR Using Guide RNAs with Photocleavable Protectors. Angew. Chem. Int. Ed. 2016, 55, 12440−12444.
6. Moroz-Omori, E. V.; Satyapertiwi, D.; Ramel, M. C.; Hogset, H.; Sunyovszki, I. K.; Liu, Z. Q.; Wojciechowski, J. P.; Zhang, Y. Y.; Grigsby, C. L.; Brito, L.; Bugeon, L.; Dallman, M. J.; Stevens, M. M., Photoswitchable gRNAs for Spatiotemporally Controlled CRISPRCas-Based Genomic Regulation. ACS Cent. Sci. 2020, 6, 695−703.
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn