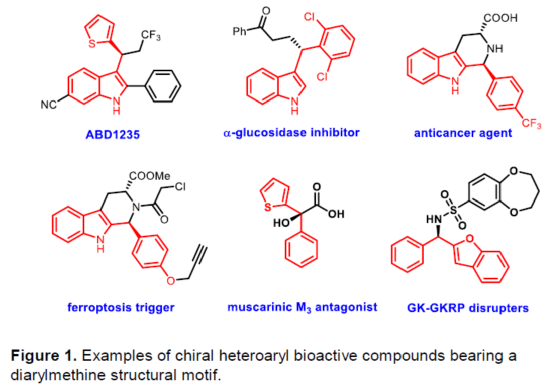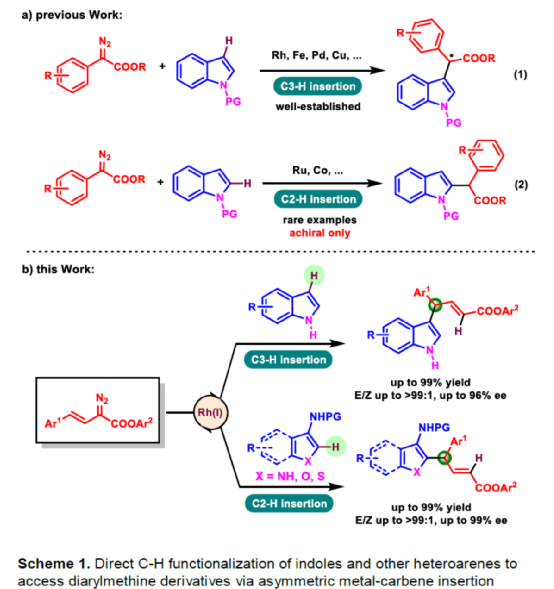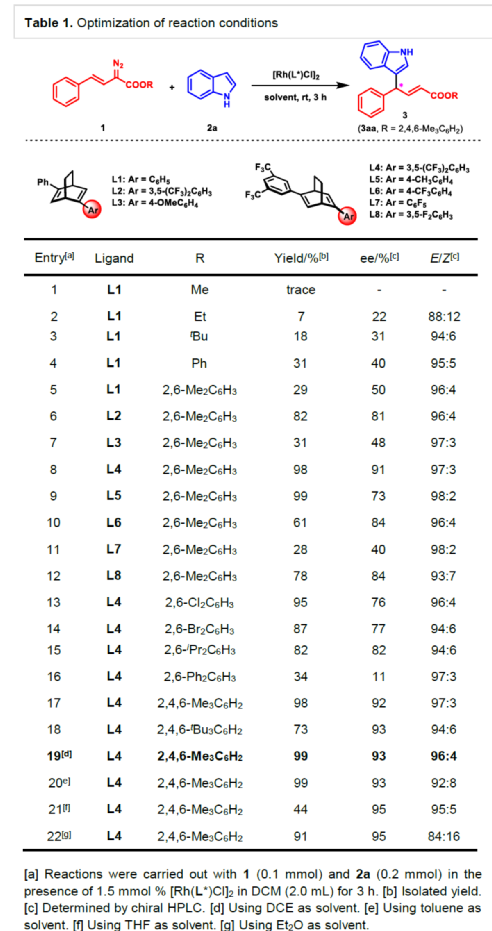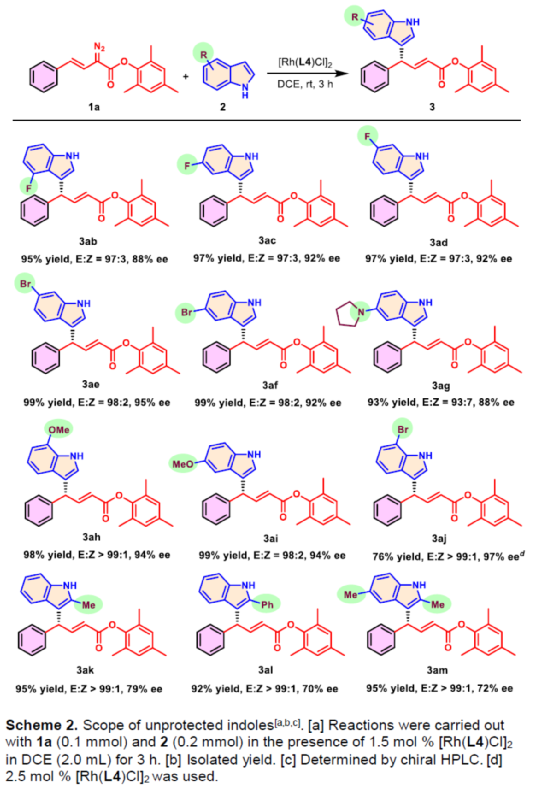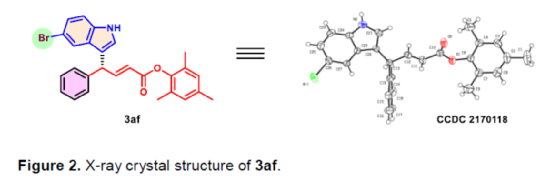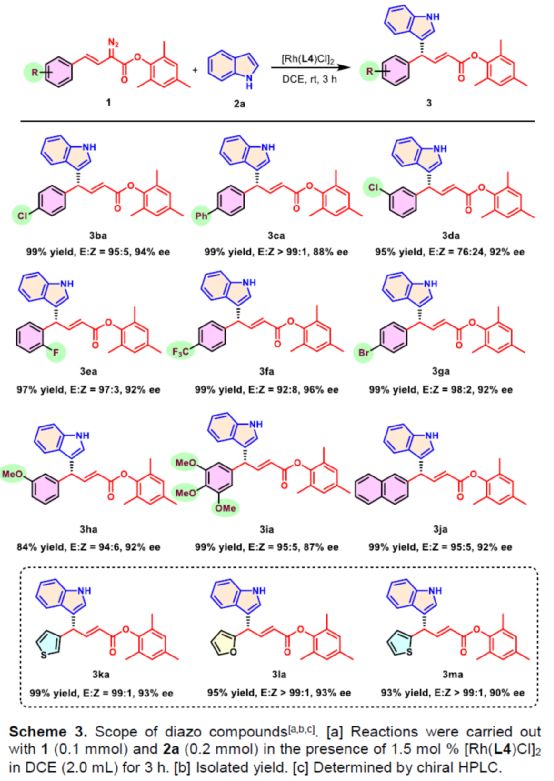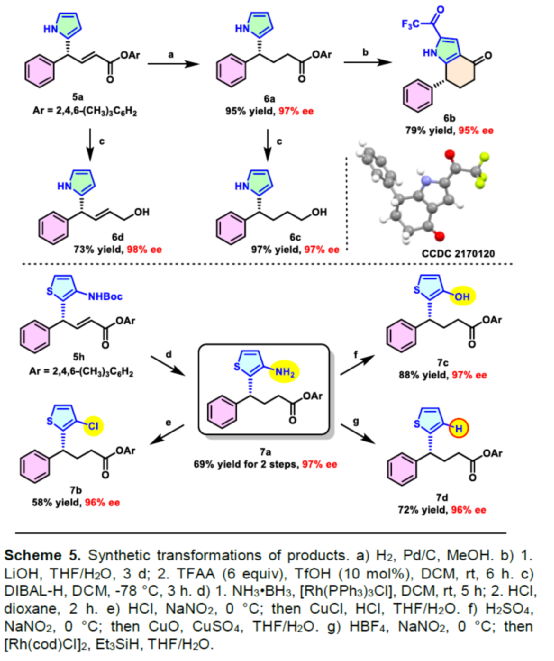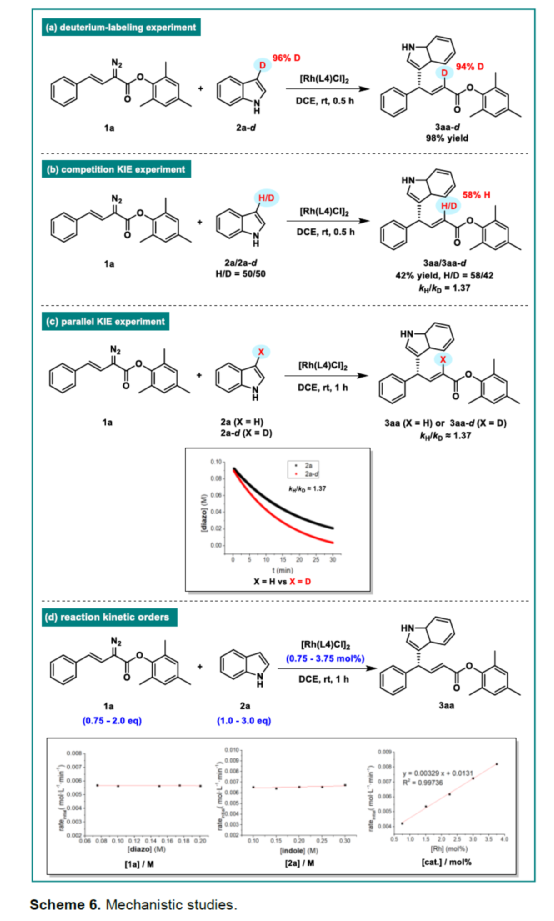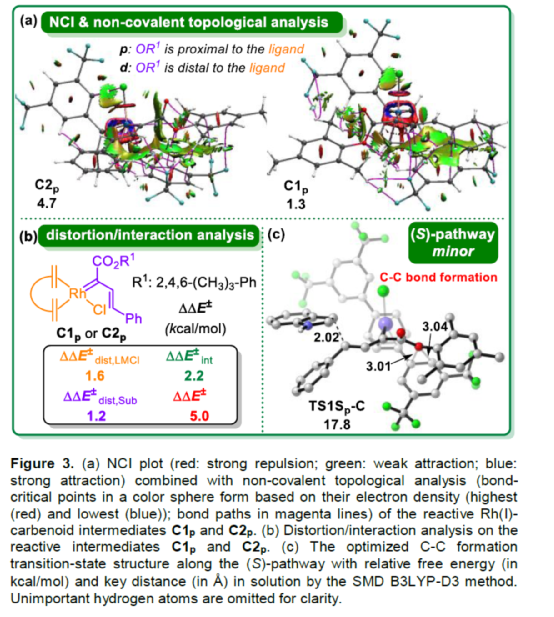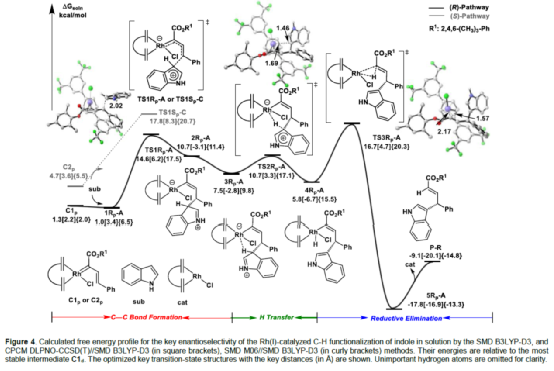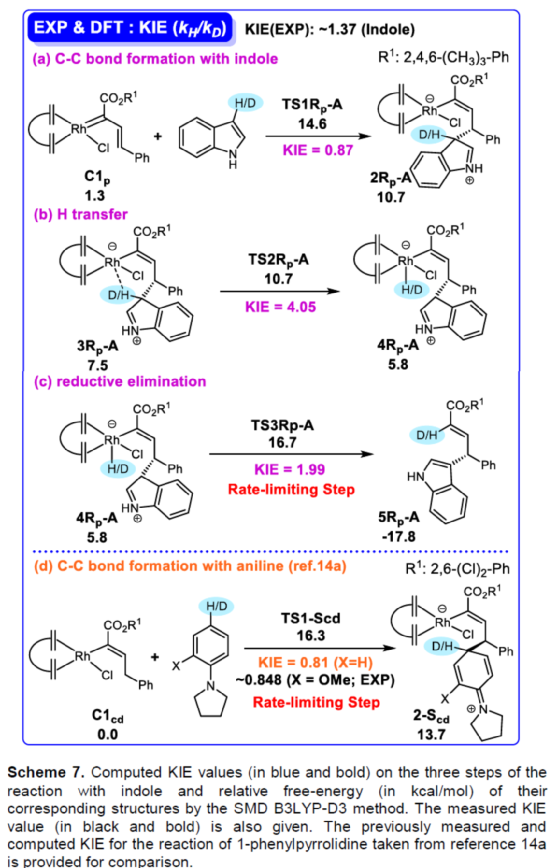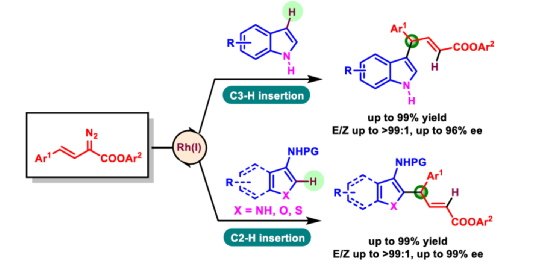
(图片来源:Angew. Chem. Int. Ed.)含有叔碳立体中心的手性二芳基次甲基骨架广泛存在于各类天然产物、生物活性化合物和合成分子中。特别是,含有吲哚或其它杂芳烃的手性偕-二芳基分子是一类具有多种生物学和药学特性的独特化合物(Figure 1)。(图片来源:Angew. Chem. Int. Ed.)近些年,化学家们已开发出多种构建此类化合物的优雅方法。其中,金属卡宾诱导的α-重氮羰基化合物与吲哚的不对称C3-H键插入反应是一种具有吸引力的方法,并且手性Rh(II)、Fe(II)、Pd(II)、Cu(I)和Ir(III)配合物已成功用于该转化(Scheme 1a, eq 1)。最近,也有文献报道了有机催化吲哚和亚砜型叶立德(sulfoxonium ylides)的不对称C3-H键插入反应。然而,上述的反应仅获得对映体富集的α-(3-吲哚基)-α-芳基乙酸酯。同时,大多数例子将底物中的NH键进行保护,从而导致额外的脱保护步骤。此外,由于吲哚的C3-和N1-位固有的亲核反应性以及对其反应中对映选择性的控制难题,导致吲哚的催化不对称C2-H键官能团化反应仍有待进一步的探索,涉及类卡宾插入(Scheme 1a, eq 2)。基于前期工作的总结(J. Am. Chem. Soc. 2021, 143, 2608.;J. Am. Chem. Soc. 2021, 143, 8583.),近日,南方科技大学徐明华课题组报道了铑(I)催化未保护吲哚与芳基乙烯基重氮乙酸酯的位点选择性、直接C2-H/C3-H键的官能团化反应,涉及一种独特的区域专一性和对映选择性。同时,该策略还可用于含有游离NH键的吡咯和其它杂芳烃的不对称C-H键插入反应(Scheme 1b)。(图片来源:Angew. Chem. Int. Ed.)首先,作者以1与吲哚2a作为模型底物,进行了相关反应条件的筛选(Table 1)。当底物1中R为2,4,6-三甲基苯基时,以[Rh(L4)Cl]2作为催化剂,在DCE溶剂中室温反应3 h,可以99%的收率得到产物3aa,ee为93%,E/Z为96:4。(图片来源:Angew. Chem. Int. Ed.)在获得上述最佳反应条件后,作者对未保护吲哚底物2的范围进行了扩展(Scheme 2)。首先,当吲哚底物的苯环上含有卤素、吡咯基、甲氧基、甲基等时,均可顺利与1a反应,获得相应的产物3ab-3aj,收率为76-99%,ee为88-97%,E/Z为93:7->99:1。其次,当吲哚底物的吡咯环上含有甲基、苯基时,也均与体系兼容,获得相应的产物3ak-3am,收率为92-95%,ee为70-79%,E/Z>99:1。(图片来源:Angew. Chem. Int. Ed.)通过晶体结构解析发现,3af的碳立体中心的绝对构型为R,C=C键的几何构型为E(Figure 2)。(图片来源:Angew. Chem. Int. Ed.)紧接着,作者对重氮酯底物1的范围进行了扩展(Scheme 3)。首先,当底物1中的末端烯烃上含有一系列不同电性取代的芳基时,均可顺利与2a反应,获得相应的产物3ba-3ia,收率为84-99%,ee为87-96%,E/Z为76:24->99:1。其中,当使用3-氯取代的芳基乙烯基重氮酯时,E/Z仅为76:24,但收率和对映选择性不受影响,如3da。其次,底物1中的末端烯烃取代为萘基、呋喃基、噻吩基时,均与体系兼容,获得相应的产物3ja-3ma,收率为93-99%,ee为90-93%,E/Z为95:5->99:1。(图片来源:Angew. Chem. Int. Ed.)除了未保护的吲哚底物以外,其它常见杂环化合物(如吡咯、呋喃、噻吩、苯并呋喃等),均与体系兼容,获得相应的产物5a-5q,收率为73-99%,ee为95-99%,E/Z为93:7->99:1(Scheme 4)。值得注意的是,上述的策略均获得C2-位官能团化的产物,并与C3-位官能团化的产物形成互补,进一步体现了反应的区域专一性。然而,3-NHBoc取代的苯并噻吩和3-NHTs取代的噻吩底物,具有较差的反应性。(图片来源:Angew. Chem. Int. Ed.)紧接着,作者对反应的实用性进行了研究(Scheme 5)。首先,5a经Pd/C催化的氢化反应可生成4-苯基-4-(1H-吡咯-2-基)丁酸酯6a,收率为95%,ee为97%。6a经水解以及分子内Friedel-Crafts酰化反应,可以79%的收率获得吡咯稠合双环化合物6b,ee为95%。在DIBAL-H条件下,5a中的酯基可选择性地还原成相应的醇而不影响双键,获得73%收率的烯丙醇化合物6d,ee为98%。同样,6a也可转化为6c,收率为97%,ee为97%。其次,5h经氢化与脱保护过程,可以69%的收率获得含有氨基的化合物7a,ee为97%。7a中的氨基可进一步转化为氯与羟基,且ee不受影响。值得注意的是,通过该策略还可合成对映体富集的γ-噻吩基-γ-苯基丁酸酯7d,这是通过以前非活化噻吩直接C-H官能团化反应不易实现的。(图片来源:Angew. Chem. Int. Ed.)此外,作者还对反应机理进行了进一步的研究(Scheme 6)。首先,通过氘标记与平行KIE实验表明,决速步在催化循环过程已经不再是和吲哚的C-C形成步骤(Schemes 6a-6c)。同时,通过原位红外研究表明,反应对铑-二烯催化剂表现出一级动力学,对重氮化合物1a和吲哚2a均表现出零级动力学(Scheme 6d)。因此,两种反应物对金属类卡宾中间体的形成几乎没有影响,从而表明重氮化合物的分解步骤和吲哚加成步骤都不是决速步骤。(图片来源:Angew. Chem. Int. Ed.)同时,通过相关的DFT计算以及相关KIE实验研究表明,在C-C加成步骤之后,两性离子中间体2Rp-A发生轻微的重排得到3Rp-A,随后经低能垒的质子转移,生成中性和五配位Rh(III)-氢化乙烯基中间体4Rp-A,最后经还原消除得到主要(R)-产物5Rp-A并再生活性催化剂(Figure 4)。值得注意的是,富电子的吲哚底物可降低C-C加成的能垒,并且还原消除是决速步骤。(图片来源:Angew. Chem. Int. Ed.)(图片来源:Angew. Chem. Int. Ed.)(图片来源:Angew. Chem. Int. Ed.)总结:南方科技大学徐明华课题组首次报道了一种铑(I)/手性二烯催化的简单无保护吲哚、吡咯及其类似物(如呋喃、噻吩和苯并呋喃)与芳基乙烯基重氮酯的对映选择性C-H键的官能团化反应,从而合成了一系列含有二芳基次甲基的α,β-不饱和酯。同时,通过微调吲哚环上的电子密度,可实现了游离(NH)-吲哚的C2-H和C3-H位点专一性不对称官能团化反应。机理和DFT计算研究表明,富电子的吲哚底物会降低C-C加成势垒,并且还原消除是决速步骤。
文章详情:
Rhodium(I) Carbene-Promoted Enantioselective C-H Functionalization of Simple Unprotected Indoles, Pyrroles and Heteroanalogues: New Mechanistic Insights
Ming-Hua Xu,Tian-Yi Wang,Xiao-Xuan Chen,Dong-Xing Zhu,Lung Wa Chung
https://doi.org/10.1002/anie.202207008