

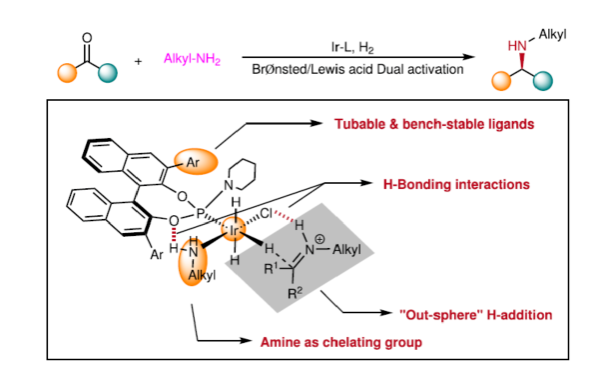
(图片来源:Nat. Commun.)
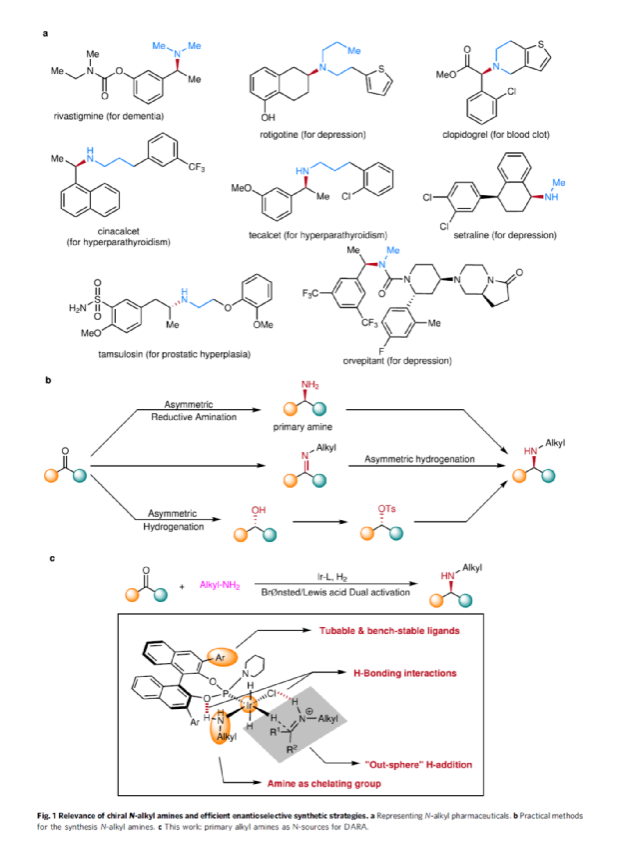
手性N-烷基胺广泛存在于各类活性药物中(Fig. 1a)。目前,不对称氢化和还原胺化反应是两种实用且高效的合成策略(Fig. 1b)。其中,直接不对称还原胺化反应(DARA)是构建手性胺最为有效的方法之一,可通过一步反应直接实现酮与胺的偶联,从而避免了不对称氢化反应中的多步反应过程。虽然过渡金属催化DARA已取得了一定的进展,但胺的偶联底物范围仍非常有限。除了分子内的DARAs,大多数DARAs的氮源通常分为三类:(1)无机铵盐/氨,用于合成伯胺;(2)芳香胺,可生成手性仲胺;(3)仲胺源,用于构建手性叔胺。同时,还存在一些特殊的胺类,如苄胺、二苯甲胺、肼、酰肼等。
前期,在过渡金属催化DARAs中,仅有一个使用烷基胺(MeNH2)作为氮偶联底物的例子,以及一些其它特殊的烷基胺(如苄胺、二苯甲胺和烯丙胺)。同时,N-烷基亚胺不对称氢化直接合成N-烷基胺的文献也非常少,其中在两种情况下,N-烷基胺原位转化为NSiH2Ph和N-Boc产物,以降低对催化剂的抑制作用。此外,限制DARA反应的主要原因在于烷基不能通过次级相互作用(如氢键、π-效应和静电相互作用)与功能性催化物种配位或发生相互作用。作者设想,是否可利用空间可调节的手性配体,能够在催化过程中有效地限制烷基的位置以及添加剂的加速作用,从而解决上述的问题。
在此,西北农林科技大学常明欣课题组报道了一种铱亚磷酰胺配合物催化酮与伯烷基胺的高效不对称还原胺化反应,合成了一系列手性N-烷基仲胺衍生物(Fig. 1c)。其中,使用空间位阻更大的3,3'-1-萘基取代基的亚磷酰胺手性配体可控制反应的对映选择性,且烷基和催化配合物之间没有次级相互作用。机理研究表明,反应涉及outer-sphere氢化物加成的过程,其中两个氢键相互作用对于反应至关重要。
(图片来源:Nat. Commun.)
首先,作者以苯乙酮1与3-苯基-1-丙胺2作为模型底物,进行了不对称还原胺化反应条件的筛选(Table 1)。当以[Ir(cod)Cl]2-(R)-L4作为催化剂,KOtBu作为碱,FeCl3与Ti(OiPr)4作为添加剂,在CF3CH2OH/MeOAc的混合溶剂中于氢气氛围(40 atm)中反应,可以99%的收率和98%ee获得产物3。
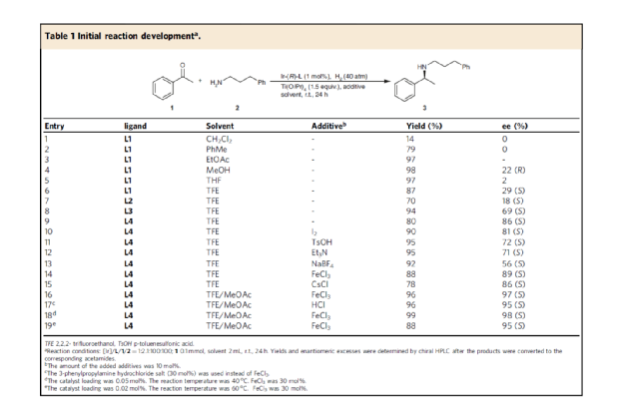
(图片来源:Nat. Commun.)
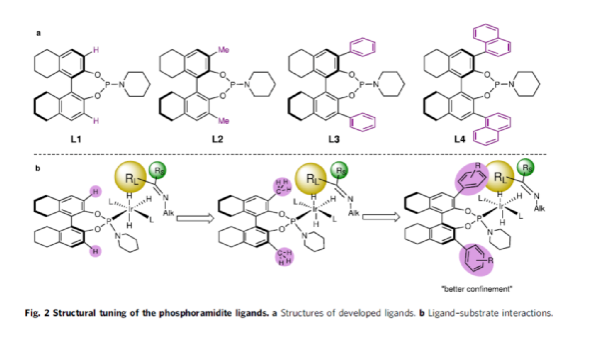
(图片来源:Nat. Commun.)
在获得上述最佳反应条件后,作者对底物范围进行了扩展(Fig. 3)。首先,苯乙酮的芳基上含有不同电性取代基时,均可顺利与3-苯基丙胺2反应,获得相应的产物4-21,收率为94-98%,ee为95-98%。对于含有空间位阻的芳香酮底物,也与体系兼容,获得相应的产物22-23和26-29,收率为53-96%,ee为85-98%。值得注意的是,当使用L5作为手性配体时,可获得相反构型的产物27-29。同时,苯乙酮的芳基上含有-NO2、-OBn、-SMe、-NHBoc、-CO2Me等时,均与体系兼容,获得相应的产物30-35,收率为92-96%,ee为92-98%。2-乙酰噻吩也是合适的底物,以94%的收率和93%ee获得产物36。其次,一系列不同取代的烷基伯胺与苄胺,均可顺利进行反应,获得相应的产物37-46,收率为92-96%,ee为95-98%。同时,含有杂芳基取代的伯胺,也是合适的底物,获得相应的产物47-50,收率为93-95%,ee为93-97%。对于含有-NHBoc、烯基和甲氧基取代的伯胺底物,也与体系兼容,获得相应的产物51-53,收率为94-96%,ee均为95%。
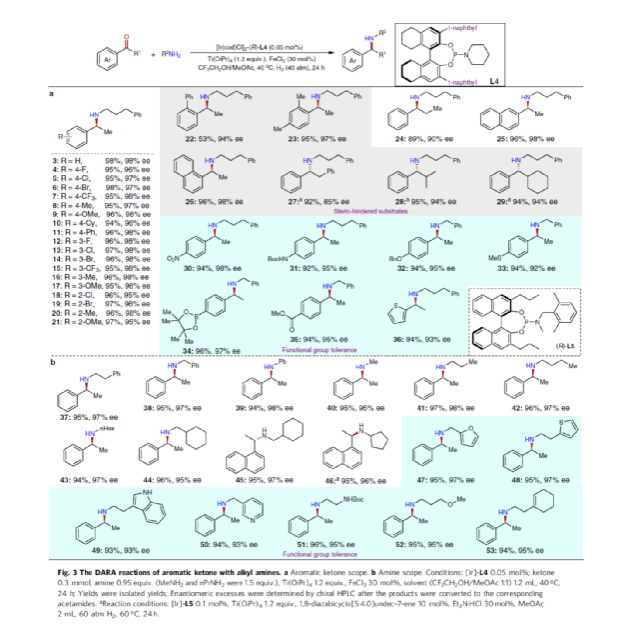
(图片来源:Nat. Commun.)
同时,作者发现,除了芳香酮底物外,含有直链、支链和环状的脂肪族酮底物均可与烷基胺顺利反应,获得相应的产物54-58,收率为94-95%,ee为88-96%。其次,通过该策略还可合成一系列全烷基胺产物59-61,收率为93-95%,ee为92-96%(Fig. 4a)。并且,当使用手性L6作为配体时,可使产物60和61具有更高的对映选择性。值得注意的是,克级规模实验,同样能够以94%收率和96%ee得到产物38。此外,通过该策略可合成一系列药物以及相应的药物中间体,如替卡塞(Tecalcet)、芬地林、卡巴拉汀与Orvepitant的关键中间体等(Fig. 4b)。
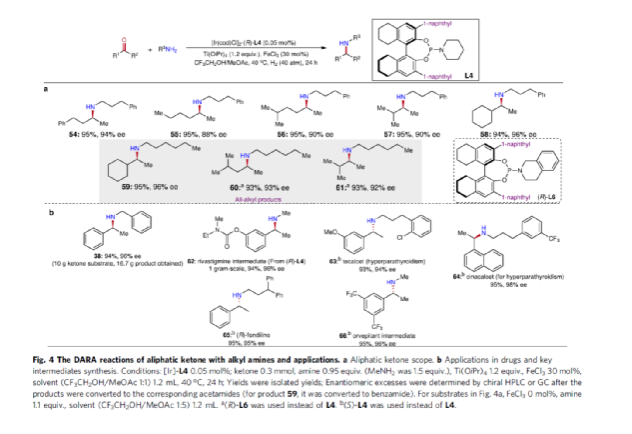
(图片来源:Nat. Commun.)
基于DFT计算的研究以及相关文献的查阅,作者提出了一种合理的催化循环过程(Fig. 5)。首先,甲胺与Ir配位可破坏二聚体I(由[Ir(cod)Cl]2与L3原位生成),生成配合物II。配合物II通过甲胺的(N)-H键和手性配体L3的(P)-O键之间的氢键相互作用,从而使其稳定(TS3-S)。紧接着,通过氧化加成生成Ir(III)中间体IV,其中H2被活化并通过过渡态TS1加成至Ir(I)配合物中。随后,第二个H2更偏向与P的顺式位配位而不是反式位(存在竞争性中间体IV'和IV''),从而生成配合物V。在亚胺底物的协助下,配合物V经异裂(heterocleaves),生成的氢化物可与Ir加成生成离子对配合物VI,涉及过渡态TS2。值得注意的是,对映选择性的起源发生在氢化物加成步骤中。最后,在热力学上,氢化物从亚胺底物的Si-face加成更为有利(TS3-S),而非Re-face加成(TS3-R),从而获得目标产物并再生配合物IV,以完成催化循环。
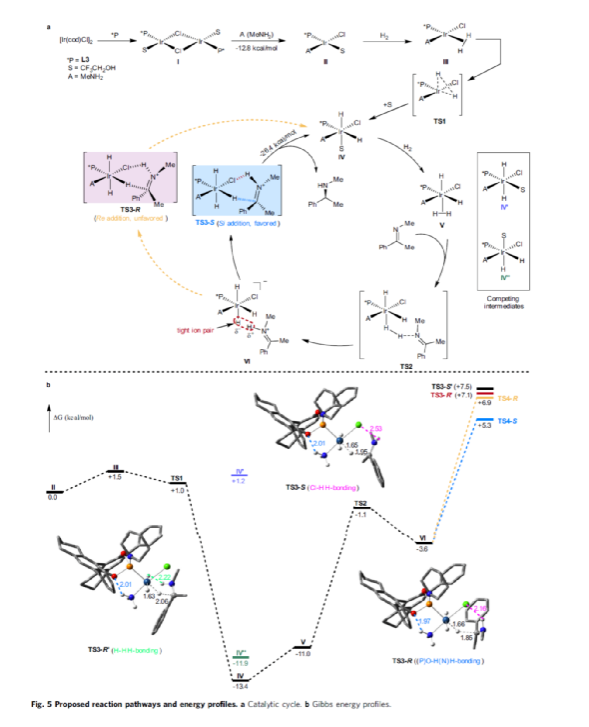
(图片来源:Nat. Commun.)
总结:西北农林科技大学常明欣课题组报道了一种铱亚磷酰胺配合物催化酮与伯烷基胺的高效不对称还原胺化反应,合成了一系列手性N-烷基仲胺衍生物。同时,该策略具有广泛的底物范围、优异的收率、优异的对映选择性等特点。此外,通过对药物以及药物中间体的合成,从而进一步证明了反应的实用性。机理研究表明,反应涉及outer-sphere氢化物加成的过程,其中:亚磷酰胺手性配体的(P)O与烷基胺(N)H键以及铱中的氯与亚胺中的(N)H键两个氢键相互作用对于反应至关重要。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn