- 首页
- 资讯
华东理工大学邓卫平团队Angew:金/铱串联催化对映选择性合成螺缩酮和螺缩醛胺
来源:化学加原创 2022-05-17
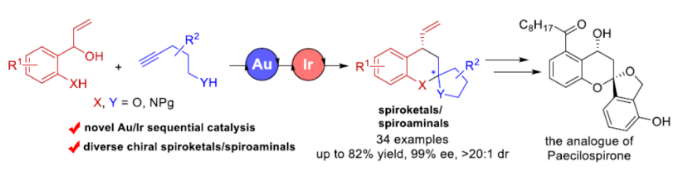
导读:近日,华东理工大学邓卫平教授与杨武林副研究员团队开发了一种金和铱串联催化体系,并成功实现了外消旋2-(1-羟基烯丙基)苯酚与炔醇/炔酰胺之间的对映选择性串联反应。在该策略中,原位生成的环外乙烯基醚或烯酰胺可与π-ally-Ir两亲性配合物发生不对称烯丙基化/螺缩酮化反应,从而以优异的对映选择性获得一系列螺缩酮和螺缩醛胺(spiroaminals)衍生物。同时,当以外消旋2-(1-羟基烯丙基)苯胺为底物时,反应涉及动力学拆分过程,并以高收率获得对映体富集的螺缩醛胺和2-(1-羟基烯丙基)苯胺。此外,通过该策略还可实现Paecilospirone类似物的高效对映选择性合成。文章链接DOI:10.1002/anie.202203661
(图片来源:Angew. Chem. Int. Ed.)
螺缩酮是许多天然产物和药理活性化合物中的关键结构单元。由于其独特的结构,此类分子常表现出广泛的生物活性。例如,Berkelic acid对OVCAR-3细胞显示出选择性活性、Paecilospirone是一种抗有丝分裂的化合物、Chaetoquadrin C是一种单胺氧化酶(MAO)抑制剂、γ-Rubromycin具有抗菌活性等(Figure 1)。此外,螺缩酮也是优势手性配体中的重要骨架。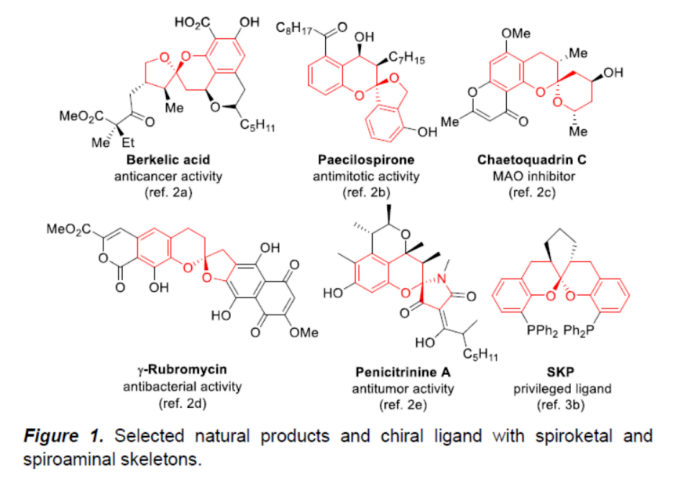
(图片来源:Angew. Chem. Int. Ed.)
因此,许多课题组已开发出多种用于合成对映体富集螺缩酮衍生物的有效方法。其中,环外乙烯基醚或烯酰胺与合适的两亲性底物进行串联加成/螺缩酮反应是一种可靠且具原子经济性的方法(Scheme 1a)。由于稳定性差,乙烯基醚和烯酰胺中间体通常通过金催化炔醇或酰胺的环化异构化原位形成。在已知的文献中,反应主要涉及缺电子π-键(如C=N、C=C)的共轭加成,然后进行螺缩酮化反应,从而实现螺缩酮和螺缩醛胺的立体选择性合成。2021年,邓卫平团队报道了一种通过Ir-介导2-(1-羟基烯丙基)苯酚的脱水过程从而形成一种新型π-ally-Ir两亲性配合物,并可用于对映体富集benzo[b]oxocines的合成。在此,华东理工大学邓卫平教授与杨武林副研究员团队开发了一种金和铱催化2-(1-羟基烯丙基)苯酚与炔醇/炔酰胺之间的串联反应,涉及环异构化/烯丙基化/螺缩酮化的过程,并以高非对映选择性和优异对映选择性获得一系列螺缩酮和螺缩醛胺衍生物(Scheme 1b)。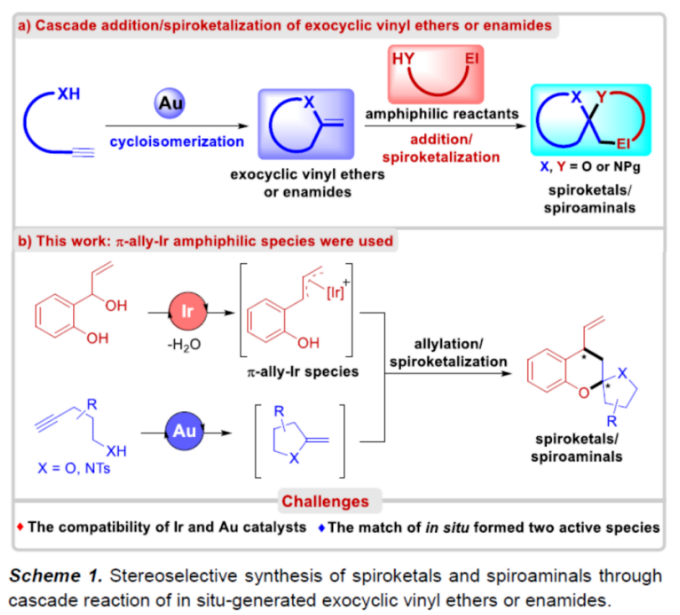
(图片来源:Angew. Chem. Int. Ed.)
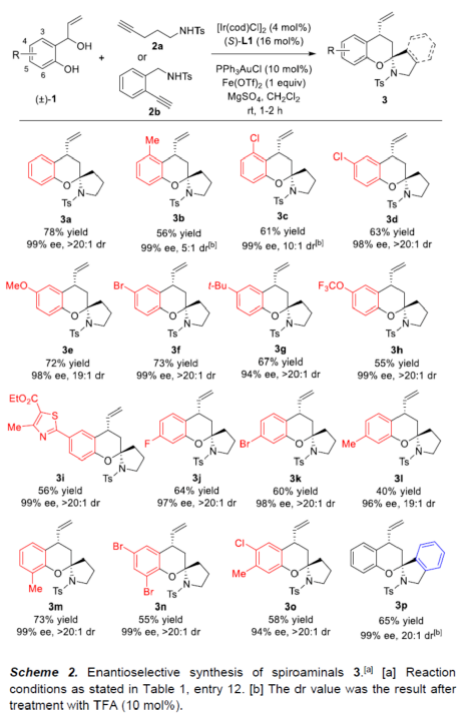
首先,作者以2-(1-羟基烯丙基)苯酚(±)-1a与炔酰胺2a作为模型底物,进行了相关反应条件的筛选(Table 1)。当以[Ir(cod)Cl]2与PPh3AuCl作为催化剂,(S)-L1作为手性配体,Fe(OTf)2作为酸性促进剂,MgSO4作为添加剂,在CH2Cl2溶剂中反应,能以78%的收率获得产物3a(> 20:1 dr,99% ee)。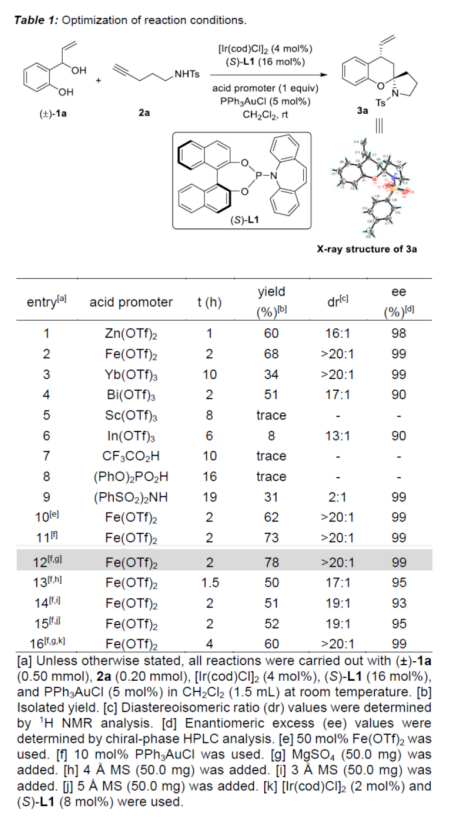
(图片来源:Angew. Chem. Int. Ed.)
在获得上述最佳反应条件后,作者首先对合成螺缩醛胺3的底物范围进行了扩展(Scheme 2)。在苯环的不同位含有-Me、-tBu、-OMe、-OCF3、卤素和杂环取代的底物(±)-1,均可顺利进行反应,获得相应的产物3a-3o,收率为40-78%,ee为94-99%。值得注意的是,除3b和3c外,其余产物均具有出色的非对映选择性。此外,炔酰胺2b也可与(±)-1a顺利反应,获得65%收率的双苯环化螺缩醛胺3p,ee为99%,dr为20:1。(图片来源:Angew. Chem. Int. Ed.)紧接着,作者对合成螺缩酮5的底物范围进行了扩展(Scheme 3)。首先,一系列不同取代的炔醇底物4,均可与(±)-1a顺利反应,获得相应的螺缩酮产物5a-5e,收率为30-74%,ee为98-99%,非对映选择性较差(仅有5c可通过差向异构过程将dr提高至20:1)。其次,芳基上含有一系列不同取代的底物(±)-1,均与体系兼容,获得相应的螺缩酮产物5f-5k,收率为65-82%,ee为98-99%,dr为8:1-10:1。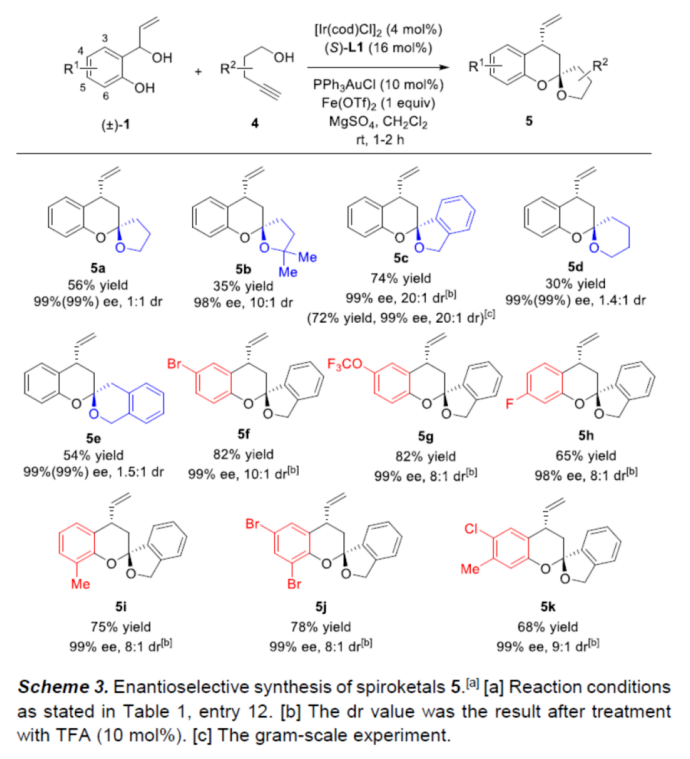
(图片来源:Angew. Chem. Int. Ed.)
同时,一系列2-(1-羟基烯丙基)苯胺 (±)-6也可作为合适的底物,可顺利与炔醇4a或4c反应,获得相应的螺缩醛胺产物7a-7f,收率为29-43%,ee为95-99%,dr为2:1-4:1(Scheme 4)。值得注意的是,在该反应过程中实现了(±)-6的动力学拆分,并获得相应的对映体富集底物(R)-6a-6e。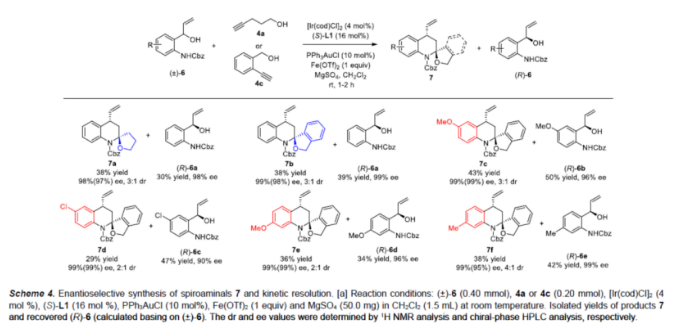
(图片来源:Angew. Chem. Int. Ed.)
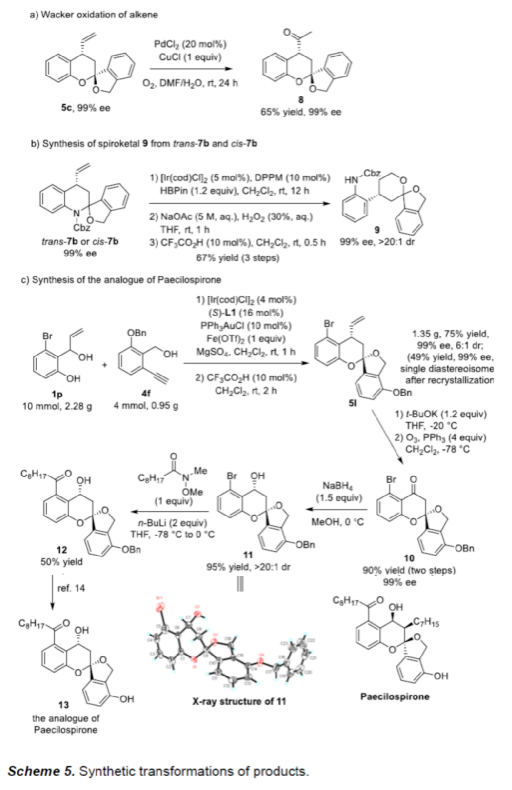
此外,作者还对反应的实用性进行了研究(Scheme 5)。首先,5c中的烯基可通过Wacker氧化,获得65%收率与99%ee的化合物8(Scheme 5a)。其次,7b经硼氢化-氧化-螺缩酮化的串联过程,可获得化合物9,收率为67%,dr > 20:1和ee为99%(Scheme 5b)。有趣的是,两种非对映异构体(trans-7b和cis-7b)都可生成相同的产物9。此外,该策略还可用于Paecilospirone类似物的高效对映选择性合成(Scheme 5c)。下载化学加APP,阅读更有效率。(图片来源:Angew. Chem. Int. Ed.)为了进一步了解反应的机理,作者进行了相关的控制实验。其中,在Ir催化剂和Fe(OTf)2存在下,环外烯醇醚14可与(±)-1a可顺利反应,获得产物5c,收率为50%,ee为97%,dr为20:1,从而表明反应可能涉及Au-催化环异构化和Ir-催化烯丙基化/螺缩酮化的串联过程(Scheme 6)。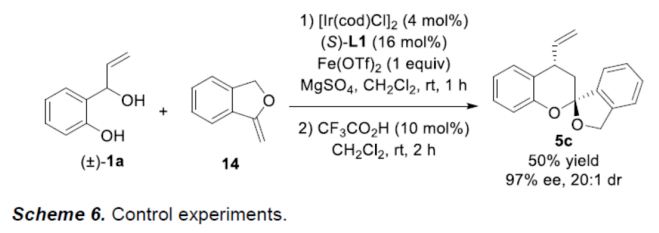
(图片来源:Angew. Chem. Int. Ed.)
基于上述的研究以及相关文献的查阅。作者提出了一种合理的催化循环过程(Scheme 7)。首先,2a经Au催化5-exo-dig分子内氢胺化可生成外环烯酰胺C。同时,在Fe(OTf)2存在下,手性Ir(I)配合物经氧化加成活化1a生成π-ally-Ir配合物D。随后,中间体D与C反应,生成烯丙基化中间体E并再生Ir催化剂。最后,由于酚羟基和磺酰胺之间的氢键相互作用,导致OH对亚胺离子的Re-面 进行进攻,在释放质子后即可获得目标产物(2R,4S)-3a。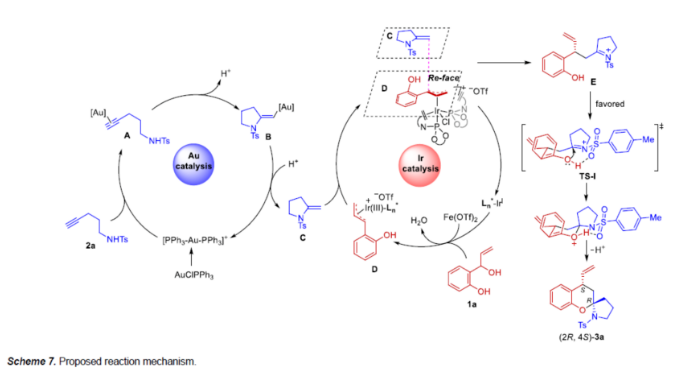
(图片来源:Angew. Chem. Int. Ed.)
总结:华东理工大学邓卫平教授与杨武林副研究员团队开发了一种金和铱串联催化2-(1-羟基烯丙基)苯酚与炔醇/炔酰胺之间的对映选择性串联反应,从而以高非对映选择性和优异对映选择性合成一系列螺缩酮和螺缩醛胺衍生物。同时,该策略涉及Au-催化的环异构化和Ir-催化的烯丙基化/螺缩酮化的串联过程。值得注意的是,当使用外消旋2-(1-羟基烯丙基)苯胺为底物时,反应存在动力学拆分的过程,并获得光学纯的螺缩醛胺和2-(1-羟基烯丙基)苯胺。此外,通过该策略还可实现Paecilospirone类似物的高效对映选择性合成。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn