- 首页
- 资讯
华中师范大学肖文精与陆良秋团队JACS:光辅助钴催化实现芳基碘的不对称还原Grignard-型加成反应
来源:化学加原创 2022-05-13
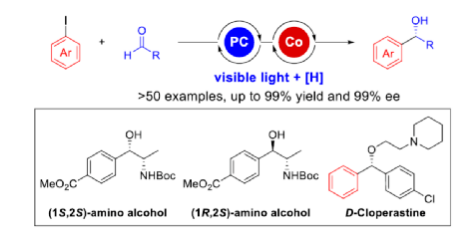
导读:Grignard加成反应是合成醇类化合物最为重要的方法之一。然而,在不对称催化领域中主要依赖于有机金属亲核试剂的使用。近日,华中师范大学肖文精与陆良秋团队首次报道了一种可见光诱导钴催化不对称还原Grignard-型加成反应,并合成了一系列手性苯甲醇衍生物。同时,该策略具有反应条件温和、官能团兼容性高、对映选择性优异、无需使用贵金属催化剂等特点。动力学实验表明,芳基钴配合物迁移插入至醛中的过程是还原加成反应中的决速步骤。文章链接DOI:10.1021/jacs.2c02481
(图片来源:J. Am. Chem. Soc.)
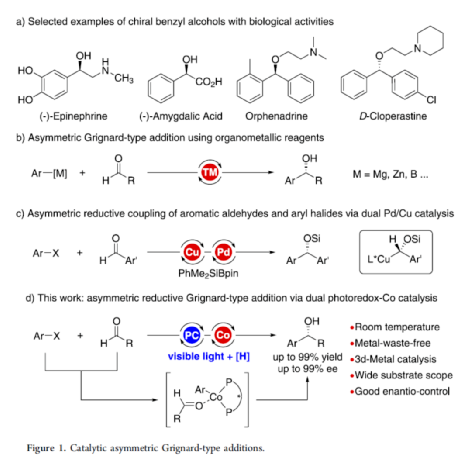
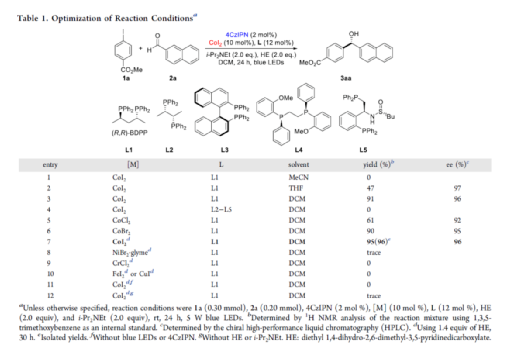
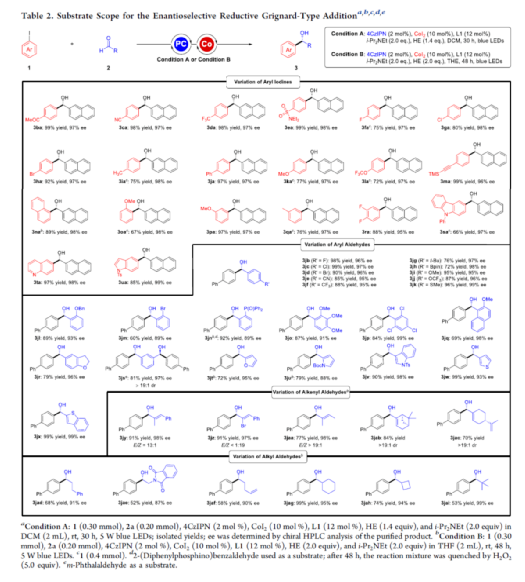
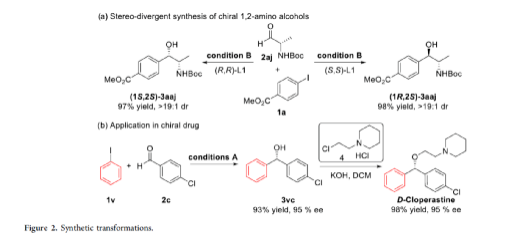
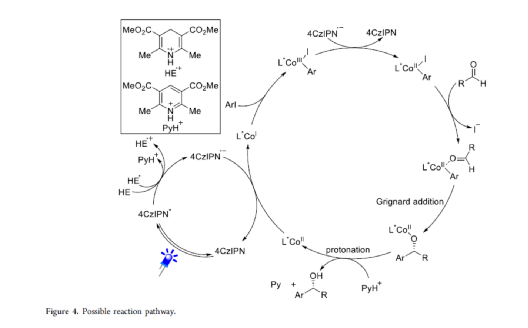
手性苯甲醇是一种重要的结构单元,广泛存在于天然产物、药物和材料等中(Figure 1a)。因此,对于手性苯甲醇分子的合成具有重要的意义。其中,过渡金属或酶催化酮的不对称氢化反应是最为环保、原子经济性的方法。相比之下,过渡金属催化有机金属试剂(Mg、Zn、B等)与羰基化合物的不对称还原Grignard-型加成反应,是合成苯甲醇衍生物的另一种有效的方法(Figure 1b)。然而,此类反应常存在化学计量有机金属试剂的使用、反应条件苛刻、生成金属废物等问题。目前,使用芳基卤代替金属试剂的还原偶联策略是一种具有前途的方法,具有反应条件温和且步骤经济性高等特点,但对于催化不对称策略的开发仅有少数成功的例子。2006年,Cheng课题组报道了一种钴催化2-碘苯甲酸酯和醛的不对称环化反应。随后,也报道了相关Pd-或Ni-催化芳基卤与酮的分子内不对称加成反应。尽管已取得一定的进展,但通过一般芳基卤和醛合成光学纯醇的策略仍具有挑战。直至2019年,Ohmiya课题组报道了一种Pd/Cu双重催化芳香醛与芳基卤的不对称还原偶联反应(Figure 1c)。在此,华中师范大学肖文精与陆良秋团队首次报道一种可见光诱导钴催化不对称还原反应,涉及芳基卤与芳基/烷基醛的Grignard加成过程,并以优异的收率与对映选择性获得一系列手性苯甲醇衍生物(Figure 1d)。首先,作者以4-碘苯甲酸甲酯1a与2-萘醛2a作为模型底物,进行了相关不对称还原反应条件的筛选(Table 1)。当以4CzIPN作为有机光催化剂,CoI2作为金属催化剂,L1作为配体,i-Pr2NEt作为缚酸剂,HE(Hantzsch ester)作为还原剂,在DCM溶剂中于蓝色LED辐射下反应,能以95%的收率和96%ee获得手性醇产物3aa。在获得上述最佳反应条件后,作者首先对芳基碘的底物范围进行了扩展(Table 2)。研究表明,芳基碘的芳基上含有一系列不同电子性质的取代基时,均可顺利反应,获得相应的产物3ba-3ra,收率为67-98%,ee为95-98%。其中,带有吸电子基团的芳基碘底物具有更高的反应性。同时,一系列杂环取代的碘化物,如咔唑、喹啉和吲哚基,同样与体系兼容,获得相应的产物3sa-3ua,收率为66-97%,ee为97-99%。紧接着,作者对芳香醛的底物范围进行了扩展。研究表明,苯甲醛的对位含有一系列不同电子性质的取代基时,均可顺利反应,获得相应的产物3jb-3jk,收率为72-99%,ee为95-99%。值得注意的是,具有硼酸酯取代的苯甲醛底物,同样能够与体系兼容,如3jh。对于苯甲醛的邻位含有一系列不同的取代基时,也可顺利进行反应,获得60-92%收率的相应产物3jl-3jq,但对映选择性有所降低(89-99% ee)。有趣的是,当以1,3-苯二醛(2s)作为底物时,可获得高光学纯的手性二醇3js,收率为81%,ee为97%,dr > 19:1。对于一系列杂芳基取代的醛,同样是合适的底物,获得相应的产物3jt-3jx,收率为72-99%,ee为88-99%。此外,一系列多取代的α,β-不饱和醛也成功进行反应,获得优异E/Z比的相应产物3jy-3jaa,收率为77-91%,ee为97-98%。天然手性桃金娘醛(myrtenal,2ab)和紫苏醛(2ac)也与体系兼容,获得70-84%收率的产物3jab和3jac,dr > 19:1。值得注意的是,一系列烷基醛(2ad-2ai)也可顺利反应,获得相应的产物3jad-3jai,收率为52-99%,ee为87-99%。随后,作者对反应的实用性进行了研究(Figure 2)。首先,以手性氨基醛2aj与1a作为底物,可直接合成具有价值的手性1,2-氨基醇衍生物,即两种非对映异构体(1S,2S)-3aaj和(1R,2S)-3aaj,收率为98-99%,dr > 19:1(Figure 2a)。其次,以1v与2c作为底物,通过两步串联策略,可直接合成高光学纯的中枢性镇咳药D-氯哌斯汀(Figure 2b)。此外,作者还对反应机理进行了进一步的研究(Figure 3)。首先,1j与环丙基甲醛2ak在标准条件下进行自由基钟实验时,未生成自由基开环偶联产物3jak',仅获得还原加成产物3jak,从而表明在光氧化还原条件下,醛未经单电子还原生成自由基阴离子配合物(Figure 3a)。其次,在标准条件下使用1a与2a/2a-D进行的KIE实验表明,芳基钴配合物迁移插入至醛的过程是还原加成反应中的决速步骤(Figure 3b)。此外,通过非线性实验表明,该还原Grignard-型加成反应是由钴/L1配合物(1:1)催化促进(Figure 3c)。该结果与CoBr2(L1)单晶结构的结果一致(Figure 3d)。基于上述的研究以及相关文献的查阅,作者提出了一种合理的催化循环过程(Figure 4)。首先,在可见光照射下,光激发的4CzIPN*经单电子还原生成还原性的4CzIPN•-,可通过单电子转移将Co(II)/L1配合物转化为低价的Co(I)/L1配合物。随后,芳基碘与Co(I)/L1配合物进行氧化加成生成芳基Co(III)/L1配合物。接下来,芳基Co(III)/L1配合物被另一个4CzIPN•-还原生成芳基Co(II)/L1配合物。在与醛进行配位后,芳基Co(II)/L1配合物对羰基的碳进行高度立体专一性的Grignard-加成后,从而生成手性醇阴离子。最后,经质子化后,即可获得目标产物。然而,目前也不能排除芳基Co(III)/L1配合物对醛的迁移插入过程。总结:华中师范大学肖文精与陆良秋团队首次报道一种可见光诱导钴催化芳基碘和醛的不对称还原Grignard-型加成反应,并合成了一系列手性苯甲醇衍生物。同时,该策略具有反应条件温和、底物范围广泛、官能团兼容性高、对映选择性优异、收率高等特点。此外,通过该策略还可实现手性1,2-氨基醇的立体发散性合成以及两步合成手性D-氯哌斯汀药物。机理研究表明,芳基钴配合物迁移插入至醛的过程是还原加成反应中的决速步骤。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn