


近二十年,肿瘤免疫治疗被认为是治疗晚期和转移性肿瘤最有效的新方法之一,该疗法通过缓解肿瘤微环境的免疫抑制现象,刺激机体免疫系统的抗肿瘤活力,从而取得显著疗效。但是许多肿瘤细胞在免疫逃逸的过程中通常表现为低抗原性,使得体内免疫细胞难以识别肿瘤抗原而发挥疗效。近十年的研究显示,一些抗癌药物或物理手段不仅能杀死肿瘤细胞,还会促进肿瘤抗原的暴露,提高肿瘤细胞的免疫原性,有利于免疫系统的识别,这一现象被称为免疫原性细胞死亡(ICD)。然而,肿瘤细胞在发生ICD的同时,会伴随大量ATP的释放,当其被胞外核苷酶代谢后,最终会生成大量腺苷(ADO),与广泛存在于各种免疫细胞表面的2A型腺苷受体(A2AR)结合后,激活免疫细胞的免疫抑制通路,加剧肿瘤免疫抑制微环境。因此,ICD诱导的抗肿瘤免疫和ADO介导的免疫抑制之间的矛盾是一个巨大的挑战。
杜永忠教授致力于新型纳米给药系统的开发及肿瘤靶向免疫治疗研究,课题组近年来在Angewandte Chemie International Edition、Nano Letters、Biomaterials、 Journal of Controlled Release、ACS Applied Materials & Interface等国际著名期刊发表多项原创性工作。本研究在前期工作的基础上,针对上述矛盾,设计了一种共载ICD诱导剂阿霉素和A2AR拮抗剂SCH 58261的温敏性胶束,并在表面修饰E-选择素,静脉注射后可在E-选择素的介导下粘附在白细胞的表面,随白细胞一同迁移至肿瘤部位,实现纳米粒的肿瘤高度富集,还解决了人工合成纳米粒易被网状内皮系统捕获、难以穿透生物屏障等问题。
研究结果表明,E-选择素修饰的载药胶束静脉注射后,可在血液循环中迅速粘附于白细胞表面,通过“搭乘白细胞的便车”实现肿瘤高效靶向。积累在肿瘤部位的载药胶束在局部微波热疗的刺激下实现药物的快速释放,所释放的阿霉素在阻滞肿瘤细胞周期的同时,还可以诱导肿瘤发生ICD,激活机体的肿瘤特异性细胞免疫,而SCH 58261通过有效拮抗各种免疫细胞表面的A2AR,缓解肿瘤免疫抑制微环境,最终实现化疗和免疫治疗的协同抗肿瘤作用。
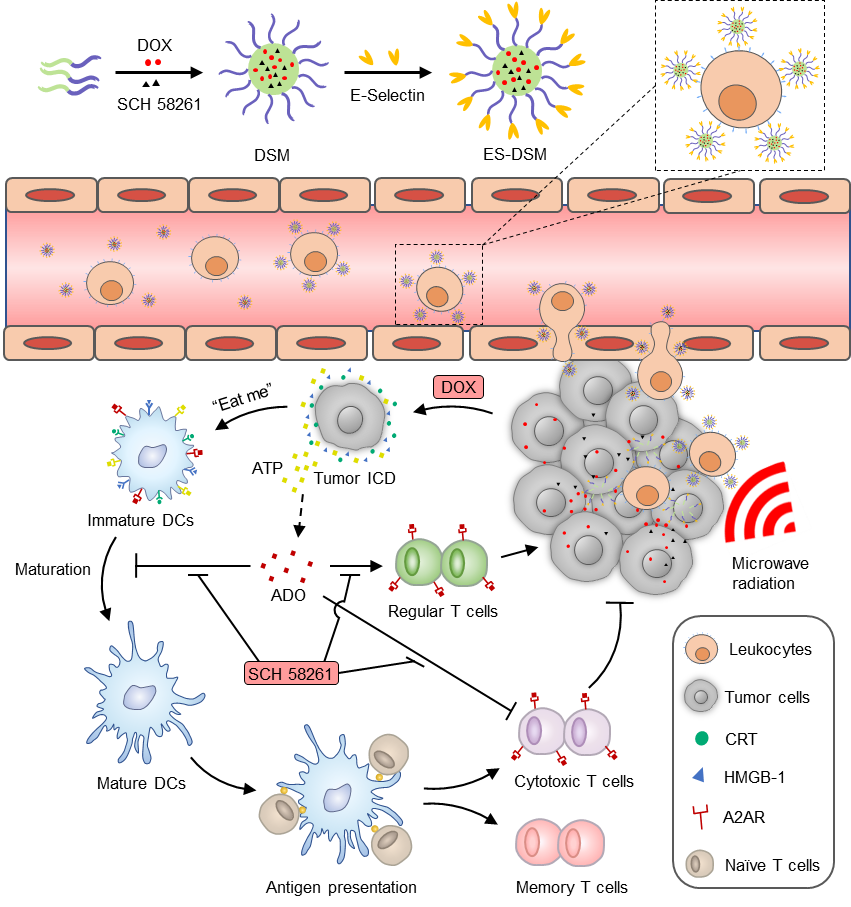
本研究利用温敏性胶束共载ICD诱导剂和A2AR拮抗剂,利用白细胞为运载工具,实现药物的肿瘤高效靶向,在提高肿瘤免疫原性的同时,缓解免疫抑制微环境,为肿瘤治疗提供了一种双管齐下的策略。
本课题受到国家重点研发计划“政府间国际科技创新合作”项目和浙江省自然科学基金重大项目的支持。本文第一作者为2016级博士生祁菁和2017级博士生金斐旸,通讯作者为我院杜永忠教授和徐晓玲博士、浙大丽水医院纪建松教授和浙大医学院附属第一医院吴李鸣教授。
参考资料:http://www.cps.zju.edu.cn/2021/0812/c26425a2414842/page.htm
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn