


该研究是一项在全球开展的评估Buparlisib联合紫杉醇或紫杉醇单独治疗复发性或转移性头颈部鳞状细胞癌疗效和安全性的随机、开放、多中心的III期临床研究。主要研究终点是患者总生存期。本研究计划在北美、欧洲及亚太的15个主要国家和地区中的150多家研究中心招募近500位头颈部鳞状细胞癌患者,入组标准包括曾接受过PD-1/PD-L1单药治疗,PD-1/PD-L1联用铂类化疗或按序列接受PD-1/PD-L1治疗和含铂类化疗(无论先后顺序)后出现疾病进展的患者。
头颈部鳞状细胞癌的全球发病率居恶性肿瘤第八位,死亡率居第十二位,每年新发约84万例。近年来,尽管免疫检查点抑制剂的出现给头颈部鳞状细胞癌患者带来了显著的临床获益,但其单药或联合化疗治疗复发性或转移性头颈部鳞状细胞癌总体反应率不高。对于使用免疫检查点抑制剂后没有响应或出现疾病进展的患者,目前尚无其他治疗选择且这类患者数量正在逐年增加。因此,临床亟需探索更多有效的治疗方式,提高患者整体生存获益。
全球头颈癌研究领域知名专家、该研究牵头人Denis Soulières教授表示:“此前已完成的全球II期临床试验结果显示Buparlisib(AN2025)具有良好的安全性和有效性,此次全球III期临床试验的目标是为经免疫治疗或免疫治疗与含铂类化疗联合使用后出现进展的患者,为其提供比紫杉醇更有效的治疗方式。”
“头颈部鳞状细胞癌近几年取得了很大的突破,但对于复发或转移性的患者来说仍存在未被满足的需求。该研究有望改变头颈部鳞状细胞癌二线治疗格局,为中国及全球患者提供全新的治疗选择。”同济大学附属东方医院一期临床试验中心主任,中国临床肿瘤学会头颈肿瘤专委会主委,郭晔教授指出,“作为医生很欣慰地看到越来越多的研究在中国开展并参与其中,在中国开展试验能精准的反映中国人群状态,为临床研究积累更多数据与经验,推动中国头颈癌诊疗进展。”
阿诺医药首席医学官Lars Birgerson博士表示:“与世界顶尖研究人员合作开展临床试验是阿诺医药全球化的开发策略中非常重要的部分。我们希望阿诺医药的产品能够在这样的合作下高效地进入市场,以惠及更多的患者及家庭。根据此前已完成的全球II期临床试验结果显示使用Buparlisib(AN2025)后患者的中位生存期高达10.4个月,获得了美国FDA授予的快速审批通道资格,该药物有望成为头颈癌治疗领域首个上市的PI3K抑制剂,为头颈癌治疗带来新的思路。”
关于头颈部鳞状细胞癌
头颈部鳞状细胞癌的全球发病率居恶性肿瘤第八位,约占所有头颈癌的90%。 2020年,头颈部鳞状细胞癌的全球发病人数约84万,预计到2030年将上升至约100万。流行病学数据显示,50%-60%的头颈部鳞癌患者在确诊时已发展为局部晚期,同时50%-60%的患者在两年内会出现复发。复发或转移性头颈部鳞癌通常预后差、死亡率高。免疫检查点抑制剂的出现给患者带来了生存获益,但也有部分患者经PD-1/PD-L1或PD-1/PD-L1联用化疗后没有响应,且这一部分的比例正逐渐上升。目前全球尚无能满足这类患者需求的候选药物进入注册性临床阶段,AN2025有望成为全球第一个上市的相关药物。
关于BURAN研究
BURAN研究是一项随机、开放、多中心的III期研究,旨在评估Buparlisib(AN2025)(一日一次)联合紫杉醇(一周一次)与紫杉醇单独治疗(一周一次)复发性或转移性头颈部鳞状细胞癌(HNSCC)的疗效和安全性。入组患者标准包括曾接受过PD-1/PD-L1单药治疗,PD-1/PD-L1联用铂类化疗或按序列接受PD-1/PD-L1治疗和含铂类化疗(无论先后顺序)后出现疾病进展的患者。
关于Buparlisib (AN2025)
Buparlisib (AN2025)是一种口服的泛PI3K抑制剂,针对所有的I类PI3K亚型,在血液恶性肿瘤和实体瘤中均表现出抗肿瘤活性。在其治疗头颈部鳞状细胞癌(HNSCC)的全球II期临床试验(BERIL-1)中,患者的中位生存期高达10.4个月,获美国FDA授予的快速审批通道资格并获批开展III期临床试验。目前,Buparlisib针对HNSCC的全球多中心III期临床试验已经启动。
关于阿诺医药
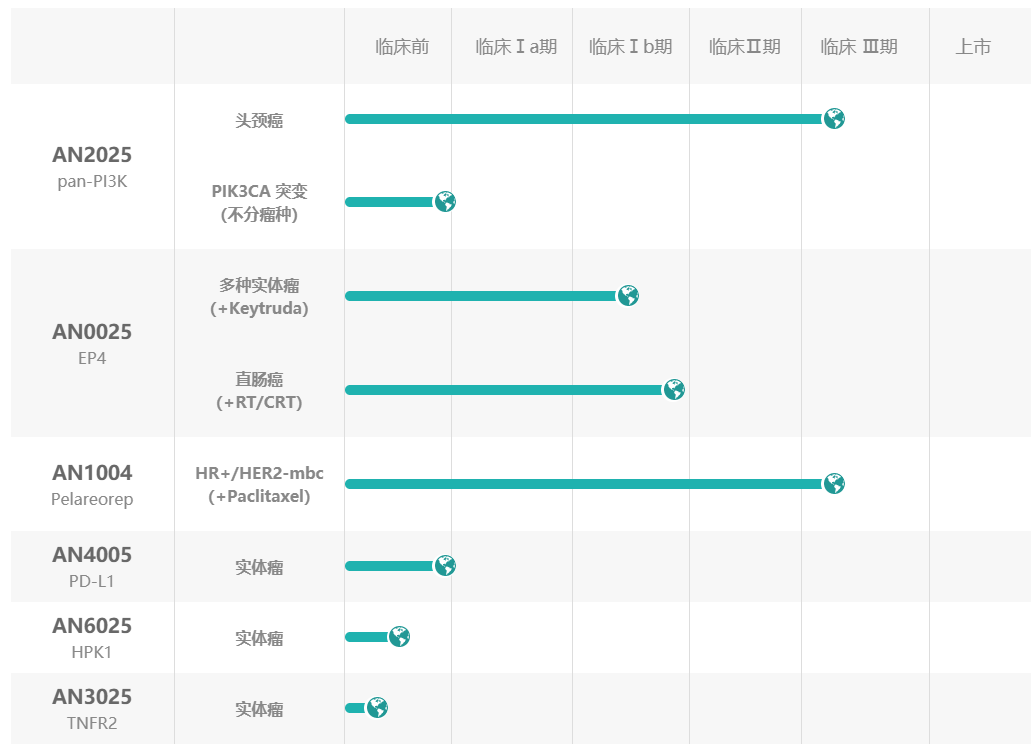
阿诺医药是一家临床阶段的专注于创新型肿瘤药物开发的全球性生物制药公司,在中美两地均设有研发及临床运营中心。阿诺医药通过“联合创新”和“自主研发”的模式构建起一条全球化的产品管线,目前涵盖10余种抗肿瘤候选药物。其中有3款药物现处于临床阶段,分别是已获得 FDA 快速通道资格的AN2025(Buparlisib)项目,正在开展全球多中心3期临床试验;同样获得 FDA 快速通道资格的可通过静脉注射给药的溶瘤病毒 AN1004(Pelareorep)项目,已完成2期临床试验;针对多种实体瘤现处于早期临床开发中的口服EP4拮抗剂(AN0025)项目,目前正在尝试与其他治疗方案(包括化放疗和PD-1 /PD-L1抑制剂疗法)联合使用。
阿诺医药已组建了一支具有竞争力的管理团队,并搭建了独特的药物开发技术平台,同时与全球多家顶尖制药企业建立了战略合作关系。阿诺医药致力于成为打造“全球新”肿瘤药物的创新型研发企业,为中国乃至全球患者带来更有效的治疗方式,实现将癌症变成一种非致命疾病乃至治愈的使命。欲了解更多,请访问www.adlainortye.com。
参考文献:
1. Sung, H. Ferlay, J. Siegel, R. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries, 2021 Feb 4.
2. 陈曦, 乔明哲. 免疫检查点抑制剂在复发或转移性头颈鳞癌的治疗进展. 山东大学耳鼻喉学报. 2019年5月, 第33卷, 第3期.
声明:
1. 该适应症尚未在中国获批
2. 阿诺医药不推荐任何未获批的药品/适应症使用
3. 仅供医疗卫生专业人士交流使用
参考资料
[1] 阿诺医药宣布Buparlisib(AN2025)治疗复发性或转移性头颈癌的全球III期临床完成首例患者给药http://www.adlainortye.com/index.php/newsInfo?id=80
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn