

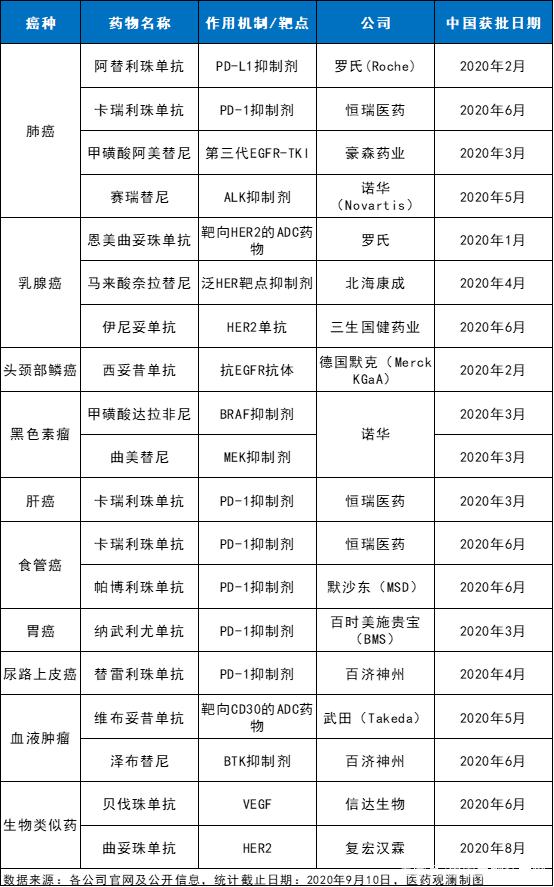
根据会上分享,截止2020年9月10日,已经有17款抗癌创新药在中国获批上市,包括PD-1/L1抑制剂、抗体偶联药物(ADC)、第三代EGFR-TKI等不同作用机制的创新疗法,以及2款生物类似药,涵盖肺癌、乳腺癌、头颈部鳞癌、黑色素瘤、肝癌、胃癌、套细胞淋巴瘤等多种癌症。
值得一提的是,这些获批的创新药意义非凡。其中,至少五款创新药为所获批适应症领域的首个,例如,中国广泛期小细胞肺癌患者迎来了首款免疫疗法,中国头颈部鳞癌患者迎来了首款获批的靶向药物等等。此外,在过去的九个月多月里,中国还迎来了两款ADC药物、首个中国国产第三代EGFR-TKI、以及首个中国国产BTK抑制剂等。本文中,我们将带大家走进这些创新抗癌药物,看看它们都给癌症患者带来了哪些获益。
2020年在中国获批上市的抗癌创新药(截止9月10日)
注:每个癌种获批的新药数量根据CDE相关负责人在2020年CSCO上的公开PPT资料整理。如有遗漏,欢迎在后台留言指出。
肺癌
无论是在全球范围,还是在中国,肺癌的发病率和死亡率都高居“众癌之首”。肺癌分为非小细胞肺癌(NSCLC)和小细胞肺癌(SCLC),其中NSCLC占了80%-85%。在获批的抗癌新药中,有四款针对的是肺癌,涵盖的适应症包括广泛期小细胞肺癌、T790M突变阳性的NSCLC、ALK阳性NSCLC、非鳞NSCLC。
今年2月,中国广泛期小细胞肺癌患者迎来了首款免疫疗法。罗氏(Roche)旗下的PD-L1单抗阿替利珠单抗获批联合化疗用于一线治疗广泛期的小细胞肺癌,成为中国首个获批该适应症的肿瘤免疫疗法。3期临床试验IMpower133研究数据显示,对比化疗手段,阿替利珠单抗联合化疗可以显著延长小细胞肺癌患者的总生存,降低该研究受试患者死亡风险30%。根据罗氏早前发布的新闻稿,IMpower133研究是30年来广泛期小细胞肺癌一线治疗的首次重大突破。
同时,经EGFR-TKI治疗进展且T790M突变的NSCLC患者也迎来了新的选择。今年3月,豪森药业的第三代EGFR-TKI阿美替尼获NMPA批准上市,治疗既往经EGFR-TKI治疗进展且T790M突变阳性的局部晚期或转移性NSCLC成人患者。值得一提的是,这不仅是首个获批的中国国产第三代EGFR- TKI,也是全球范围第二个获批上市的第三代EGFR- TKI。临床研究数据显示,阿美替尼单药治疗显示出优异的疗效和安全性:患者的中位无进展生存期(mPFS)达12.3月;患者的客观缓解率(ORR)达68.9%,疾病控制率(DCR)达93.4%;而且能够有效控制脑部病灶,脑转移患者ORR达61.5%。
今年5月,间变性淋巴瘤激酶(ALK)阳性NSCLC患者也迎来了新的一线治疗选择。诺华(Novartis)公司的ALK抑制剂赛瑞替尼获批用于ALK阳性的局部晚期或转移性NSCLC患者的一线治疗。此外恒瑞医药的PD-1抗体卡瑞利珠单抗也获批联合培美曲塞加卡铂一线治疗晚期或转移性非鳞非小细胞肺癌。
乳腺癌
乳腺癌是女性发病率最高的恶性肿瘤。根据中国国家癌症中心2019年发布的报告显示,2015年中国乳腺癌新发患者数为30.4万人,其中20%~25%的乳腺癌患者为HER2阳性患者。今年,中国HER2阳性乳腺癌迎来了三款创新疗法。
其中,罗氏公司的恩美曲妥珠单抗是一种抗体偶联药物(ADC):它的一端是靶向HER2的抗体曲妥珠单抗(赫赛汀的主要活性成分),另一端是化疗药物DM1。该药于今年1月获得NMPA批准,单药适用于接受了紫杉烷类联合曲妥珠单抗为基础的新辅助治疗后、仍残存侵袭性病灶的HER2阳性早期乳腺癌患者的辅助治疗,成为了首款在中国获批上市的ADC药物。
研究显示,恩美曲妥珠单抗组患者辅助治疗后3年内,无侵袭性癌生存率达到88.3%,而曲妥珠单抗单药组为77%。此外,对于新辅助治疗手术后仍有残存病灶的HER2阳性乳腺癌患者,恩美曲妥珠单抗能够进一步降低50%的疾病复发及死亡风险。
另外两款药物分别为来自北海康成的马来酸奈拉替尼片、三生国健药业的伊尼妥单抗,前者获批的适应症为既往接受曲妥珠单抗辅助治疗的HER2阳性早期乳腺癌患者的强化辅助治疗,后者获批的适应症为HER2阳性的转移性乳腺癌。
头颈部鳞癌
今年,中国头颈部鳞癌患者终于迎来了首款获批的靶向药物。2020年3月,德国默克(Merck KGaA)的抗EGFR抗体西妥昔单抗获NMPA批准,与铂类和氟尿嘧啶化疗联合,用于一线治疗复发和/或转移性头颈部鳞状细胞癌。根据德国默克早前发布的新闻稿,这西妥昔单抗这一新适应症的获批,打破了中国复发和/或转移性头颈部鳞状细胞癌患者30年来铂类化疗效果不佳的困局,填补了头颈部鳞癌领域靶向治疗的空白。
头颈部鳞癌是常见的恶性肿瘤之一。大部分患者就诊时已到局部晚期阶段,经过手术、放化疗后仍有很高比例的患者会发生局部复发和/或远处转移。研究结果表明,西妥昔单抗联合铂类为基础的化疗显著改善了无进展生存期(PFS,5.5个月vs 4.2个月)、总生存期(OS,11.1月vs 8.9个月)和客观缓解率(ORR,50% vs 26.6%)。在安全性方面,西妥昔单抗并没有显著增加化疗的毒副反应。
黑色素瘤
黑色素瘤由黑色素细胞基因突变引起的一种病,虽然在所有皮肤癌中,黑色素瘤约占1%,但却是皮肤癌患者死亡的主要原因,因此被称为“皮肤癌之王”。今年3月,黑色素瘤患者新来了一款新的疗法——诺华的达拉非尼/曲美替尼联合疗法,该联合疗法获NMPA批准用于BRAF V600突变阳性的3期黑色素瘤患者完全切除后的辅助治疗。
达拉非尼是一种强效和选择性BRAF激酶活性抑制剂,曲美替尼片是一种可逆的、高选择性MEK1和MEK2激酶活性的变构抑制剂。这两种药物联合使用,可以同时抑制BRAF和MEK两个靶点,达到比单药更好的效果。多项全球关键性临床研究结果显示,对比靶向单药治疗,达拉非尼和曲美替尼联合使用可帮助晚期BRAF V600突变黑色素瘤患者,得到更高的疾病缓解,实现更长的无进展生存。
肝癌
在肝细胞癌领域,今年迎来了首款肝癌PD-1免疫疗法。肝癌是世界上导致癌症死亡的第二大癌症类型,全世界每年有80万名新患者,超过70万患者因此而去世。中国更是肝癌的大国之一。在此之前,中国尚未有同类PD-1/L1单抗获批肝细胞癌适应症,恒瑞医药自主研发的PD-1抑制剂卡瑞利珠单抗(艾瑞卡)打破了这一局面。它在今年3月被NMPA批准用于接受过索拉非尼治疗和/或含奥沙利铂系统化疗的晚期肝细胞癌患者的治疗。
根据发表于《柳叶刀•肿瘤学》卡瑞利珠单抗单药用于晚期经治肝癌的研究结果,来自全国13家医院的220位肝癌患者参与研究,数据显示卡瑞利珠单抗治疗后客观缓解率14.7%,6个月生存率74.4%,12个月生存率55.9%,中位生存期13.8个月;且研究显示候选药具有良好的安全性,患者耐受性良好。
食管癌
食管癌是在中国较为常见的一种恶性肿瘤。据统计,每年中国新发食管癌病例数和死亡病例数占全球一半以上,其中90%以上为食管鳞癌。今年6月,中国食管癌领域迎来了两款创新药,分别是恒瑞医药的卡瑞利珠单抗和默沙东(MSD)的帕博利珠单抗。其中,帕博利珠单抗被批准单药用于通过充分验证的检测评估肿瘤表达PD-L1(综合阳性评分(CPS)≥10)的、既往一线全身治疗失败的、局部晚期或转移性食管鳞状细胞癌(ESCC)患者的治疗。
卡瑞利珠单抗被批准用于既往接受过一线化疗后疾病进展或不可耐受的局部晚期或转移性食管鳞癌患者的治疗。根据一项名为ESCORT的多中心3期临床研究,卡瑞利珠单抗相比化疗可显著延长患者的中位OS(8.3个月vs 6.2个月),降低死亡风险近30%,同时ORR更高(20.2% vs 6.4%),持续缓解时间更长(7.4个月vs 3.4个月)。更重要的是,卡瑞利珠单抗在所有人群中均可获益。根据恒瑞医药公告,该产品因此在中国独家获批了全人群的适应症。
胃癌
在中国,胃癌已成为仅次于肺癌的第二大癌种,其发病与死亡数均占全球近50%。约80%的中国胃癌患者确诊时已是晚期 ,可选择的治疗方案少且疗效存在局限。今年3月,中国迎来首个胃癌免疫疗法——百时美施贵宝(BMS)的PD-1抑制剂欧狄沃(纳武利尤单抗注射液)。它被NMPA批准用于治疗既往接受过两种或两种以上全身性治疗方案的晚期或复发性胃或胃食管连接部腺癌患者。这一获批突破了中国胃癌治疗“后线缺药”的僵局,对于重振晚期胃癌治疗信心具有重要意义。
根据公开资料,此次获批基于一项名为ATTRACTION-2的3期临床研究,这是全球首个启动的胃癌免疫肿瘤治疗3期临床试验,纳入人群均为东亚(包括中国台湾、日本和韩国)患者。结果显示,与研究选择的对照组相比,欧狄沃可使死亡风险降低38%,一年生存率翻倍,达27.3%。同时,中国台湾人群数据与整体人群结果相一致,与对照组相比,纳武利尤单抗注射液可显著降低死亡风险达51%,明确了其对于中国胃癌患者的附加价值。
尿路上皮癌
尿路上皮癌是目前最常见的一种膀胱癌,占膀胱癌病例90%以上。对于中国晚期尿路上皮癌患者而言,现有治疗方案十分有限。今年4月,中国尿路上皮癌领域迎来了一款创新疗法——百济神州的抗PD-1抗体药物百泽安(替雷利珠单抗注射液)。它被NMPA批准用于治疗接受含铂化疗失败包括新辅助或辅助化疗12个月内进展的局部晚期或转移性PD-L1高表达的尿路上皮癌(UC)患者。值得一提的是,这也是中国第一个获批尿路上皮癌适应症的PD-1单抗。
根据公开信息,该批准是基于一项在中国和韩国开展的用于治疗既往接受过含铂化疗且PD-L1高表达的局部晚期或转移性UC患者的单臂、多中心、关键性2期临床试验。在符合疗效评估的患者中,中位随访时间为14个月时,经独立评审委员会(IRC)根据RECIST实体瘤疗效评估标准1.1版评估的ORR为24.8%,完全缓解(CR)率为9.9%。安全性数据来自参与四项百泽安单药临床试验的934位患者。
血液肿瘤
在血液肿瘤领域,今年迎来了2款创新产品,分别是武田(Takeda)旗下全新的抗体偶联药物(ADC)维布妥昔单抗,和百济神州BTK抑制剂百悦泽(泽布替尼)。值得一提的是,2款新药的获批都具有一定临床意义。
其中,维布妥昔单抗为血液肿瘤领域获批的首款ADC药物,它在中国获批用于成人CD30阳性的复发或难治性系统性间变性大细胞淋巴瘤(sALCL)和复发或难治性经典型霍奇金淋巴瘤(cHL)的治疗。该产品在3项研究中的表现也极为亮眼:针对复发或难治性sALCL,58例患者中97%可实现肿瘤缩小,其5年生存率提高至60%;针对复发或难治性cHL,94%的患者可实现肿瘤缩小,其中位OS从历史27.6个月提升至40.5个月;针对二线及以上复发或难治性cHL患者,ORR为50%。
泽布替尼则是首款获批的中国国产BTK抑制剂,且同时被NMPA批准2项血液肿瘤适应症,分别用于治疗既往至少接受过一种疗法的成人套细胞淋巴瘤(MCL)患者,和既往至少接受过一种疗法的成人慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)患者。其中,针对中国R/R CLL患者总缓解率超过60%;针对R/R MCL患者总缓解率为83.7%,其中完全缓解率达68.6%。
生物类似药
今年以来,我们也见证了中国生物医药产业在生物类似药研发和生产领域的蓬勃发展,正在迈向快速发展阶段。公开资料显示,有2款抗肿瘤生物类似药于今年首次在中国获批,分别为信达生物的贝伐珠单抗生物类似药(达攸同)和复宏汉霖的曲妥珠单抗生物类似药(汉曲优)。
值得一提的是,复宏汉霖的汉曲优是首个登陆欧洲市场的“中国籍”单抗生物类似药,也是中国首个曲妥珠单抗生物类似药。它在中欧两地均获得了原研产品已获批准的所有适应症:1)HER2阳性早期乳腺癌;2)HER2阳性转移性乳腺癌;3)HER2阳性转移性胃癌。根据近日复宏汉霖在2020年欧洲肿瘤医学协会会议(ESMO)上分享的3期研究最新临床数据,汉曲优与原研曲妥珠单抗在HER2阳性转移性乳腺癌患者上的疗效、安全性和药代动力学相当。
注:本文旨在介绍医药健康研究进展,不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
参考资料:
[1]重磅!泰圣奇®在华获批!中国广泛期小细胞肺癌患者迎来首个免疫疗法!Retrieved Feb 13,2020 from https://mp.weixin.qq.com/s/ChuExsjKIfWehcOkvjSDVg
[2]豪森药业阿美乐(R)获批,全球第二个三代EGFR-TKI创新药Retrieved March 19 ,2020,from https://www.prnasia.com/story/275416-1.shtml
[3]各公司官网,及官方公开资料
文章来源:医药观澜(ID:yiyaoguanlan)
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn